曹访 刘莉 采克俊 吴成龙 周俊波
摘要:采用转录组高通量测序方法,比较分析幼龄翘嘴红鲌精巢、卵巢组织中小RNA转录谱。结果显示,精巢、卵巢的小RNA分布的峰值分别为28、29 nt,与一般物种的22~24 nt有较大的差异;在小RNA库中,经比对注释的比例很低,分别为2.5%、2.1%。在比对注释的斑马鱼miRBase、斑马鱼ncRNA、piRNA、Rfam数据库中,精巢组织中被miRBase数据库注释的比例最高,为1.49%;而卵巢组织中被miRBase和piRNA数据库注释的比例接近,分别为094%和0.96%。比较表达量相对较高的共有miRNA分子,均是与胚胎发育相关的分子,且大多是精巢组织的表达量高于卵巢组织,这些miRNA分子在个体发育中可能具有重要意义。初步获得了翘嘴红鲌不同性腺组织的转录谱,为今后进一步分析小RNA在生殖发育中的调控作用奠定了基础。
关键词:翘嘴红鲌;精巢;卵巢;miRNA;转录谱;分析;比较
中图分类号: S917.4
文献标志码: A
文章编号:1002-1302(2020)02-0077-06
收稿日期:2018-10-17
作者简介:曹 访(1980—),男,江苏丰县人,硕士,高级实验师,研究方向为动物遗传育种与繁殖。E-mail:hzyzucf@hotmail.com。
生物体内的小分子非编码RNA通过转录和转录后调节形成遗传信息的表达调控网络,在细胞的分裂分化、个体生长发育和繁殖等生命活动过程中具有重要的作用。已发现的这类小RNA包括siRNA(small interfering RNA)、miRNA(microRNA)、hsRNA(heterochromatin associated small RNA)和piRNA(piwi interacting RNA)等。发掘新的小分子非编码RNA、研究其生物学功能及作用机制在生命科学研究中具有重要意义,目前研究较多的是miRNA。鱼类的miRNA也已在斑马鱼、红鳍东方鲀等几个模式种以及非模式鱼类的虹鳟鱼中被发现报道[1-2]。
miRNAs是一类非编码、长度约22 nt的小RNA分子,由60~80 nt的茎环前体分子衍生而来,广泛存在于动物、植物甚至病毒中。miRNAs通过调节靶标mRNAs的稳定性和翻译效率,在基因的表达中起着非常重要的作用,影响着各个生理过程,包括代谢、细胞凋亡、神经系统发育、免疫防御、肿瘤病理过程等。自从1993年首次在秀丽线虫中发现miRNA(lin-4)以来[3],有大量关于miRNAs的生物合成、功能和作用机制的研究[4-6]。尽管miRNAs的作用早已发现,但有关miRNA转录组的研究最近几年才开始。过去主要是通过直接克隆、测序、northern blot杂交分析等鉴定逐个对miRNAs鉴定。但这一方法对于含量较低的、表达水平变化幅度大的、瞬时表达的、与不同发育阶段相关的miRNAs的分析具有很大的局限性。这也解释了小规模测序主要揭示保守miRNAs分子,而对于低水平的非保守miRNAs却难以分析,高通量测序方法使非保守的、弱表达的、种特异性的miRNAs的分析成为可能。piRNAs是近年来新发现的一类非编码小RNA,具有组织特异性,调控着生殖细胞和干细胞的生长发育,对物种的遗传和维持至关重要,已在人、果蝇、斑马鱼等动物的生殖细胞中发现了这类小分子[7-9]。
现有的鱼类生殖发育研究主要集中在斑马鱼、青鳉鱼等模式物种上,而养殖鱼类相关研究甚少,其原因与相关遗传背景是否清楚有关。但鱼类属低等脊椎动物,物种差异大,其生殖发育复杂多样,对模式生物的研究成果难以套用到养殖品种中。我国作为水产大国,很多研究者已经认识到这一点。翘嘴红鲌(Erythroculter ilishaeformis)是一种鲤科淡水鱼类,分布较为广泛,俗称白鱼,长江下游俗称“太湖白鱼”,是“太湖三白”之一。其肉质细嫩、营养丰富,是鱼中上品,市场价格较高。天然水域的生产量已很低,野生资源日益减少。目前已建立了翘嘴红鲌的人工繁殖技术和大规模的人工养殖技术。笔者前期的初步研究发现,雌性翘嘴红鲌的卵巢发育较雄性精巢发育早,其生长也较早。针对这一名优特色鱼种开展生殖细胞的基础生物学研究,对于品种进一步的开发利用及保护天然翘嘴红鲌的野生资源等都有重要的意义。本研究选取幼龄翘嘴红鲌的性腺开展了小RNA转录组的分析比较,为今后进一步开展生殖细胞发育及性别调控研究等奠定基础。
1 材料与方法
1.1 组织收集与总RNA制备
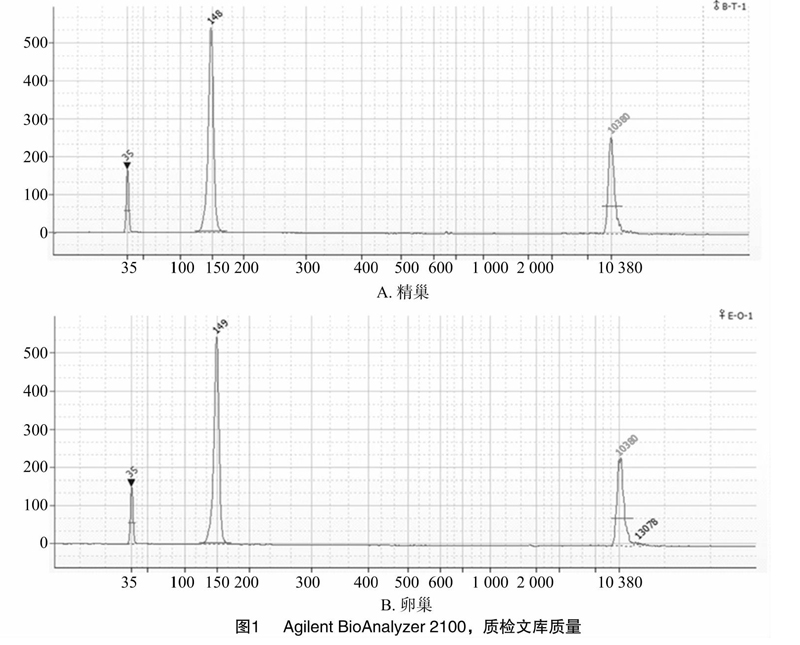
分别取5月龄的3尾雌性及3尾雄性翘嘴红鲌的性腺组织各1 g,迅速在液氮中速冻。研磨后,分别将3尾雌鱼和3尾雄鱼的组织样品混合,用TRIzol reagent(Life Technologies公司)试劑提取总RNA。提取的RNA经紫外分光光度计、1%琼脂糖电泳和Agilent BioAnalyzer 2100进行质检(安捷伦科技有限公司)。
1.2 小RNA文库的建立
采用miRNA提取试剂盒mirVanaTM miRNA isolation kit(Ca#t.AM1560 Austin TX,Thermo Fisher,US)从上述提取的总RNA中富集小RNA。之后,先在小RNA的5′和3′末端添加1对接头序列,再用于接头互补的序列作为引物进行RT-PCR。扩增的cDNA经6% PAGE胶纯化后,使用Qubit 2.0 Fluorometer检测浓度,Agilent2100检测文库的大小。由测序仪Illumina Genome Analyzer GA-IIX(Illumina公司)进行高通量测序。测序质量要求每向碱基质量大于20(Q20)的比例不小于85%。
1.3 生物信息学分析
原始的测序数据以去除低质量读长以及将含接头序列且大于18 nt序列为可用的读长作为数据过滤的依据,所用软件为CLC genomic workbench(商业软件版本号5.5)。经过滤的small RNA序列与公共数据库比对去除rRNA、tRNA、small nuclear RNA(snRNA)and small nucleolar RNA(snoRNA),余下的序列再与miRBase、ncRNA、piRNA、Rfam等数据库进行比对分析。此外,应用sRNA Toolkit软件包里的miRCat工具来预测novel miRNA;应用miRanda软件对miRNA序列以及所测序物种的cDNA序列进行可能的靶位点预测;用DEGseq R语言包结合perl脚本将样品的表达量进行比较分析。
2 结果与分析
2.1 总RNA制备与小RNA文库的质量评价
提取精巢和卵巢混合样品的总RNA的D260 nm/D280 nm分别为2.05和2.02,表明其纯度较好。但同样组织量精巢样品提取的总RNA量明显低于卵巢的总RNA提取量,且5S的量较高。推测这可能与雌鱼较雄鱼发育快有关。此外,Agilent BioAnalyzer 2100质检结果中RIN值大于8,也表明提取质量合格。
构建的小RNA文库经Qubit 2.0 Fluorometer检测,精巢、卵巢的小RNA的cDNA文库浓度分别为32.6、10.6 ng/μL,主峰长度分别为148、149 bp(图1)。单端测序,读长50 nt,测序所用Flow cell为Illumina Single Read Flow cell V4,测序结果显示精巢和卵巢的Q20值的百分比分别为97.4%和976%,表明测序数据可用于后续的数据分析。
2.2 数据预处理与长度分布统计
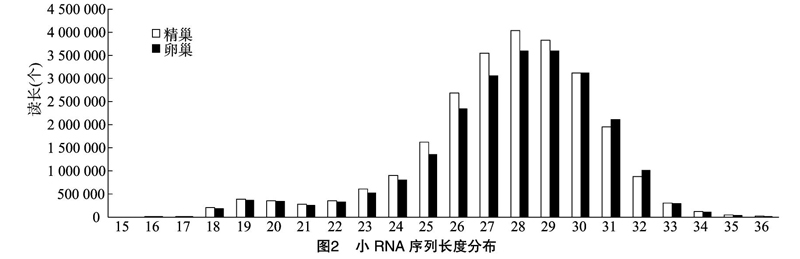
本研究采用Illumina/Solexa深度测序技术对幼龄翘嘴红鲌的精巢和卵巢的小RNA库进行了测定。应用 CLC genomics_workbench 5.5软件对测定的数
据进行预处理,主要是弃去仅含接头序列、低质量序列、长度小于15 nt和大于33 nt的序列等。此外,还须排除已知的mRNA,rRNA,tRNA,snRNA,snoRNA和重复序列元件。测定的精巢小RNA原始读长(reads)为24 752 792个,可用于后续分析的高质量有效读长20 167 240个,占81.47%;卵巢小RNA的原始读长为 22 947 949 个,其中有效读长为18 198 879个,占79.31%。精巢小RNA的序列大小分布的峰值在28 nt,卵巢小RNA的峰值在29 nt(图2)。
2.3 比对注释,鉴定已知miRNA
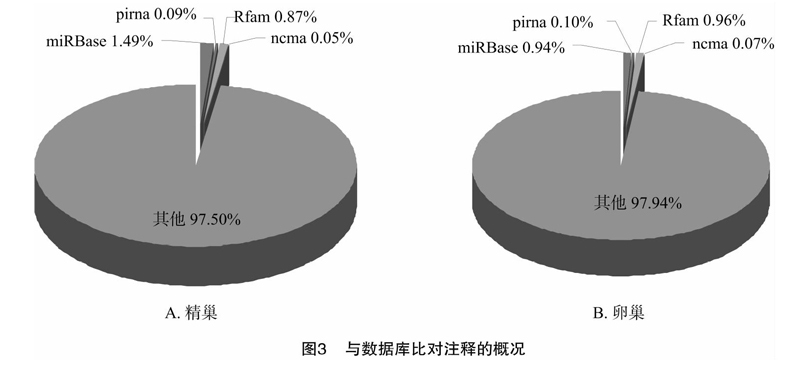
上述处理后的序列与最新Sanger miRBase数据库比对,比对过程不允许有错配。另外还与其他非编码数据库ncRNA、piRNA、Rfam数据库比对,允许与目标序列有2个碱基错配、允许比目标序列两端各缩短或延长2个碱基。比对结果(图3)表明,精巢的有效读长序列中,被注释的读长有502 823个,占2.5%,其中与斑马鱼miRBase、斑马鱼ncRNA、piRNA、Rfam数据库比对注释的读长所占比例分别为 1.49%、0.87%、0.09%、0.05%;而卵巢组织中被注释的读长有374 895个,占2.1%,被上述数据库注释的比例分别为0.94%、0.10%、0.96%、0.07%。
用DEGseq R语言包结合perl脚本将精巢和卵巢样品的表达量进行鉴定和比较分析。2个样品的小RNA中,有219个miRNA与斑马鱼miRBase已知miRNA相同,但其表达量有差异。其中有9个miRNA在精巢组织中可找到,在卵巢中没有找到;有4个在卵巢中有而在精巢中没有,但这13个miRNA的表达丰度都极低。在已知miRNA中,较高表达丰度的miRNA分子在精巢中的表达绝大部分都高于卵巢(图4)。
2.4 新microRNA分子的预测
应用sRNA Toolkit软件包中的miRCat工具来预测novel miRNA。microRNA前体的标志性发卡结构能够用来预测新的microRNA。将没有注释的读长(样品名_unannotated.csv)比对到斑马鱼基因组后,通过折叠模型分析,若有序列位于茎环结构上,则初步判定该序列为1个候选的新microRNA。按上述方法在精巢组织中预测到76个新microRNA,卵巢组织中预测到77个,其中50个相同。预测新microRNA序列,见表1。在这些预测的新microRNA分子中,仅在精巢和卵巢共有序列中有4个序列具有对应的miRNA*序列,分别是第1、第2、第30号序列,它们对应的miRNA*序列分别为:AUGAAGGUCAAUGGUUAvCCvAGU(dre-miR-7146-3p)、GAUCAUUUUUGUGAUUAUGCAGCU(dre-miR-153c-3p)、UCACAGUGAACCGGUCUCUUUU(dre-miR-128-3p)。
3 讨论
鱼类养殖中所涉及的苗种繁育、性别控制等问题与鱼类生殖细胞的发育分化密切相关。此外,鱼类属低等脊椎动物,其生殖发育较高等脊椎动物具有更丰富的多样性。结合现代生命科学技术,弄清楚水产养殖鱼类的基础生物学问题,是进行现代育种、建设现代渔业的重要环节。本研究就具有地方特色的名优水产养殖品种翘嘴红鲌的性腺小RNA转录谱进行了初步的分析。笔者在研究中发现,尽管笔者所用材料均为5月龄翘嘴红鲌性腺,但通过组织切片观察其性腺发育阶段明显不同。该阶段精巢组织中还未见游离精子,而卵巢组织中已见游离的卵子;提取总RNA时也发现,卵巢组织总RNA中5S RNA的含量很高。目前,已有翘嘴红鲌全雌育种技术的应用,主要是利用雌性生长较雄性快的特点,从其性腺的发育来看,也是雌性发育较雄性早。
从获得的小RNA数据与现有数据库比对结果来看,可注释的序列比例非常低,97%以上的序列无法注释,这一方面反映了鱼类基因组信息的多样性,另一方面也提示模式生物的遗传信息对于鱼类基因组、转录组等研究具有较大的局限性。在小RNA序列分布中,发现其峰值在28~29 nt,这一值较其他物种明显偏高。已报道的其他物种小RNA大小分布的峰值一般在22~24 nt,也有报道在 26 nt[10]。仔细校验测序过程,证实其样品制备及测序质控均符合要求,说明该结果与物种有关。但是否因其特殊的发育阶段导致,还须与其他发育阶段的小RNA转录组比较。
在被注釋的已知miRNA中,miR-181a-5p、mir-143-1、mir-92a-1、mir-26a-1、miR-146a、mir-10b-1、mir-22a、mir-21-1、mir-10c、let-7a-1等这些表达量较高的miRNA分子,均与斑马鱼的个体发育密切相关[11-12]。此外,在小RNA转录谱已比对注释的分子中,精巢miRNAs所占比例最高,为1.49%,而卵巢中已注释的miRNAs和piRNAs所占比例接近,分别为0.94%和0.96%,这可能也与同一年龄的精巢和卵巢组织实际上是处于不同的发育阶段有关,其中miRNAs和piRNAs的消长规律值得进一步探讨。
4 结论
本研究采用转录组高通量测序方法,比较分析了幼龄翘嘴红鲌精巢和卵巢组织中小RNA转录谱,由于没有翘嘴红鲌基因组信息,新miRNA的预测只能以斑马鱼基因组信息为基础展开。结果显示,部分预测的同一个新miRNA分子位于不同的染色体上,由此推测这些成熟的miRNA分子在翘嘴红鲌的基因组中也可能对不同的基因起到调控作用。下一步,笔者可继续比较分析其他不同发育阶段性腺小RNA转录谱,可能找出性别调控的关键miRNAs或piRNAs。
参考文献:
[1]Cheng J,Kricka L J. Biochip technology[M]. Pennsylvania:Harwood Academic Publishers,2001.
[2]Boeddrich A,Burgtorf C,Roest C H,et al. Analysis of the spermine synthase gene region in Fugu rubripes,Tetraodon fluviatilis,and Danio rerio[J]. Genomics,1999,57(1):164-168.
[3]Lee F R C,Feinbaum R L,Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell,1993,75:843-854.
[4]Lu J,Getz G,Miska E A,et al. MicroRNA expression profiles classify human cancers[J]. Nature,2005,435(743):834-838.
[5]Iorio M V,Ferracin M,Liu C G,et al. MicroRNA gene expression deregulation in human breast cancer[J]. Cancer Research,2005,65(16):7065-7070.
[6]Rodriguez A,Vigorito E,Clare S,et al. Requirement of Bic/microRNA-155 for normal immune function[J]. Science,2007,316(5824):608-611.
[7]John B,Enright A J,Aravin A,et al. Human microRNA targets[J]. PLoS Biology,2004,2(11):e363.
[8]Aravin A A,Lagos-Quintana M,Yalcin A,et al. The small RNA profile during Drosophila melanogaster development[J]. Developmental Cell,2003,5(2):337-350.
[9]Thatcher E J,Bond J,Paydar I,et al. BMC genomics[Z]. 2008:253.
[10]Kim V N,Han J J,Siomi M C. Biogenesis of small RNAs in animals[J]. Nature Reviews Molecular Cell Biology,2009,10(2):126-139.
[11]Mishima Y. Widespread roles of microRNAs during zebrafish development and beyond[J]. Development Growth & Differentiation,2012,54(1):55-65.
[12]Wei C Y,Salichos L,Wittgrove C M,et al. Transcriptome-wide analysis of small RNA expression in early zebrafish development[J]. RNA,2012,18(5):915-929.楊亚桐,董安忆,刘松涛,等. 基于SSR分子标记的糯玉米遗传多样性研究[J]. 江苏农业科学,2020,48(2):83-86.
- 关于语文差异教学的几点思考
- 没有爱读先生,何来爱读学生?
- 初中语文听说训练三步曲
- 试论高效语文课堂的教学策略
- 例谈语文课的导入与学生情感的激发
- 落实学生的主体地位
- 从兴趣入手,提高应用文教学水平
- 语文课堂教学应理性引领多元解读
- 《史记·淮阴侯列传》创新教学设计
- 情境创设在初中语文教学中的有效应用研究
- 让学生徜徉在充满语文味的课堂
- 聆听圣贤 善教如水
- 以针对性教学措施破解语文教学制约因素
- 语文诗歌教学中学生鉴赏心理与能力的培养
- 例谈说明文教学中多媒体的有效运用
- “学讲方式”下语文课堂激疑问难摭谈
- 新课程背景下高中语文先学后导教学模式探索
- 头脑风暴法在学习《孔雀东南飞》中的应用
- 文言教学“八开放”
- 让情思在朗读中飞扬
- 《沁园春?长沙》领字质疑
- 一主三层
- 问世间情为何物,直教人生死相许
- 《先秦诸子选读》主问题设计的课例研究
- 《丑小鸭》误读原因分析及教学建议
- overlownesses
- overloyal
- overloyally
- overloyalties
- overloyalty
- overlubricate
- overlubricated
- overlubricates
- overlubricating
- overlubrication
- overlubrications
- overluscious
- overlusciously
- overlusciousness
- overlusciousnesses
- overlush
- overlustiness
- overlustinesses
- overluxuriant
- overluxuriantly
- overluxurious
- overluxuriously
- overluxuriousness
- overluxuriousnesses
- overly
- 卖米不带升——居心不量
- 卖粉团的撞见了敲板儿蛮子叫冤屈——麻饭肐胆的帐
- 卖糖人儿和捏洋号的——能吹
- 卖糖人的——连吹带捏
- 卖糖人的手艺——光靠吹
- 卖糖人的敲锣——生意不大招牌响
- 卖糖带望戏
- 卖糖的不卖醋,卖醋的也别卖糖
- 卖糖的不卖醋,卖醋的也别来卖糖
- 卖絮婆子看冬朝,无风无雨哭号啕
- 卖红薯丢了干粮——硬啃
- 卖红薯的不带秤
- 卖绝
- 卖缺
- 卖羔药
- 卖翘
- 卖翘(俏)
- 卖耀
- 卖老
- 卖老脸
- 卖老资格
- 卖老骨头
- 卖肉刀切豆腐——不在话下
- 卖肉的
- 卖肉的切豆腐——不在话下