娄安钢 季久秀 相思宇 金太花 张睿 崔长艳 关立增

摘要:为研究血液外胞体中miRNA对延边黄牛垂体细胞中生长激素(GH)分泌的影响,本研究选择在延边黄牛和韩延牛血液外胞体中显著差异表达的miR-6523a,利用实时定量PCR(qPCR)和Western Blot技术,研究了miR-6523a对延边黄牛垂体细胞中GH分泌水平的影响及miR-6523a与靶基因间的调控机制。生物信息学分析和双荧光素酶报告基因系统结果显示,miR-6523a靶向了SSTR5的3′非翻译区(UTR);qPCR和Western Blot检测结果显示,与对照组相比,添加miR-6523a-mi能极显著提高延边黄牛垂体细胞中GH mRNA和蛋白的表达(P<0.01),而添加miR-6523a-in,GH mRNA和蛋白的表达有所降低,但和对照组相比差异不显著(P>0.05);与对照组相比,添加 miR-6523a-mi 能极显著抑制SSTR5 mRNA和蛋白的表达(P<0.01),而添加miR-6523a-in,SSTR5 mRNA和蛋白的表达均有所提高,但和对照组相比差异不显著(P>0.05)。本研究表明,miR-6523a可通过调节SSTR5基因的表达而调控垂体细胞中GH的分泌,本研究结果将为研究外胞体miRNA调控动物生长发育机制提供理论依据。
关键词:miR-6523a;延边黄牛;垂体细胞;GH;SSTR5
中圖分类号: S823.8+11文献标志码: A文章编号:1002-1302(2020)13-0202-06
收稿日期:2019-08-11
基金项目:国家自然科学基金(编号:31660614)。
作者简介:娄安钢(1980—),男,吉林延吉人,博士,讲师,主要从事动物的遗传与育种研究。E-mail:1163986278@qq.com。
通信作者:关立增,博士,副教授,硕士生导师,主要从事动物基因的表达与调控研究。E-mail:guanlizeng@163.com。延边黄牛具有生长速度慢、生长周期长和出栏率低等缺点,导致饲料资源浪费和饲养成本提高,这严重制约了延边黄牛养殖业的健康发展[1-3]。因此,如何提高纯种延边黄牛的生长速度、缩短其养殖周期是加快延边黄牛养殖产业快速发展的关键。研究表明,外胞体(exosome)中miRNA对动物的生长发育发挥着重要的调控作用。如Melnik等研究发现,牛乳exosome中的miRNA-21可以促进犊牛的生长[4]。陈婷用来源于猪exosome的 miR-PC-86、miR-PC-263处理C2C12细胞,结果显示二者可调控C2C12细胞上胰岛素样生长因子1受体(IGF-1R)的表达,从而对猪肌细胞生长发挥调控的作用[5]。由此可见,exosome中的一些miRNA可能与动物生长发育存在密切的关系,那么exosome中miRNA是否具有调控延边黄牛生长速度、提高生长效率的作用有待进一步研究。
在动物生长发育过程中,生长轴起着关键的作用[6-7]。而在生长轴中腺垂体分泌的生长激素(GH)是最重要的成分之一[8-9]。因此,为更全面地了解exosome中miRNA在调节延边黄牛生长过程中的作用,本研究在前期工作中选择以延边黄牛和在长发育速度、初生质量及各年龄段体尺体质量等均极显著高于延边黄牛的韩延牛作为研究对象,利用生物信息学技术分析了延边黄牛及韩延牛血液exosome中显著影响GH分泌的差异表达miRNA,并筛选出显著差异表达的miR-6523a。但关于 miR-6523a 对延边黄牛垂体中GH的分泌的影响机制还不清楚,因此本研究旨在在体外垂体细胞水平上探究miR-6523a对延边黄牛垂体GH分泌的调控机制,进而为进一步研究外胞体miRNA调控动物生长发育机制提供理论依据。
1材料与方法
1.1试验材料
1.1.1主要仪器Bio-Rad 650型酶标仪(美国Bio-Rad公司);倒置生物显微镜(日本Olympus公司);荧光定量PCR仪(美国ABI公司);2406-2型CO2培养箱(美国Thermo公司);凝胶成像系统(英国Ultro-Violet Products公司)。
1.1.2主要试剂XhoⅠ、XbaⅠ,购自宝生物工程(大连)有限公司;DMEM/F12培养液、胎牛血清、0.25%胰蛋白酶、胶原酶Ⅱ及青霉素、链霉素、LipofectamineTM 2000,均购自GIBCO公司;GH抗体、SSTR5抗体,均购自Abcam公司;β-actin抗体,购自北京博奥森生物技术有限公司;总蛋白提取试剂盒,购自北京佳兰生物科技有限公司;miR-6523a的模拟物(mimics)(miR-6523a-mi)、抑制剂(inhibitor)(miR-6523a-in)、阴性对照(NC)、抑制剂阳性对照(iNC),均由上海吉玛制药技术有限公司合成;双荧光报告基因检测试剂盒购自Promega公司。
1.2试验方法
1.2.1miR-6523a的靶基因预测利用targetscan和RNAhybrid分析软件对miR-6523a与GH合成分泌相关的基因(GHRHR、SSTR2、LEF1、POU1F1和SSTR5等)的靶关系进行预测。
1.2.2延边黄牛垂体细胞原代培养垂体细胞原代培养方法参考文献[10]。在无菌条件下分离3头延边黄牛的垂体组织,分别剪碎至1 mm×1 mm×1 mm 的组织块,用pH值为7.0的磷酸缓冲盐溶液(PBS)冲洗3遍后,接种于75 mL培养瓶中,加入DMEM/F12培养液,放入37 ℃、5% CO2培养箱中培养,待细胞从组织块中爬壁生长至80%时,采用0.25%胶原酶消化,并通过差速贴壁法分离细胞,获得垂体原代培养细胞。
1.2.3miR-6523a对延边黄牛腺垂体细胞中GH mRNA转录水平的影响按“1.2.2”节中所述方法对延边黄牛的垂体组织细胞进行原代培养后,按2.0×106个细胞/孔的密度将垂体细胞接种至6孔培养板中,待细胞汇合度为60%~70%时进行转染试验。转染前采用2 mL PBS漂洗细胞1次,并加入 0.7 mL DMEM/F12培养液和100 μL 1 μmol/L 生长抑素(SS),之后分别将miR-6523a的mimics、inhibitor、NC对照、iNC对照分别稀释到100 μL DMEM/F12培养液中。然后将10 μL转染试剂LipofectamineTM 2000稀释至100 μL DMEM/F12培养液中,之后将上述稀释液分别按1 ∶1体积比混合,室温孵育 10 min 后,将200 μL混合物加入到上述预处理的细胞孔中,使mimics、inhibitor、NC对照、iNC对照最终浓度为200 pmol/L,每组设3次重复。为了避免转染毒性,6 h后吸弃含转染试剂的培养基,同时置换新的培养基继续培养48 h,收集细胞,提取总mRNA。采用荧光定量PCR(qPCR)法检测GH mRNA的转录情况,具体步骤参考文献[10]中的方法进行。
1.2.4miR-6523a对延边黄牛腺垂体细胞中GH蛋白表达的影响根据总蛋白提取试剂盒的步骤对“1.2.3”节中获得的细胞进行总蛋白提取,并进行GH蛋白Western Blot检测具体步骤如下:按常规方法配制10%聚丙烯酰胺凝胶电泳(PAGE)分离胶和5% PAGE浓缩胶并放入垂直电泳槽中,待其凝固后,拔出木梳并向梳孔中加入1×甘氨酸缓冲液,然后加入50 μg制备的总蛋白样品进行电泳。电泳结束后,将上述蛋白胶进行转膜,所用膜为聚偏氟乙烯(PVDF),转膜条件为110 V、60~70 min,转膜结束后取出PVDF膜,进行丽春红染色,检验转膜效果;之后采用1×TBST溶液洗涤膜数次,去除丽春红染色液,再用5%脱脂奶粉室温条件下封闭2 h;之后将封闭的PVDF膜放入5 mL离心管中,加入 2 mL GH蛋白一抗,4 ℃条件下孵育过夜(12 h)。孵育结束后,采用1×TBST缓冲液洗涤PVDF膜3次,每次10 min。将洗涤后的PVDF膜放入新的 5 mL 离心管中,加入2 mL 1 ∶5 000稀释的GH蛋白二抗,室温孵育2 h。孵育结束后,用1×TBST缓冲液洗涤PVDF膜3次,每次5 min。然后将PVDF膜置于发光液中显色1 min后,在凝胶成像系统中曝光,并与β-actin内参基因的表达进行比较,计算GH蛋白的相对表达量。
1.2.5miR-6523a与SSTR5靶关系验证将能与miR-6523a种子序列匹配的SSTR5 3′非翻译区(UTR)区域的上、下游30 bp之内的序列进行人工合成,同时将与miR-6523a种子序列匹配区域的5个碱基进行人工突变作为对照,逐步确定miR-6523a真正结合位点。然后用限制性内切酶XhoⅠ和XbaⅠ酶切上述人工合成的片段及人工突变片段,将酶切产物分别与荧光素酶基因报告载体(pirGLO载体)连接,构建重组pirGLO-SSTR5-3′UTR表达载体和突变载体,获取无内毒素质粒。之后将miR-6523a的mimic、NC与构建好的pirGLO-SSTR5-3′UTR正常或缺失载体分别稀释为200 pmol/L,然后在转染试剂LipofectamineTM 2000的作用下共转染中国仓鼠卵巢癌细胞(CHO)细胞,具体转染过程参考“1.2.3”节中的方法。48 h后收集细胞、裂解,按荧光素酶检测试剂盒步骤检测荧光素酶的活性,以验证miR-6523a与SSTR5之间的靶关系。
1.2.6miR-6523a对延边黄牛腺垂体细胞中SSTR5的mRNA转录水平和蛋白表达的影响SSTR5 mRNA转录水平的qPCR检测和蛋白的Western Blot检测均参考“1.2.3”和“1.2.4”节中的方法进行。
1.2.7数据分析采用SPSS 13.0软件进行数据分析,结果以 x±s的形式表示。*、**分别表示与NC或iNC对照组比较差异显著(P<0.05)、极显著(P<0.01)。
2结果与分析
2.1miR-6523a与调控GH分泌相关基因靶关系预测
本试验使用targetscan和RNAhybrid分析软件对miR-6523a与GH合成分泌相关的基因(GHRHR、SSTR2、LEF1、POU1F1、SSTR5等)靶关系进行分析。结果显示,miR-6523a的靶基因为SSTR5。
2.2miR-6523a对GH基因mRNA转录水平的影响
为分析miR-6523a对延边黄牛垂体GH基因表达的影响,本研究首先用miR-6523a mimics及inhibitor转染原代培养的延边黄牛垂体细胞,然后对GH基因mRNA表达进行检测。由图1可知,与对照组相比,添加miR-6523a-mi能够极显著提高GH mRNA的转录水平(P<0.01),而添加miR-6523a-in能降低GH mRNA的轉录水平,但与对照组相比差异不显著(P>0.05)。
2.3miR-6523a对GH蛋白表达的影响
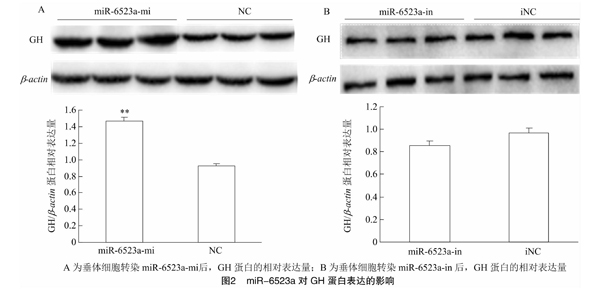
为了进一步验证miR-6523a对延边黄牛垂体GH蛋白表达的影响,本研究在GH mRNA转录检测结果基础上进一步对GH蛋白的表达水平进行Western Blot检测。由图2可知,与对照组相比,添加miR-6523a-mi 能够极显著提高GH蛋白表达水平
(P<0.01),而添加miR-6523a-in能降低GH蛋白的表水平,但与对照组相比差异不显著(P>0.05)。
2.4miR-6523a与SSTR5靶关系验证
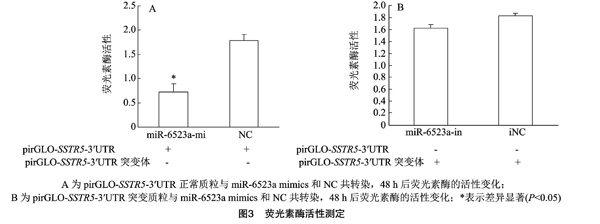
为验证miR-6523a与SSTR5之间是否存在靶位关系,本研究将pirGLO-SSTR5-3′UTR正常或突变载体分别与miR-6523a/NC共转染CHO细胞,从而通过荧光素酶活性的变化反映miR-6523a与SSTR5是否存在靶关系。由图3可知,miR-6523a能显著降低pirGLO-SSTR5-3′UTR正常质粒荧光素酶的活性,而对pirGLO-SSTR5-3′UTR突变体无抑制效果。由此可知,miR-6523a能结合并作用于SSTR5的3′UTR区域,miR-6523a与SSTR5之间存在靶位关系。
2.5miR-6523a对SSTR5基因mRNA表达的影响
为验证miR-6523a对SSTR5基因的调控功能,本试验首先用miR-6523a mimics及inhibitor转染原代培养的延边黄牛垂体细胞,然后对SSTR5基因mRNA转录水平进行qPCR检测。由图4可知,与对照组相比,添加miR-6523a-mi能够极显著降低SSTR5 mRNA的转录水平(P<0.01),而添加miR-6523a-in能提高SSTR5 mRNA的转录水平,但与对照组相比差异不显著(P>0.05)。
2.6miR-6523a对SSTR5蛋白表达的影响
为了进一步验证miR-6523a对延边黄牛垂体SSTR5蛋白表达的影响,本研究在SSTR5 mRNA转录检测结果基础上进一步对SSTR5蛋白表达的变化进行Western Blot检测。由图5可知,与对照组相比,添加miR-6523a-mi能够极显著降低SSTR5
蛋白的表达水平(P<0.01),而添加miR-6523a-in能提高SSTR5蛋白的表达水平,但与对照组相比差异不显著(P>0.05)。
3讨论與结论
外胞体中的miRNA可通过血液等体液的运输,被运输到动物机体的各个组织细胞并可通过细胞膜进入细胞内,从而在生长调控、细胞间通讯交流、免疫调节、信号传递等过程中发挥着重要的作用[11-12]。研究表明,exosome中的miRNA具有调控动物生长的功能[4-5]。此外笔者所在课题组在对生长性能有显著差异的延边黄牛和韩延牛血液exosome中的miRNA进行差异分析时,也发现在2个品种牛exosome中的miRNA存在着显著性差异,因此笔者所在课题组选择以在延边黄牛和韩延牛血液exosome中有显著差异的miRNA去研究其对延边黄牛的生长性能的调控具有一定意义。
笔者所在课题组的前期研究工作证明,外胞体中的miR-6523a在延边黄牛和韩延牛之间呈现显著性差异表达,因此推理miR-6523a可能参与了生长调控过程,可能是造成延边黄牛和韩延牛生长性能差异的主要因素之一,而在动物生长发育过程中,生长轴起着关键的作用,而在生长轴中腺垂体分泌的GH是最重要的成员之一[13]。GH可通过与生长激素结合蛋白(GHBP)结合而运输,与靶器官上生长激素受体(GHR)结合,促使胰岛素样生长因素(IGFs)的产生并进入血液循环,IGFs再通过与胰岛素样生长因子结合蛋白(IGFBP)结合转运到全身组织细胞,刺激骨、软骨细胞的生长和分化,调节蛋白质、糖及脂肪的代谢等[14]。因此,本研究对 miR-6523a与GH分泌之间的关系进行了探索。为初步确定miR-6523a是否与GH的分泌调控有关,本研究首先通过生物学分析软件对miR-6523a与GH分泌相关的调控基因进行了靶关系分析。研究资料表明,与GH合成分泌相关的基因主要有GHRHR、SSTR2、LEF1、POU1F1、SSTR5等[15]。鉴于此,笔者所在课题组利用targetscan和RNAhybrid分析软件分别对miR-6523a与GHRHR、SSTR2、LEF1、POU1F1和SSTR5的靶关系进行分析。分析结果表明,miR-6523a的种子序列只与SSTR5基因存在靶关系。研究表明,SSTR5与生长抑素(SS)结合后通过与G蛋白偶联进而调控GH的合成[16]。而通过进一步的荧光素酶报道基因验证结果显示,miR-6523a能显著降低pirGLO-SSTR5-3′UTR正常质粒荧光素酶的活性,而对缺失载体的荧光素酶活性无影响,上述结果不仅说明miR-6523a与SSTR5之间存在着靶位关系,同时可初步推测 miR-6523a 是通过调控SSTR5的表达而影响GH分泌的。
为进一步验证miR-6523a是否参与了垂体细胞GH的分泌调节,本研究利用miR-6523a mimics和inhibitor对延边黄牛垂体细胞进行了转染试验,并利用qPCR和Western Blot技术对延边黄牛垂体细胞中GH mRNA和蛋白表达水平进行了检测。qPCR和Western Blot检测结果显示,通过转染 miR-6523a mimics能极显著增加GH mRNA和蛋白的表达,而转染miR-6523a inhibitor能降低相应GH mRNA和蛋白的表达,该结果说明miR-6523a参与了调控垂体细胞中GH的分泌过程。
虽然,本研究通过生物信息学分析和报告基因系统验证了miR-6523a与SSTR5的靶关系,但在垂体细胞水平上miR-6523a对SSTR5基因表达具体影响结果仍然未知。因此,笔者所在课题组对延边黄牛垂体细胞进行miR-6523a mimics和inhibitor转染试验,并利用qPCR和Western Blot检测SSTR5基因的mRNA和蛋白的表达变化。结果显示,通过转染miR-6523a-mi能极显著降低SSTR5 mRNA和蛋白的表达,而转染miR-6523a-in能提高SSTR5 mRNA和蛋白的表达。因此,此结果进一步证明了miR-6523a与SSTR5之间存在靶关系,并说明 miR-6523a是通过与SSTR5作用而间接正调控GH分泌的。
总之,本研究结果证明,miR-6523a可以通过靶向SSTR5进而调节GH的表达。本研究成果将为进一步研究外胞体miRNA调控动物生长发育机制提供理论依据,也将为延边黄牛生长发育调控提供新的作用靶标。
参考文献:
[1]王志刚,刘和,杨胤轩. “延边黄牛”地理标志的历史沿革、发展现状、存在问题及前景展望[J]. 农业经济与管理,2014(3):67-71.
[2]金海国,曹阳,臧延青,等. 微卫星DNA与延边黄牛肉用生长性状关系[J]. 中国兽医学报,2004,24(3):285-288.
[3]夏广军,严昌国,金海国,等. 延边黄牛TG基因多态性与胴体和肉质性状相关性分析[J]. 中国兽医学报,2014,34(3):500-504.
[4]Melnik B C,John S M,Schmitz G. Milk is not just food but most likely a genetic transfection system activating mTORC1 signaling for postnatal growth[J]. Nutrition Journal,2013,12(1):103-108.
[5]陈婷. 猪乳外胞体中mRNAs、蛋白质和miRNAs的挖掘及功能分析[D]. 广州:华南农业大学,2014:17-37.
[6]刘建文,施用晖,乐国伟. 动物生长轴的激素调控[J]. 中国饲料,2003(14):7-9.
[7]姜克杰,赵景鹏,黄辉. 神经内分泌生长轴及其对畜禽的生长调控[J]. 中国饲料添加剂,2006(11):1-4.
[8]Deghenghi R,Avallone R,Torsello A,et al. Growth hormone-inhibiting activity of cortistatin in the rat[J]. Journal of Endocrinological Investigation,2001,24(11):RC31-RC33.
[9]Korbonits M,Grossman A B. Growth hormone-releasing peptide and its analogues:novel stimuli to growth hormone release[J]. Trends in Endocrinology and Metabolism,1995,6(2):43-49.
[10]关立增,娄安钢,朴明淑,等. 延边黄牛与韩延牛血液Exosome对延边黄牛垂体细胞中GH含量的影响[J]. 安徽农业科学,2016,44(1):105-107.
[11]Alvarez-Erviti L,Seow Y,Yin H,et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nature Biotechnology,2011,29(4):341-345.
[12]Valadi H,Ekstrm K,Bossios A,et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nature Cell Biology,2007,9(6):654-659.
[13]王開云,张国生,曾检华,等. 利用生长轴各激素调控动物生长[J]. 江西畜牧兽医杂志,2008(6):4-6.
[14]张成龙. 南方黄牛生长发育及其垂体组织转录组分析[D]. 扬州:扬州大学,2016:21-45.
[15]柒启恩. SD-大鼠垂体miRNAs的时序表达规律及功能分析[D]. 广州:华南农业大学,2015:32-76.
[16]Horvath T L,Diano S,Sotonyi P,et al. Minireview:ghrelin and the regulation of energy balance:a hypothalamic perspective[J]. Endocrinology,2001,142(10):4163-4169.马晓勇,岳世林,姜国均. 猪粪中添加不同比例牛粪对蚯蚓养殖的影响[J]. 江苏农业科学,2020,48(13):208-211.doi:10.15889/j.issn.1002-1302.2020.13.042
- 巧用选考知识解决解析几何压轴题
- 引入切线 巧解不等式
- 点击回归分析
- 例谈有效“翻译”数学语言的策略
- “直观想象”在全国卷数列试题中的应用探析
- 例谈高考试题的若干编制来源
- 2017年福建省中考数学卷与课程标准的一致性研究
- 利用圆的方程推导椭圆和双曲线的标准方程
- 对一类数列型不等式的研究
- 《数学通报》2305号“数学问题”的简解与探讨
- 由一道习题引发的探究性学习
- 一题多解真精彩 思维活动显真章
- 三角换元与基本不等式的“争锋”
- 高三数学复习中概念教学的思考
- 让教师在数学课堂中充满生命活力
- 走出分类误区,变出数学精彩
- 初中数学新授课校本作业设计有效性的评测标准探析
- 一类含绝对值的双重最值问题探究
- “一题多解”勿忘“择优原则”
- 选择合理方法 突破解题困境
- 主要矛盾思想在解题受阻时的应用
- 反比例函数中k的几种求法
- 直观严谨相辉映,运动变化显本真
- 例谈含参不等式解集的求法
- 刍议数学解题中的化归转化思想
- have¹
- having
- having responsibility
- having to
- havoc
- havocked
- havocker
- havockers
- havocking
- havocs
- hawk
- hawked
- hawking
- hawkishly
- hawkishness
- hawkishnesses
- hawklike
- hawk's
- hawks
- hawthorn
- hawthorneeffect
- hawthorne efˌfect
- hawthorns
- hawthorny
- hay
- 憨直
- 憨直、不知变通的样子
- 憨真
- 憨着脸儿
- 憨笑
- 憨胀
- 憨脸皮厚
- 憨葱
- 憨虎虎
- 憨蛋
- 憨诚
- 憨谬
- 憨达郎儿
- 憨郎
- 憨顽
- 憩
- 憩休
- 憩偃
- 憩室
- 憩息
- 憩棠
- 憩歇
- 憩止
- 憩泊
- 憩睡