陈贤 杨勇 刘凤权
摘要:褪黑素(melatonin,简称MT)是生物进化中一种保守的胺类激素,广泛存在于动物、植物及微生物体内。在植物中,褪黑素在调控植物生长和提高植物响应环境胁迫等方面发挥重要的作用。本文从植物褪黑素的发现、分子结构及化学性质、植物褪黑素的合成与分解代谢等方面进行了归纳与总结,重点阐述了褪黑素在植物生长与发育中的生理功能及在植物抗逆抗病中的调控作用,并对未来植物褪黑素的研究方向进行了展望。
关键词:植物褪黑素;分子结构;化学性质;生理功能;环境胁迫
中图分类号: S184 ?文献标志码: A ?文章编号:1002-1302(2020)24-0017-08
褪黑素,化学名称为N-乙酰基-5-甲氧基色胺(N-acetyl-5- methoxytryptamine),一類广泛存在于生物体内的吲哚类小分子化合物。自1995年褪黑素在许多高等植物体内相继被检测出来之后,出现了大量有关褪黑素在植物领域的研究[1-2]。其研究内容涉及:植物褪黑素的分离及提取方法、植物褪黑素含量在体内昼夜节律变化、植物褪黑素的合成途径、植物褪黑素潜在的生物学功能[3]。最初,植物褪黑素的研究工作主要围绕其抗氧化剂特性而展开。随着首个植物褪黑素受体的鉴定,为证实褪黑素是一种新型植物激素提供了最为直接的有力证据[4]。鉴于此,本文综述了褪黑素在植物体内的发现、分子结构及其功能,以期为褪黑素在植物生产中的应用提供参考。
1 植物褪黑素的发现
褪黑素是一种生命必需的吲哚胺类激素,广泛存在于动物、植物及微生物体内[5-7]。褪黑素最早发现于动物的松果体中。在1917年,美国学者McCord和Allen利用丙酮法萃取牛的松果体,发现提取液中含有某种未知物质可使小蝌蚪皮肤颜色由黑色变成浅白色[8]。在1959年,耶鲁大学皮肤学教授Lerner利用紫外分光光度计结合乙酸乙酯萃取法首次从牛的松果体中成功分离并鉴定这种未知物质,并将这种松果体激素取名为褪黑素[9]。其实,Lerner教授将其命名为褪黑素(melatonin)是个组合词。字首mela取自黑色素(melamin),因为褪黑素可使黑色素细胞发亮,后缀tonin取自5-羟色胺(serotonin),因为褪黑素是从5-羟色胺衍生而来。
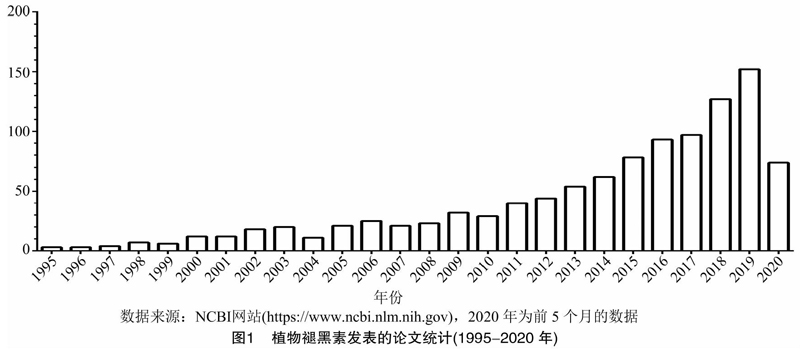
褪黑素作为一种广为人知的动物激素,对许多生理活动的调节起着重要的作用[10]。以至于在很长的一段时间内,大家认为褪黑素是动物专有的一种神经激素。虽然在1959年,美国国立卫生研究院Udenfriend等在植物中鉴定到5-羟色胺(serotonin),一个参与动物褪黑素合成的关键中间体[11]。直到1995年,日本圣玛丽安娜医科大学Hattori和德国不来梅大学Dubbels首次发现植物体内含有褪黑素。Hattori等利用放射免疫(RIA)技术和HPLC技术检测了24个可食用的植物,包括:菠菜、黄瓜、猕猴桃、白菜、白萝卜、胡萝卜、苹果、草莓、番茄、大米、大麦、燕麦、玉米、芋头、芦笋、大葱、菠萝及高羊茅等,发现它们体内都含有褪黑素,其中高羊茅中褪黑素含量最高[(5 288.1±368.3) pg/g],芦笋中褪黑素含量最低[(9.5±3.2) pg/g][2]。Dubbels等利用放射免疫(RIA)技术和气相色谱-质谱联用(GC-MS)技术检测9种植物叶片中褪黑素的含量,其中香蕉中褪黑素的含量为47 ng/100 g,番茄中褪黑素的含量为25 ng/100 g,黄瓜中褪黑素的含量为9 ng/100 g,而红头菜中褪黑素的含量最低(01 ng/100 g)[1]。这2项几乎同时发表的研究成果拉开了植物褪黑素的研究序幕。据NCBI(National Center for Biotechnology Information)网站统计(图1),在1995—2010年,植物褪黑素相关论文的年发表量为15.44篇/年;到2011年,植物褪黑素相关论文的年发表量进入快速持续增长的阶段。在2019年,植物褪黑素相关论文的年发表量达到最大值(152篇)。即便在全球新冠疫情的影响下,2020年前5个月中植物褪黑素相关论文的发表量为72篇。截至2020年5月,植物褪黑素相关论文的发表总量为996篇,其中包括我国学者发表的328篇。
2 植物褪黑素的分子结构与化学性质
褪黑素是一个以色氨酸为前体经过酶促反应合成的小分子吲哚胺类化合物,分子式C13H16N2O2,分子量为232.27,CAS号为73-31-4。褪黑素的分子结构式含有一个吲哚环、一个甲氧基及一个酰胺基(图2)。酰胺基团带负电荷,可与三氟乙酸(trifluoroacetic acid,简称TFA)发生蓝色颜色反应,形成TFA衍生物[12]。吲哚环是芳香杂环类化合物,包含1个六元苯环和1个五元含氮的吡咯环的双环结构。褪黑素中吲哚环结构赋予其高亲脂性,而甲氧基和乙酰基赋予其疏水性,所以褪黑素能自由穿梭细胞膜系统,并易于进入细胞核[13]。甲氧基具有吸电子的诱导效应和供电子共轭效应,其中供电子的共轭效应占主导地位。褪黑素结构中的甲氧基及吲哚环均表现为电子供体,而这些特性赋予其以电子供体的形式与自由基发生化学反应。
褪黑素是生命体重要自由基清除剂之一,具有抗氧化的分子特性。在1991年,Ianǐ等首次发现褪黑素参与氧化还原反应过程,接着Poeggeler等在1993年证实褪黑素清除自由的能力是谷胱甘肽(GSH)的4倍、甘露醇的14倍[14-15]。褪黑素的抗氧化作用,一方面是因为它可以提供电子、氢原子、亚硝基化以及置换、加成等方式与ROS及NOS发生直接作用,包括:羟自由基(OH·)、过氧化氢(HO-2)、过氧烷自由基(RO-2)、过氧亚硝基(ONOO-)、超氧阴离子(O-2·)及一氧化氮自由基(NO·)等[16]。不仅褪黑素具有自由基清除功能,其与自由基反应的中间产物也参与了活性氧自由基的清除反应。在这种联合反应作用下,1分子褪黑素可以清除10个自由基团[17]。另一方面,褪黑素不仅直接参与抗氧化级联反应,也通过调控抗氧化系统的酶活性间接调控活性氧的清除反应[18]。例如,褪黑素能显著诱导抗氧化酶的活性,包括CAT、SOD、GSH-Px等[19-20]。因此,褪黑素具有保护细胞器和延缓衰老的作用。
褪黑素可抑制革兰氏阳性细菌和革兰氏阴性细菌的增殖[21]。褪黑素对引起乳房炎的无乳链球菌生长具有明显的抑制作用,最小剂量为 2 μg/mL[22]。褪黑素对引起肠道炎的金黄色葡萄球菌和对引起菌血症的铜绿假单胞菌等增殖具有明显的抑制作用,最小剂量在31.25~125 μg/mL之间[21]。褪黑素对引起肠胃炎的鼠伤寒沙门氏菌和对引起食物中毒的普通变形杆菌等生长有抑制作用,最小剂量为100 mg/mL[23]。褪黑素对引起水稻细菌性条斑病的稻生黄单胞菌条斑致病变种具有抑制作用,最小剂量200 μg/mL[24]。褪黑素可以结合游离的铁离子和锌离子,可阻止细胞摄取脂肪酸及抑制细菌组成型外分泌蛋白的合成与分泌[25-26]。褪黑素是否通过结合金属离子、干扰细菌代谢来抑制病原菌的生长,有待进一步研究。
3 植物褪黑素的合成与代谢
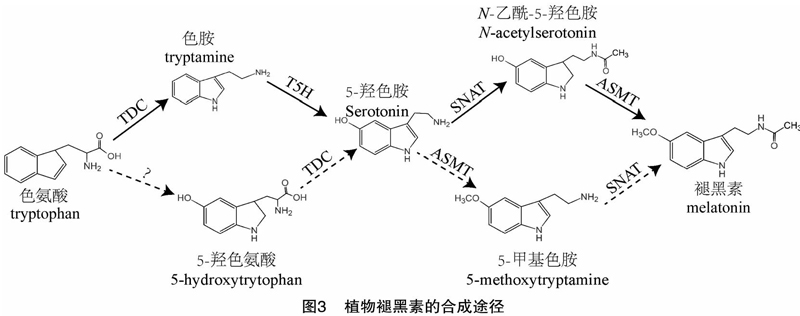
植物褪黑素合成途径分为经典途径和非经典途徑[27-28]。在经典途径中,植物褪黑素的合成与动物途径中褪黑素的合成路径相似。褪黑素合成前体色氨酸经历色氨酸脱羧酶(Tryptophan decarboxylase,TDC)、色胺-5-羟化酶(tryptamine-5-hydroxylase,简称T5H)、5-羟色胺-N-乙酰基转移酶(serotonin N-acetyltransferase,简称SNAT)及N-乙酰基-5-羟色胺-甲基转移酶(N-acetylserotonin methyltransferase,简称ASMT)等4个连续的酶促反应合成褪黑素[29]。
第一步:色氨酸脱羧酶(TDC)催化色氨酸(tryptophan)转化为色胺(tryptamine),其中TDC为褪黑素合成途径的限速酶[30-31]。TDC定位于细胞质和叶绿体上[32]。TDC参与叶片的衰老过程。在水稻过量表达TDC能增强褪黑素的合成,并延缓叶片的衰老;敲除TDC后,叶片则表现为早衰现象[33-34]。对辣椒叶片接种炭疽菌(Colletotrichum gloeosporioides)可增强TDC的转录水平,推测TDC可能参与植物防御病原菌的侵染过程[35]。
第二步:色胺-5-羟化酶(T5H)催化色胺转化为5-羟色胺(serotonin)[36]。T5H定位于内质网上,在植物体内保持较高的酶活性[37-38]。在新鲜叶片中,5-羟色胺的含量可高达1 600 μg/g,而褪黑素的含量约为5-羟色胺的0.000 1%(<1 ng/g)[33,39]。水稻白叶枯病菌和稻瘟菌的侵染均能增强T5H的转录水平[40]。外施5-羟色胺可诱导增强水稻抗稻瘟病,推测T5H可能参与水稻响应稻瘟病菌的侵染过程[41]。
第三步:5-羟色胺-N-乙酰基转移酶(SNAT)催化5-羟色胺转化为N-乙酰基-5-羟色胺[42]。SANT定位于叶绿体中,高温和黑暗环境能提高SANT酶的活性和增强褪黑素的合成[34,42]。黄酮类化合物莫林和杨梅素可通过抑制SANT酶活性来调控褪黑素的合成[43]。在过表达SANT的转基因植物中,其株系不但表现为增强对冷害胁迫的耐受性和对氧化胁迫的抗性,而且能通过激活水杨酸(salicylic acid,简称SA)和茉莉酸(jasmonic acid,简称JA)信号途径增强植物的防御能力[44]。
第四步:N-乙酰基-5-羟色胺-甲基转移酶(ASMT)催化N-乙酰基-5-羟色胺最终转化成褪黑素[45]。ASMT定位于细胞质中[42]。与SANT酶类似,高温和黑暗环境均能提高ASMT酶活性和增强褪黑素的合成[34]。在过表达ASMT转基因苜蓿中,植物株高增加、叶片扩大和茎秆变粗壮,其体内的纤维素含量增多[46]。脱落酸(abscisic acid,简称ABA)和茉莉酸甲酯(methyl jasmonate,简称MeJA)均能诱导ASMT的表达,暗示ABA和MeJA可能参与调控褪黑素的合成[40]。
在非经典途径中,植物中有1个以色氨酸合成5羟色胺的支路和1个以5-羟色胺合成褪黑素的支路。在贯叶连翘中,色氨酸通过色氨酸-5-羟化酶(TPH)催化合成5-羟色胺,后者在色氨酸脱羧酶(TDC)或芳香-L-氨基酸脱羧酶(AADC)的催化作用下合成5-羟色胺[31]。在拟南芥中,5-羟色胺经ASMT酶催化合成5-甲氧基色胺,后者在SNAT酶的催化作用下合成褪黑素[47]。在植物合成路径中,由色氨酸转化合成5-羟色胺的效率较高,而由5羟色胺转化合成褪黑素的效率较低。最终导致植物体内5-羟色胺含量很高,而褪黑素含量相对较低[28]。
相对于合成代谢,褪黑素分解代谢在植物中研究得较少。植物褪黑素通过酶促反应和非酶促反应分解产生多种代谢产物[48]。在水稻中,褪黑素可通过水解酶(melatonin-2-hydroxylase,简称M2H)主要分解成2-羟基褪黑素[49]。M2H定位于叶绿体和细胞质中[50]。酶活性动力学表明,M2H活性远高于褪黑素的合成酶SNAT和ASMT,使得植物体内2-羟基褪黑素的含量为褪黑素的368倍[51]。同时,褪黑素也可通过酶促反应分解为4-羟基褪黑素,但后者在植物体内的含量极低。在非酶促反应中,褪黑素可以通过与自由基发生级联反应而逐渐被分解[52]。例如,褪黑素通过M2H酶解为2-羟基褪黑素,后者可通过与自由基进一步发生反应产生N-1-乙酰基-N-2-甲酰基犬尿酰胺(AFMK)[50]。
4 植物褪黑素的生理功能
色氨酸是褪黑素和吲哚乙酸生物合成的共同前体[31]。它们在结构上十分相似,二者在植物体内有相似的生理功能[27]。褪黑素参与调控植物发育、开花、营养吸收及果实成熟等生理过程[3]。
外施褪黑素能显著提高植物种子的萌发率。利用外源褪黑素处理棉花种子,发现低浓度褪黑素促进种子的萌发,而高浓度褪黑素对种子萌发具有抑制作用[53]。低浓度褪黑素处理棉花种子,能改善种子萌发过程中的发芽势、发芽率和最终鲜质量。褪黑素具有抗氧化能力,在植物种子萌发过程中可保护种子内部的脂类不被氧化[54-55]。外施褪黑素能提高处于盐胁迫下植物种子的萌发率[56]。张娜等发现在盐胁迫下(150 mmol/L),利用外源褪黑素(1 μmol/L)可显著提高黄瓜种子的萌发率[57]。在盐胁迫下,与对照组相比,褪黑素可显著诱导抗氧化酶的活性,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)。此外,褪黑素可通过增强GA合成基因GA20ox和GA3ox的表达,促进GA的合成含量显著增强;同时,褪黑素抑制ABA合成基因CsCYP707A1和CsCYP707A2表达及增强其分解基因CsNECD2的转录水平,最终导致ABA含量在发芽期快速下降。进一步,张娜等利用蛋白质组学分析在盐胁迫下褪黑素促进种子萌发的分子机理[58]。在盐胁迫下,与对照组相比,褪黑素显著影响了157个蛋白的表达水平。这些蛋白分别参与核糖体的生物合成、脂质代谢、碳水化合物代谢和贮藏蛋白降解等生理生化过程。而在碳水化合物代谢中,褪黑素增强耐压蛋白质和ATP合成酶的含量,推测褪黑素可能通过促进能量代谢来减轻盐胁迫对种子萌发的抑制作用。
褪黑素参与调控种子和愈伤组织发育。Mona等发现褪黑素处理鹰嘴豆植物后,显著增加种子的数量和质量[59]。与对照组相比,褪黑素(0.25 mmol/L)处理鹰嘴豆植物,可增加光合色素的合成和植物鲜质量,并且使得种子的数量增加达117.6%。同时,褪黑素可提高种子中营养物质的含量。与对照组相比,褪黑素处理鹰嘴豆植物后,使得碳水化合物、油、酚及抗氧化物质的含量分别提高8.12%、44.94%、57.14%及9.41%。Fazal等发现褪黑素能影响夏枯草愈伤组织的鲜质量。在培养基中添加外源褪黑素(1.0 mg/L),可使夏枯草的愈伤组织增质量达3.18 g[60]。此外,他们还发现褪黑素可提高外植体中的总蛋白含量、超氧歧化酶和过氧化物酶的活性活性,推测褪黑素可增强植物生物量的积累和应激酶的活性。
褪黑素参与调控植物根部发育。Chen等利用褪黑素处理芥菜的幼苗(苗龄),发现低浓度褪黑素(0.1 mmol/L)对幼苗根部生长具有促进作用,同时他们还发现低浓度褪黑素可促进根部IAA的合成,推测IAA可能参与褪黑素诱导的植物根部发育过程[61]。Pelagio等利用外源褪黑素处理拟南芥幼苗根部,发现褪黑素可显著促进侧根和不定根的生长,但不影响生长素的合成与降解,推测褪黑素调控根部发育可能与生长素信号无关[62]。Liang等利用转录组学分析褪黑素处理下水稻幼根中转录组的变化,发现生长素相关的基因均被激活,推测褪黑素可能通过直接或间接激活生长素信号传导途径来塑造根部结构[63]。Park等发现在水稻体内过表达1个山羊SANT基因,不但能增强内源褪黑素的合成,同时促进主根和不定根的发育[64]。Chen等发现褪黑素诱导苜蓿侧根发育在时空上与过氧化氢合成保持高度一致[65]。他们还发现在拟南芥中异源表达苜蓿MsSNAT基因,增强过氧化氢的合成和促进侧根的形成。而利用过氧化氢清除剂(N,N′-二甲基硫脲)均能阻断过氧化氢的合成和侧根的形成过程,推测过氧化氢可能参与褪黑素诱导侧根的形成过程。这些研究结果表明褪黑素及其合成基因参与植物根部的发育。
褪黑素参与果实成熟过程。Luo等发现褪黑素能延长采摘后西兰花的货架期[66]。利用褪黑素和茉莉酸甲酯(MeJA)分别处理采摘后的新鲜西兰花,与对照组相比,MeJA和褪黑素处理后分别将西兰花泛黄推迟2 d和4 d。当样品开始失去绿色的时候,MeJA处理增加西兰花的甜味和萝卜硫素的含量,而褪黑素处理西兰花后能减轻苦味及涩味,同时显著增加抗氧化酶的活性和含硫挥发物的含量。Cao等发现褪黑素增强低温胁迫下桃果的耐寒能力[67]。与对照组相比,利用褪黑素(100 μmol/L)处理桃果可降低低温对果实的伤害,提高可提取汁液率和总可溶性固形物含量。褪黑素处理增加果实中脯氨酸和多胺的含量,进而诱导桃果的耐寒性。
5 植物褪黑素在环境胁迫应答中的作用
褪黑素是一种重要的生物刺激器,可提高植物对非生物胁迫的抵抗能力;褪黑素是一种重要的新型植物激素,可增强植物对生物胁迫的抵抗能力[68-70]。
褪黑素可维持逆境下植物的健康状态[71]。外施褪黑素显著提高了干旱胁迫下黄瓜的发芽率和根系发育,主要是通过保护叶绿体的完整性和维持叶绿素水平来缓解干旱胁迫对光合作用造成的阻碍作用;外施褪黑素提高了盐胁迫下黄瓜的发芽率,主要是通过清除由盐胁迫形成的活性氧而维持细胞膜的完整性和促进种子内能量的合成来促进种子萌发[72]。外施褪黑素提高了高温胁迫下黄瓜的耐受性,主要是通过提高碳氮代谢相关酶的活性来促进碳水化合物代谢和增加氮素积累来缓解高温对酶的抑制作用,增强了黄瓜的抗逆性[73]。外施褪黑素可增强番茄对低温的耐受性,主要是通过维持细胞膜的完整性和减少电解质渗漏来缓解低温伤害[74]。褪黑素具有结合铜离子的特性,外施褪黑素可提高铜离子胁迫下豌豆的存活率[75]。低温胁迫可诱导胡萝卜悬浮细胞的凋亡,而外源褪黑素可通过诱导腐胺和亚精胺的合成,提高低温胁迫下胡萝卜悬浮细胞的存活率[74]。外源褪黑素处理胡萝卜悬浮细胞不影响其体内活性氧的生成,推测褪黑素的ROS清除剂特性可能不参与上述的抗逆过程。褪黑素是植物体内重要的抗氧化剂[76]。褪黑素可清除植物体内因胁迫而形成的活性氧,进而保护了细胞膜的完整性及提高了相关氧化酶的催化活性[27]。但褪黑素在植物体内有很高的依赖性。对于同一株植物来说,不同浓度的褪黑素可以缓解植物遭受的胁迫伤害也可能加速胁迫伤害。
褪黑素可作为一种植物激素诱导植物的防御反应。外源施加褪黑素增强植物抗性的研究已有较多的报道[77]。周彤等发现水稻感染水稻条纹病毒(RSV)后外源施加褪黑素,可使RSV CP基因的转录水平下调,病害显症时间推迟,病症减轻,发病率降低[78]。时浩杰等发现水稻感染稻瘟病菌ZB15后外源施加褪黑素,增强了SOD酶和PPO酶活性,增强水稻稻瘟病抗性[79]。马锋旺等发现在苹果树感染苹果斑褐病(Dm)后外源施加褪黑素,可使过氧化氢(H2O2)含量增加,病原菌积累量减少[80]。施海涛等发现香蕉感染香蕉枯萎病菌(Foc)后外源施加褪黑素,抑制了水杨酸(SA)合成,增强香蕉对Foc的抗性。施海涛等还发现拟南芥感染丁香假单胞菌番茄致病变种(Pst DC3000)后外源施加褪黑素,可诱导一氧化氮(NO)和水杨酸(SA)途径中防御基因的表达,抑制病原菌的增殖和扩散,增强拟南芥对Pst DC3000的抗性,而褪黑素合成缺陷突变体 snat-1、snat-2对Pst DC3000则更为敏感[81]。褪黑素能诱导过氧化氢(H2O2)合成。Kyoungwhan等发现拟南芥NO合成酶noal、nia1/nia2缺失突变株和H2O2合成酶rbohD/rbohF缺失突变株被Pst DC3000感染后外源施加褪黑素,不能增强拟南芥突变体对Pst DC3000的抗性[82]。有丝分裂原蛋白激酶(MAPK)是诱导植物防卫基因表达的重要上游组份[83]。Kyoungwhan等還发现MAPK3和MAPK6在拟南芥感染Pst DC3000后外源施加褪黑素后,表达量显著增强。然而,病原菌侵染寄主后MT如何调控植物免疫途径尚不清楚。
6 结语与展望
褪黑素广泛存在于植物体内,但其含量极低且具有明显的昼夜节律特点。褪黑素参与植物抗病抗逆的过程,但对其作用机制的研究还不够深入。本文主要介绍了植物褪黑素的发现、分子结构及化学性质,褪黑素在植物生长与发育中的生理功能,褪黑素在植物抗逆抗病中的作用等。目前,植物褪黑素的研究在以下3个方面有待进一步完善:(1)不同植物体内褪黑素在分子结构及生物活性上是否有差异?(2)褪黑素在植物体内确切的合成和分解路径。(3)褪黑素在植物抗逆和抗病过程中的信号转导路径。
植物褪黑素是一个新的、热点研究领域。随着植物中首个褪黑素受体的鉴定,为证明褪黑素是一种植物激素提供了直接的证据,但要证实植物褪黑素是一种植物激素还需更多的证据来支持。
参考文献:
[1]Dubbels R,Reiter R J,Klenke E,et al. Melatonin in edible plants identified by radioimmunoassay and by high performance liquid chromatography-mass spectrometry[J]. Journal of Pineal Research,1995,18(1):28-31.
[2]Hattori A,Migitaka H,Iigo M,et al. Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International,1995,35(3):627-34.
[3]趙 燕,王东华,赵曦阳. 植物中褪黑素的研究进展[J]. 西北植物学报,2014,34(1):196-205.
[4]Wei J,Li D X,Zhang J R,et al. Phytomelatonin receptor PMTR1-mediated signaling regulates stomatal closure in Arabidopsis thaliana[J]. Journal of Pineal Research,2018,65(2):e12500.
[5]Viljoen F P,Preez J L D,Wessels J C,et al. An HPLC-DAD validated method for the detection and quantification of cortisol,corticosterone and melatonin in plasma samples of two different animal species[J]. Pharmazie,2019,74(4):206-211.
[6]Chen X,Laborda P,Liu F. Exogenous melatonin enhances rice plant resistance against Xanthomonas oryzae pv. oryzae[J]. Plant Disease,2020,104(6):1701-1708.
[7]Chen X,Sun C,Laborda P,et al. Melatonin treatment inhibits the growth of Xanthomonas oryzae pv. oryzae[J]. Frontiers in Microbiology,2018,9:2280.
[8]Mccord C P,Allen F P. Evidences associating pineal gland function with alterations in pigmentation[J]. Journal of Experimental Zoology Part A Ecological Genetics & Physiology,1917,23(1):207-224.
[9]Lerner A B,Case J D,Takahashi Y,et al. Isolation of melatonin,the pineal gland factor that lightens melanocytes [J]. Journal of the American Chemical Society,1958,80(10):2587-2587.
[10]Emet M,Ozcan H,Ozel L,et al. A review of melatonin,its receptors and drugs[J]. The Eurasian Journal of Medicine,2016,48(2):135-141.
[11]Udenfriend S,Lovenberg W,Sjoerdsma A. Physiologically active amines in common fruits and vegetables[J]. Arch Biochem Biophys,1959,85:487-90.
[12]恋田和今,仁/森本,宏治/橋本,圭二/河合,聡/宇野,文二. Melatoninのtrifluoroacetyl誘導体の生成機構に関する考察[J]. The Annual Proceedings of Gifu College of Pharmacy,2001,50:61-65.
[13]Huo X,Wang C,Yu Z,et al. Human transporters,PEPT1/2,facilitate melatonin transportation into mitochondria of cancer cells:An implication of the therapeutic potential[J]. Journal of Pineal Research,2017,62(4):e12390.
[14]Ian O,Olinescu R,Bǎdescu I. Melatonin involvement in oxidative processes[J]. Endocrinologie,1991,29(3-4):147-153.
[15]Poeggeler B,Reiter R J,Tan D X,et al. Melatonin,hydroxyl radical-mediated oxidative damage,and aging:a hypothesis[J]. Journal of Pineal Research,1993,14(4):151-68.
[16]王懷清,刘志民. 褪黑素及其代谢物抗氧化作用研究进展[J]. 国际内分泌代谢杂志,2009,29(2):129-131.
[17]Tan D X,Hardeland R,Manchester L C,et al. Mechanistic and comparative studies of melatonin and classic antioxidants in terms of their interactions with the ABTS cation radical[J]. Journal of Pineal Research,2003,34(4):249-59.
[18]Khan A,Numan M,Khan A L,et al. Melatonin:Awakening the defense mechanisms during plant oxidative stress[J]. Plants,2020,9(4):407.
[19]Fischer T W,Kleszczyński K,Hardkop L H,et al. Melatonin enhances antioxidative enzyme gene expression (CAT,GPx,SOD),prevents their UVR-induced depletion,and protects against the formation of DNA damage (8-hydroxy-2′-deoxyguanosine) in ex vivo human skin[J]. Journal of Pineal Research,2013,54(3):303-314.
[20]Rodriguez C,Mayo J C,Sainz R M,et al. Regulation of antioxidant enzymes:a significant role for melatonin[J]. Journal of Pineal Research,2004,36(1):1-9.
[21]Tekbas O F,Ogur R,Korkmaz A,et al. Melatonin as an antibiotic:new insights into the actions of this ubiquitous molecule[J]. Journal of Pineal Research,2008,44(2):222-226.
[22]Atroshi F,Rizzo A,Westermarck T,et al. Effects of tamoxifen,melatonin,coenzyme Q(10),and L-carnitine supplementation on bacterial growth in the presence of mycotoxins[J]. Pharmacological Research,1998,38(4):289-295.
[23]Karakas F,Karakas A,Turker A,et al. Antibacterial and antitumor activities of melatonin hormone[J]. Spatula Dd Peer Reviewed Journal on Complementary Medicine & Drug Discovery,2013,3(2):1-7.
[24]Chen X,Sun C,Laborda P,et al. Melatonin treatments reduce the pathogenicity and inhibit the growth of Xanthomonas oryzae pv. oryzicola[J]. Plant Pathology,2019,68(2):288-296.
[25]Limson J,Nyokong T,Daya S. The interaction of melatonin and its precursors with aluminium,cadmium,copper,iron,lead,and zinc:An adsorptive voltammetric study[J]. Journal of Pineal Research,1998,24(1):15-21.
[26]Blask D E,Dauchy R T,Sauer L A. Putting cancer to sleep at night-The neuroendocrine/circadian melatonin signal[J]. Endocrine,2005,27(2):179-188.
[27]Zhao D,Yu Y,Shen Y,et al. Melatonin synthesis and function:evolutionary history in animals and plants[J]. Front Endocrinol,2019,10:249.
[28]Back K,Tan D X,Reiter R J. Melatonin biosynthesis in plants:multiple pathways catalyze tryptophan to melatonin in the cytoplasm or chloroplasts[J]. Journal of Pineal Research,2016,61(4):426-437.
[29]Arnao M B,Hernandez-Ruiz J. Functions of melatonin in plants:a review[J]. Journal of Pineal Research,2015,59(2):133-50.
[30]Zhao D,Wang R,Liu D,et al. Melatonin and expression of tryptophan decarboxylase Gene (TDC) in herbaceous peony (Paeonia lactiflora Pall.) flowers[J]. Molecules,2018,23(5):1164.
[31]Murch S J,Krishnaraj S,Saxena P K. Tryptophan is a precursor for melatonin and serotonin biosynthesis in in vitro regenerated St. Johns wort (Hypericum perforatum L. cv. Anthos) plants[J]. Plant Cell Reports,2000,19(7):698-704.
[32]Miao W,Qiu-Rong L,Fiore S D,et al. Expression of recombinant tryptophan decarboxylase in different subcellular compartments in tobacco plant[J]. Acta Botanica Sinica,2002,44(3):314-317.
[33]Kang K,Kim Y S,Park S,et al. Senescence-induced serotonin biosynthesis and its role in delaying senescence in rice leaves[J]. Plant Physiology,2009,150(3):1380-1393.
[34]Byeon Y,Back K. Melatonin synthesis in rice seedlings in vivo is enhanced at high temperatures and under dark conditions due to increased serotonin N-acetyltransferase and N-acetylserotonin methyltransferase activities[J]. Journal of Pineal Research,2014,56(2):189-195.
[35]Park S,Kang K,Lee K,et al. Induction of serotonin biosynthesis is uncoupled from the coordinated induction of tryptophan biosynthesis in pepper fruits (Capsicum annuum) upon pathogen infection[J]. Planta,2009,230(6):1197-1206.
[36]Kang S,Kang K,Lee K,et al. Characterization of tryptamine 5-hydroxylase and serotonin synthesis in rice plants[J]. Plant Cell Reports,2007,26(11):2009-2015.
[37]Kang K,Kang S,Lee K,et al. Enzymatic features of serotonin biosynthetic enzymes and serotonin biosynthesis in plants[J]. Plant Signaling & Behavior,2008,3(6):389-390.
[38]Lee H Y,Back K. Cadmium disrupts subcellular organelles,including chloroplasts,resulting in melatonin induction in plants[J]. Molecules,2017,22(10):1791.
[39]Kang K,Lee K,Park S,et al. Enhanced production of melatonin by ectopic overexpression of human serotonin N-acetyltransferase plays a role in cold resistance in transgenic rice seedlings[J]. Journal of Pineal Research,2010,49(2):176-182.
[40]Wei Y,Zeng H,Hu W,et al. Comparative transcriptional profiling of melatonin synthesis and catabolic genes indicates the possible role of melatonin in developmental and stress responses in rice[J]. Frontiers in Plant Science,2016,7:676.
[41]Fujiwara T,Maisonneuve S,Isshiki M,et al. Sekiguchi lesion gene encodes a cytochrome P450 monooxygenase that catalyzes conversion of tryptamine to serotonin in rice[J]. Journal of Biological Chemistry,2010,285(15):11308-11313.
[42]Byeon Y,Lee H Y,Lee K,et al. Cellular localization and kinetics of the rice melatonin biosynthetic enzymes SNAT and ASMT[J]. Journal of Pineal Research,2014,56(1):107-14.
[43]Lee K,Hwang O J,Reiter R J,et al. Flavonoids inhibit both rice and sheep serotonin N-acetyltransferases and reduce melatonin levels in plants[J]. Journal of Pineal Research,2018,65(3):e12512.
[44]Yu Y,Bian L,Jiao Z,et al. Molecular cloning and characterization of a grapevine (Vitis vinifera L.) serotonin N-acetyltransferase (VvSNAT2) gene involved in plant defense[J]. BMC Genomics,2019,20(1):880.
[45]Pan L,Zheng J,Liu J,et al. Analysis of the ASMT gene family in pepper (Capsicum annuum L.):identification,phylogeny,and expression profiles[J]. International Journal of Genomics,2019,2019:7241096.
[46]Cen H,Wang T,Liu H,et al. Overexpression of MsASMT1 promotes plant growth and decreases flavonoids biosynthesis in transgenic alfalfa (Medicago sativa L.)[J]. Frontiers in Plant Science,2020:489.
[47]Tan D X,Hardeland R,Back K,et al. On the significance of an alternate pathway of melatonin synthesis via 5-methoxytryptamine:comparisons across species[J]. Journal of Pineal Research,2016,61(1):27-40.
[48]劉哲宇,孙 铮. 褪黑素代谢模式的研究进展[J]. 生命科学,2017,29(2):209-214.
[49]Choi G H,Back K. Suppression of melatonin 2-hydroxylase increases melatonin production leading to the enhanced abiotic stress tolerance against cadmium,senescence,salt,and tunicamycin in rice plants[J]. Biomolecules,2019,9(10):589.
[50]Byeon Y,Park S,Lee H Y,et al. Elevated production of melatonin in transgenic rice seeds expressing rice tryptophan decarboxylase[J]. Journal of Pineal Research,2014,56(3):275-282.
[51]Byeon Y,Tan D X,Reiter R J,et al. Predominance of 2-hydroxymelatonin over melatonin in plants[J]. Journal of Pineal Research,2015,59(4):448-454.
[52]Tan D X,Manchester L C,Esteban-Zubero E,et al. Melatonin as a potent and inducible endogenous antioxidant:synthesis and metabolism[J]. Molecules,2015,20(10):18886-906.
[53]Xiao S,Liu L,Wang H,et al. Exogenous melatonin accelerates seed germination in cotton (Gossypium hirsutum L.)[J]. PLoS One,2019,14(6):e0216575.
[54]Xia H,Ni Z,Hu R,et al. Melatonin alleviates drought stress by a Non-Enzymatic and enzymatic antioxidative system in kiwifruit seedlings[J]. International Journal of Molecular Sciences,2020,21(3):852.
[55]Deng B,Yang K,Zhang Y,et al. Can antioxidants reactive oxygen species (ROS) scavenging capacity contribute to aged seed recovery? Contrasting effect of melatonin,ascorbate and glutathione on germination ability of aged maize seeds[J]. Free Radical Research,2017,51(9/10):765-771.
[56]Li J,Zhao C,Zhang M,et al. Exogenous melatonin improves seed germination in Limonium bicolor under salt stress[J]. Plant Signaling & Behavior,2019,14(11):1659705.
[57]Zhang H J,Zhang N,Yang R C,et al. Melatonin promotes seed germination under high salinity by regulating antioxidant systems,ABA and GA4 interaction in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research,2014,57(3):269-279.
[58]Zhang N,Zhang H J,Sun Q Q,et al. Proteomic analysis reveals a role of melatonin in promoting cucumber seed germination under high salinity by regulating energy production[J]. Scientific Reports,2017,7(1):503.
[59]El-Awadi M E,Dawood M G,Abdel-Baky Y R,et al. Physiological effect of melatonin,IAA and their precursor on quality and quantity of chickpea plants grown under sandy soil conditions[J]. CIGR Journal,2017(Sp):35-44.
[60]Fazal H,Abbasi B H,Ahmad N,et al. Exogenous melatonin trigger biomass accumulation and production of stress enzymes during callogenesis in medicinally important Prunella vulgaris L. (Selfheal)[J]. Physiology and Molecular Biology of Plants,2018,24(6):1307-1315.
[61]Chen Q,Qi W B,Reiter R J,et al. Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings of Brassica juncea[J]. Journal of Plant Physiology,2009,166(3):324-328.
[62]Pelagio-Flores R,Munoz-Parra E,Ortiz-Castro R,et al. Melatonin regulates Arabidopsis root system architecture likely acting independently of auxin signaling[J]. Journal of Pineal Research,2012,53(3):279-288.
[63]Liang C Z,Li A F,Yu H,et al. Melatonin regulates root architecture by modulating auxin response in rice[J]. Frontiers in Plant Science,2017,8:134.
[64]Park S,Back K. Melatonin promotes seminal root elongation and root growth in transgenic rice after germination[J]. Journal of Pineal Research,2012,53(4):385-389.
[65]Chen Z,Gu Q,Yu X,et al. Hydrogen peroxide acts downstream of melatonin to induce lateral root formation[J]. Annals of Botany,2018,121(6):1127-1136.
[66]Luo F,Cai J H,Zhang X,et al. Effects of methyl jasmonate and melatonin treatments on the sensory quality and bioactive compounds of harvested broccoli[J]. Rsc Advances,2018,8(72):41422-41431.
[67]Cao S F,Song C B,Shao J R,et al. Exogenous melatonin treatment increases chilling tolerance and induces defense response in harvested peach fruit during cold storage[J]. Journal of Agricultural and Food Chemistry,2016,64(25):5215-5222.
[68]Shi H T,Qian Y Q,Tan D X,et al. Melatonin induces the transcripts of CBF/DREB1s and their involvement in both abiotic and biotic stresses in Arabidopsis[J]. Journal of Pineal Research,2015,59(3):334-342.
[69]Kaur H,Mukherjee S,Baluska F,et al. Regulatory roles of serotonin and melatonin in abiotic stress tolerance in plants[J]. Plant Signaling & Behavior,2015,10(11):e1049788.
[70]Hernandez-Ruiz J,Arnao M B. Relationship of melatonin and salicylic acid in biotic/abiotic plant stress responses[J]. Agronomy,2018,8(4):33.
[71]Zhang N,Sun Q Q,Zhang H J,et al. Roles of melatonin in abiotic stress resistance in plants[J]. Journal of Experimental Botany,2015,66(3):647-656.
[72]Zhang N,Zhao B,Zhang H J,et al. Melatonin promotes water-stress tolerance,lateral root formation,and seed germination in cucumber (Cucumis sativus L.)[J]. Journal of Pineal Research,2013,54(1):15-23.
[73]徐向东,孙 艳,孙 波,等. 高温胁迫下外源褪黑素对黄瓜幼苗活性氧代谢的影响[J]. 应用生态学报,2010,21(5):1295-1300.
[74]Lei X Y,Zhu R Y,Zhang G Y,et al. Attenuation of cold-induced apoptosis by exogenous melatonin in carrot suspension cells:the possible involvement of polyamines[J]. Journal of Pineal Research,2004,36(2):126-31.
[75]Tan D X,Manchester L C,Helton P,et al. Phytoremediative capacity of plants enriched with melatonin[J]. Plant Signaling & Behavior,2007,2(6):514-520.
[76]Zhang N,Zhang H,Yang R,et al. Advances in melatonin and its functions in plants[J]. Agricultural Science and Technology,2012,13(9):1833-1837.
[77]李雅洁,张其安,陆晓民. 不同外源物质对低温弱光次生盐渍化复合逆境下黄瓜幼苗生长、抗氧化系统及光合作用的影响[J]. 江苏农业学报,2018,34(2):404-410.
[78]Lu R F,Liu Z Y,Shao Y D,et al. Melatonin is responsible for rice resistance to rice stripe virus infection through a nitric oxide-dependent pathway[J]. Virology Journal,2019,16(1):141.
[79]许秋怡,陈兆晖,季富宴,等. 褪黑素增强盐害条件下水稻幼苗对稻瘟病的抗病能力[J]. 安徽农业科学,2018,46(9):126-128.
[80]Yin L H,Wang P,Li M J,et al. Exogenous melatonin improves Malus resistance to Marssonina apple blotch[J]. Journal of Pineal Research,2013,54(4):426-434.
[81]Shi H T,Chen Y H,Tan D X,et al. Melatonin induces nitric oxide and the potential mechanisms relate to innate immunity against bacterial pathogen infection in Arabidopsis[J]. Journal of Pineal Research,2015,59(1):102-108.
[82]Lee H Y,Back K. Melatonin is required for H2O2-and NO-mediated defense signaling through MAPKKK3 and OXI1 in Arabidopsis thaliana[J]. Journal of Pineal Research,2017,62(2):e12379.
[83]Meng X Z,Zhang S Q. MAPK cascades in plant disease resistance signaling[J]. Annual Review of Phytopathology,2013,51:245-266. 李鳴霄,强 俊,陶易凡,等. 刺五加的生理功能及在水产动物养殖中的应用综述[J]. 江苏农业科学,2020,48(24):25-30.
- 幼儿园户外活动质量与儿童动作发展的关系
- 浅议新形势下幼儿园的管理艺术
- 简析幼儿园自主性游戏活动的有效性
- 初中英语合作学习中存在的问题及对策
- 浅谈幼儿园活动中有效的师幼互动
- 论提高幼儿园区域活动有效性的策略
- 浅谈幼儿动手能力的培养策略
- 幼儿阅读习惯培养策略
- 探究小学语文低年级阅读教学策略
- 学前教育中幼儿自信心的培养策略分析
- 浅议对厌学学生的教学策略
- 浅谈小学汉语拼音教学优化策略
- 小学语文三年级起步作文指导方法初探
- 小学语文教学中字词的训练与积累阐述
- 低年段数学“阅读能力”的培养策略
- 创设睛境,营造氛围,让课堂活起来
- 中小学音乐课堂教学中的困惑与思考
- 在素质教育背景下开展小学美术教学工作
- 学前教育专业教学中幼儿歌曲的弹唱教学策略解析
- 小学美术课堂教学手段有效性的策略
- 创新教学设计提升音乐素养
- 绘本生活化教学模式在幼儿教学中的应用探讨
- 基于班本特色的家长家庭教育理念更新实践探索
- 师幼共参:幼儿自主建构游戏中的发展与策略
- 幼儿主题活动中游戏化教学的运用探讨
- stand alone
- stand-alone
- standalone
- stand-alones
- standard
- standard & poor's 500 index
- standardandpoors500index
- standard cost
- standard costing
- standardcosting
- standarddeduction
- standard deduction
- standarddeviation
- standard deviation
- standardformcontract
- standard-form contract
- standardise
- standardised
- standardises
- standardising
- standard issue
- standardissue
- standardizable, standardisable
- standardization
- standardizations
- 显祖扬宗
- 显祖荣宗
- 显神通
- 显禄
- 显科学
- 显秩
- 显称
- 显突
- 显突水面
- 显章
- 显系
- 显级
- 显结
- 显罚
- 显美
- 显耀
- 显耀名声
- 显耀的名声
- 显耀的样子
- 显耀而美好
- 显耀门第,传扬名声
- 显考
- 显者
- 显而易见
- 显职