刘园园 崔柏宁 王艳
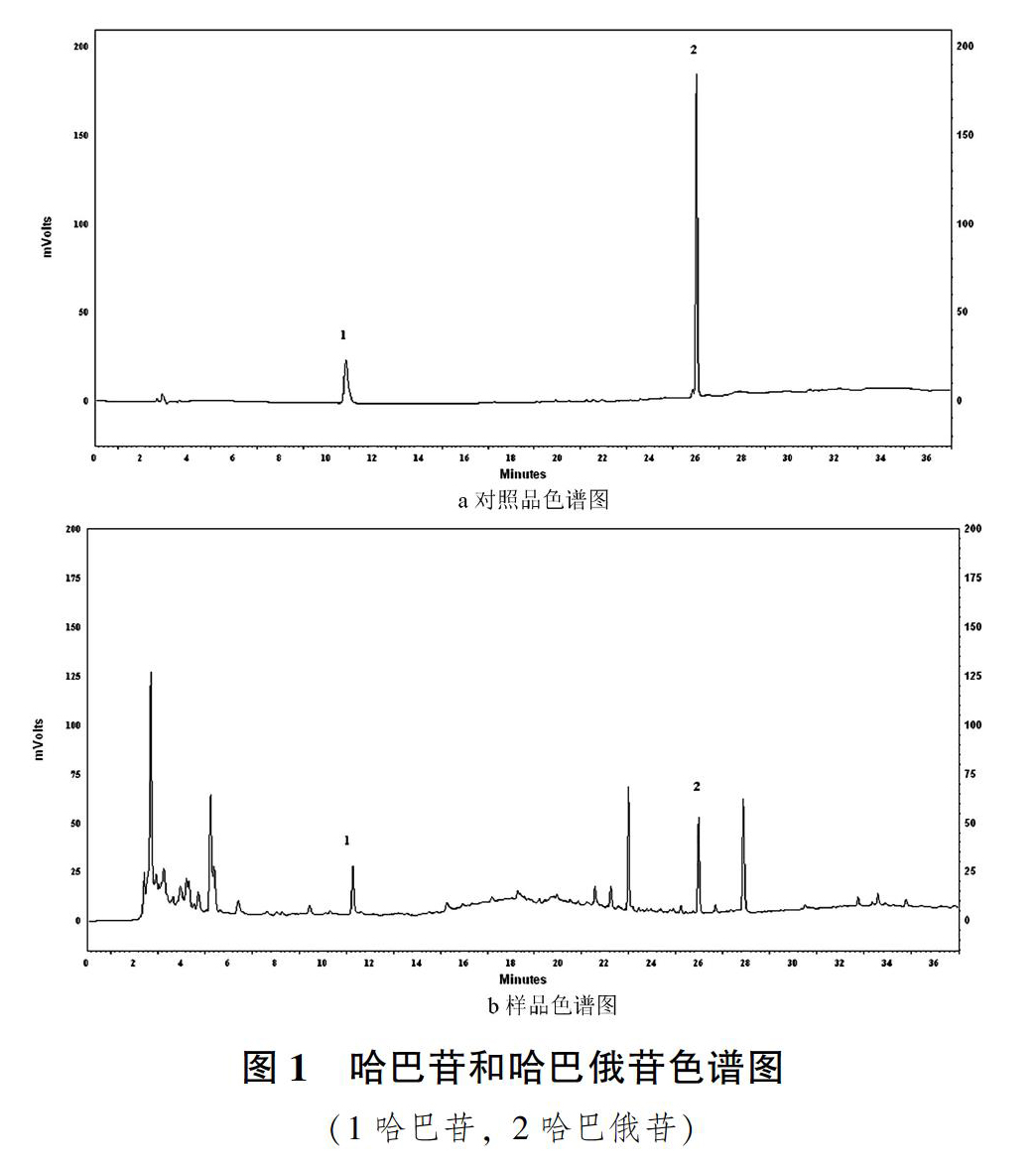
摘 要:优选玄参中哈巴苷和哈巴俄苷的提取工艺,采用单因素试验和L9(34)正交实验考察料液比、提取时间、提取次数对玄参中哈巴苷和哈巴俄苷的提取工艺的影响,玄参中哈巴苷和哈巴俄苷的最优提取工艺为料液比为1∶12,提取3次,每次1.5h。优选提取工艺稳定可靠,可为玄参中哈巴苷和哈巴俄苷的提取提供参考。
关键词:玄参;哈巴苷;哈巴俄苷;L9(34)正交试验;提取工艺
中图分类号:S-3 ? ? ? 文献标识码:A
DOI:10.19754/j.nyyjs.20201030019
玄参来源于玄参科植物玄参Scrophularia ningpoensis Hemsl的干燥根,为常用中药。玄参中的环烯醚萜苷类成分哈巴苷和哈巴俄苷具有多种药理活性。哈巴苷能通过抑制氧化应激抑制心肌细胞凋亡[1],还具有保护急性脑缺血的作用[2];哈巴俄苷具有增加免疫力、降压、镇痛、解痉等[3]功效。哈巴苷和哈巴俄苷被认为是玄参的特征性有效成分,为含有玄参的中成药的指标检测成分[4-7]。因玄参中的哈巴苷和哈巴俄苷的药理活性显著,优化其提取工艺十分必要。
1 仪器与材料
1260型高效液相色谱仪(美国Agilent公司);JA3003电子天平(上海菁海仪器有限公司);数显恒温水浴锅(金坛市科析仪器有限公司);DHG-9240A烤箱;KDM型调温电热套(天津市静海县工兴电器厂);哈巴苷对照品(南京普仪生物科技有限公司);哈巴俄苷对照品(南京普仪生物科技有限公司);娃哈哈纯净水(杭州娃哈哈集团有限公司);乙腈(Fisher公司,色谱级);磷酸(TED公司,色谱纯);其他试剂为分析纯。
2方法
2.1 哈巴苷和哈巴俄苷含量测定方法建立[8-9]
2.1.1 色谱条件
色谱柱:Orca C18柱(250 mm×4.6mm,5μm);
流动相:乙腈(A)-0.1%甲酸溶液(B);
梯度洗脱:0~10min,3%~10%A;10~20min,10%~33%A;20~25min,33%~50%A;25~30min,50%~80%A;30~35min,80%A;35~37min,80%~93%;
檢测波长:210nm;
流速:1mL·min-1。
2.1.2 对照品溶液的制备
取哈巴苷、哈巴俄苷适量,分别精密称定,加30%甲醇制成含哈巴苷0.146mg·mL-1、哈巴俄苷0.071mg·mL-1的混合对照品溶液。
2.1.3 供试品溶液的制备
取玄参药材粉碎过3号筛,取粉末约0.5g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50mL,密塞,称定重量,浸泡1h,超声处理(功率500W,频率40kHz)45min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀滤过,取续滤液,即得。
2.1.4 线性关系考察
分别精密吸取“2.1.2”项下混合对照品溶液4、6、8、12、16、20μL注入液相色谱仪,按上述色谱条件记录峰面积。以峰面积积分值(Y)对哈巴苷质量(X)作回归曲线,得回归方程:Y=163461X+14023.1(R2=0.9993),说明哈巴苷在0.584~2.92μg范围内线性关系良好;以峰面积积分值(Y)对哈巴俄苷质量(X)作回归曲线,得回归方程:Y=969097X+25231.3(R2=0.9995),说明哈巴俄苷在0.284~1.42μg范围内线性关系良好。
2.1.5 精密度试验
取供试品溶液,连续进样5次,按上述色谱条件测定哈巴苷和哈巴俄苷的色谱峰峰面积RSD值分别为2.13%和2.25%,表明本方法精密度良好。
2.1.6 稳定性试验
分别在供试品制备后的0、2、4、6、8h,精密吸取上述供试品溶液10μL注入液相色谱仪,分别记录与哈巴苷和哈巴俄苷对应的标准品保留时间相同的色谱峰峰面积RSD值分别为2.47%和2.59%。
2.1.7 重复性试验
取同一批样品6份,精密称定,按“2.1.3”项下的方法平行制备,按“2.1.1”项下的色谱条件进样,连续重复进样6次,测得哈巴苷和哈巴俄苷的含量的RSD值分别为1.92%和1.75%。
2.1.8 加样回收率试验
称取已知含量的样品0.25g,精密称定,共6份,每份分别精密加入哈巴苷1818.8μg和哈巴俄苷279.5μg,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项下色谱条件分别测定与对应的哈巴苷标准品保留时间相同的色谱峰峰面积,计算加样回收率为96.12%,RSD值为2.84%。同法测定哈巴俄苷的加样回收率为98.04%,RSD值为2.62%。
2.2 单因素试验
综合评分=出膏率×0.3+哈巴苷和哈巴俄苷总含量×0.7。
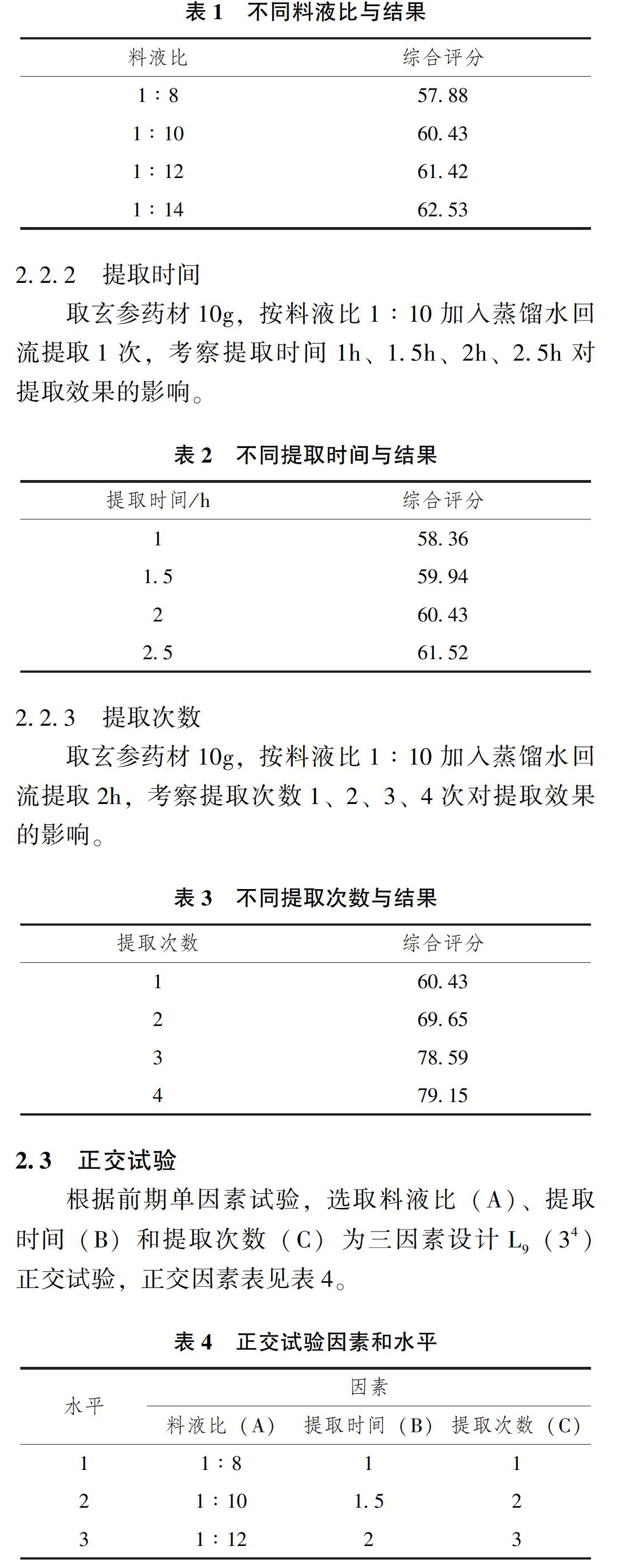
2.2.1 料液比
取玄参药材10g,加入蒸馏水回流提取1次,每次2h,考察料液比1∶8、1∶10、1∶12、1∶14对提取效果的影响。
2.2.2 提取时间
取玄参药材10g,按料液比1∶10加入蒸馏水回流提取1次,考察提取时间1h、1.5h、2h、2.5h对提取效果的影响。
2.2.3 提取次数
取玄参药材10g,按料液比1∶10加入蒸馏水回流提取2h,考察提取次数1、2、3、4次对提取效果的影响。
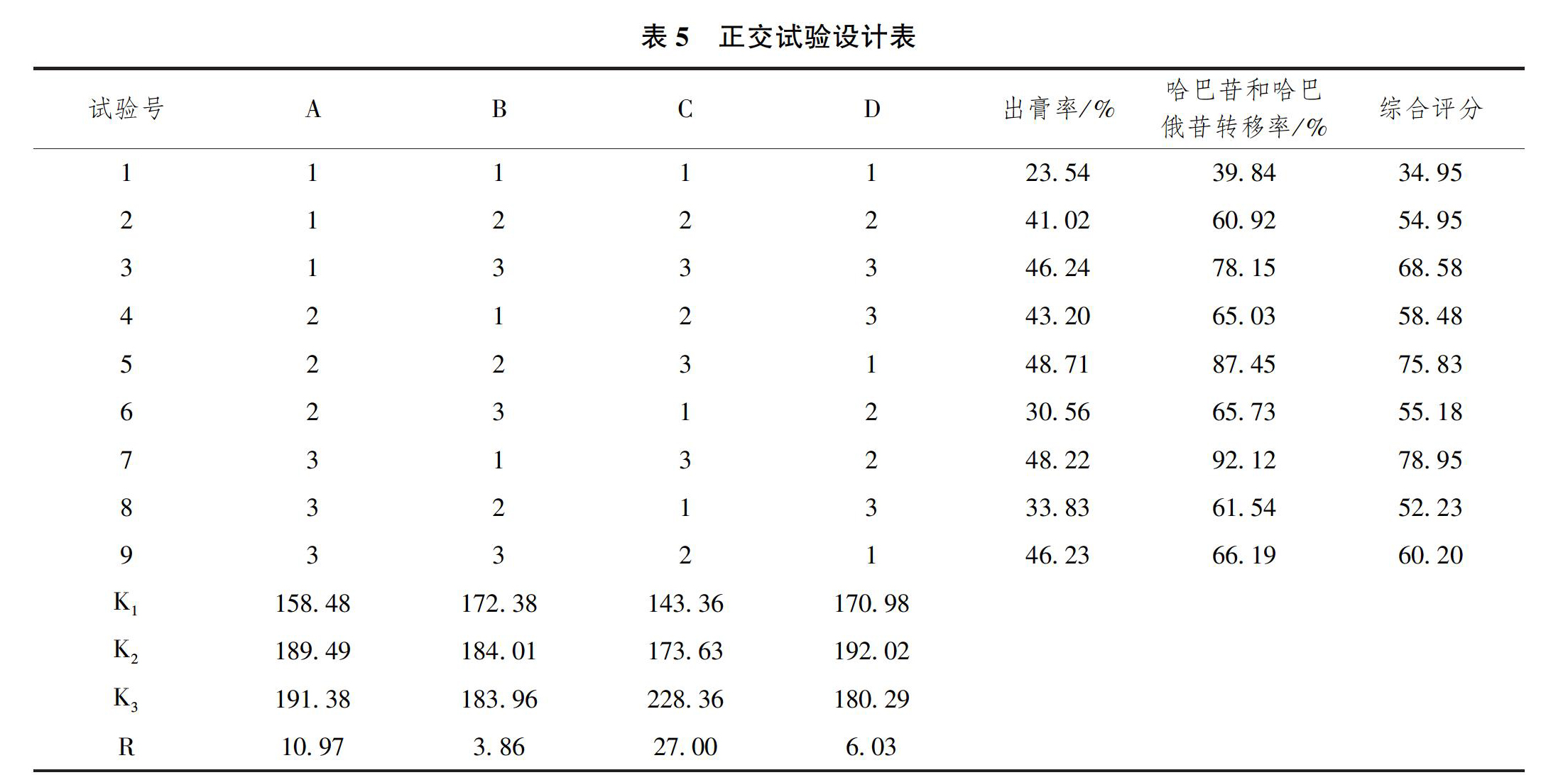
2.3 正交试验
根据前期单因素试验,选取料液比(A)、提取时间(B)和提取次数(C)为三因素设计L9(34)正交试验,正交因素表见表4。
称取玄参10g,连续称取9份,按照L9(34)正交表的实验条件进行试验,以哈巴苷和哈巴俄苷的量为指标,对提取工艺进行优化选择,正交试验设计表见表5。
各因素对玄参中哈巴苷和哈巴俄苷提取工艺影响程度:C>A>B,优化的提取工艺为A3B2C3,即料液比为1∶12,提取3次,每次1.5h。
2.4 验证试验
按照上述优选出来的提取工艺A3B2C3,进行3组验证试验,结果见表7。试验表明优选的提取工艺条件符合预期结果,提取工艺稳定可行,正交试验优选方案合理。
3 結语
玄参中的环烯醚萜苷类有效成分哈巴苷和哈巴俄苷等为九碳骨架结构,成分分离和提纯相对容易。这类环烯醚萜苷类具有抗炎、抗微生物、保肝、降血糖等药理作用[10]。本文优化提取玄参中哈巴苷和哈巴俄苷的工艺,为玄参的开发和利用奠定基础。
参考文献
[1] 徐博,郭伟,刘丹平等.哈巴苷对H2O2诱导的大鼠心肌细胞H9c2氧化应激损伤的保护作用[J].中西医结合心脑血管病杂志,2019,17(15):2276-2281.
[2]周炳文,楼烨亮,钟晓明等.哈巴苷对急性脑缺血小鼠神经细胞及caspase非依赖性凋亡通路的影响[J].中国药理学通报,2017,33(12):1754-1761.
[3]许洪波,高春晖,蔡兴航等.玄参饮片标准汤剂制备及质量标准研究[J].中国中药杂志,2019,44(12):2493-2498.
[4]江建丽.高效液相色谱多波长法同时测定中风合剂中梓醇、哈巴苷、绿原酸和芍药苷含量[J].中国药业,2019,28(15):23-25.
[5]黄春兰,朱新华,叶慧文等.HPLC法测定舒筋跌打膏中哈巴苷、哈巴俄苷、梓醇、毛蕊花糖苷、焦地黄苯乙醇苷B1、马替诺皂苷和藁本内酯[J].现代药物与临床,2019,34(07):1960-1963.
[6]邱学伟,张春辉,卢京光等.一测多评法测定咽炎片玄参中3种主要成分含量[J].中国药业,2018,27(06):14-17.
[7]王海丽,蒙蒙.HPLC法测定儿童回春颗粒中哈巴苷和哈巴俄苷的含量[J].西北药学杂志,2016,31(06):584-587.
[8]向采芹,李希,冯建安等.HPLC双波长切换同时测定玄参药材中哈巴苷和哈巴俄苷的含量[J].中药与临床,2017,8(06):10-12.
[9]张玉秀,李桂娟.正交实验法提取苍术多糖的工艺优化及抗氧化性能研究[J].广东化工,2019,46(17):58-60.
[10]高鑫,董婉茹,陈平平等.玄参中环烯醚萜苷不同构架的药理学研究[J].哈尔滨商业大学学报(自然科学版),2016,32(06):655-658.
(责任编辑 周康)
- 谈如何加强大项工程阶段审计监督
- 生态文明背景下自然资源资产离任审计问题研究
- 领导干部离任经济责任审计的难点与解决方案
- 施工企业内部审计存在的问题及对策研究
- 强化经济责任审计的探索与思考
- 新常态下经济责任审计的发展定位及方向
- 谈县区级财政专项资金审计中发现的问题及对策
- 浅析国家审计与民间审计之区别和联系
- 浅谈企业内部审计质量控制问题
- 基于中介审计视角的“忽悠式重组”问题的探讨
- “互联网+审计”时代审计人才职业胜任力的重构与培养研究
- 上市公司内部控制信息披露的问题和对策分析
- 会计内部控制策略在事业单位的分析
- 浅谈民办高校如何加强完善内控规范建设
- 试析技工院校内控制度的构建及完善
- 简述医院内部控制在固定资产管理中的实践与应用
- 基于全面预算管理的企业内部控制之我见
- 探讨内控导向下房地产项目的成本控制方法
- 对会计信息化背景下的企业内部控制研究
- 基于内部控制视角的小金库的防范与治理
- 试析基层医疗保险经办机构基金的内部控制管理
- 医院实施内部控制的必要性及路径探讨
- 浅议中小企业内部控制常见问题
- 浅议煤炭企业会计内部控制与监督
- 论行政事业单位如何加强内部控制建设
- technicalness
- technicalnesses
- technicals
- technical support
- technicalsupport
- technician
- technicians
- technique
- techniques
- techno
- techno-economic
- techno-environment
- technographic
- technological
- technologically
- technologies
- technologism
- technologist
- technologists
- technology
- technologyheavy
- technology-ˌheavy
- technonomy
- technophile
- technophobe
- 磨炼自己,使有高尚的节操
- 磨炼自己,使道德修养更加提高
- 磨炼节操
- 磨炼节操品德
- 磨炼身心
- 磨烦
- 磨牙
- 磨牙凿齿
- 磨牙吮血
- 磨牙斗嘴,漫谈闲聊
- 磨牙臼齿
- 磨牙费嘴
- 磨牙逗嘴儿
- 磨牛
- 磨牛如故
- 磨牛迹陈
- 磨牛陈迹
- 磨玉的青石
- 磨玉石
- 磨琢
- 磨琢使光滑或光亮
- 磨琢坚硬之物
- 磨的底盘
- 磨盘
- 磨盘上放算盘——推算