马粒雅 王闻 迟雯丹

摘要 将中华乌塘鳢置于密闭的玻璃容器中,在溶解氧浓度分别为3.5、1.0、0.5、0.3、0.05、0、0 mg/L(将鱼憋2 h后)时分别进行取样,测定肝脏、肠和鳃中的酶活。结果表明,中华乌塘鳢肝脏组织中的抗氧化酶活性最高,肠组织中免疫酶活性最高,而外周组织(鳃)的酶活性远低于其他组织;当溶解氧浓度降至约0.31 mg/L时,抗氧化酶和免疫酶活性均明显下降,这可能是中华乌塘鳢进入了一種类似休眠的状态,整个新陈代谢降低仅能维持基本的生命状态;当水中溶解氧几乎消耗完全时,中华乌塘鳢为维持其基本生命特征而进行自身调节,抗氧化酶和免疫酶的活性又出现明显升高。
关键词 中华乌塘鳢;溶解氧;碱性磷酸酶;超氧化歧化酶;过氧化氢酶
中图分类号 S917.4 文献标识码 A 文章编号 0517-6611(2020)03-0091-04
Abstract Chinese black sleepers were cultured in closed glass vessels,and samples were collected when the concentration of dissolved oxygen was 3.5, 1.0, 0.5, 0.3, 0.05, 0 and 0 mg/L(dissolved oxygen disappeared for 2 hours).The enzyme activities in the liver, intestine and gill were determined. The results showed that the activity of antioxidant enzymes was the highest in the liver and the activity of immune enzymes were most active in intestinal tissues, while both of them were much lower in the gill than that in the liver and intestinal tissues. When the dissolved oxygen concentration dropped to 0.31 mg/L,the activities of antioxidant enzymes and immune enzymes decreased significantly, this might be caused by the fact that Chinese black sleepers entered a state similar to dormancy, so that the entire metabolism was reduced only to maintain the basic state of life. However, when dissolved oxygen in water was almost consumed completely, the activities of antioxidant enzymes and immune enzymes increased again, which might be derived from the selfregulation of Chinese black sleepers to maintain its basic life characteristics.
Key words Chinese black sleeper;Dissolved oxygen;Alkaline phosphatase(AKP);Superoxide dismutase(SOD);Catalase(CAT)
中华乌塘鳢隶属塘鳢科乌塘鳢属,广泛分布于我国黄海南部,东海,南海以及日本海域[1]。中华乌塘鳢是一种低氧耐受性很强的鱼类,通过对其在不同溶解氧浓度下碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的研究来揭示其耐低氧能力[2]。它的存活率很高,能很快将伤口愈合并维持健康的生命体征。另外,中华乌塘鳢的最大特点是对低氧和干露的耐受性很强,即使只在离水的阴湿环境中也能生存7 d左右[3],是一种能够适应当前海洋生态环境变化的优良品种。目前对中华乌塘鳢的研究主要集中在繁殖、养殖方面,而对该种鱼在低溶解氧条件下的存活机理迄今尚未见报道。
当鱼类受到外界环境因素的影响时,激发非特异性免疫系统是机体用来抵抗外界环境的主要方式。磷酸酶是一类非特异性免疫酶,其活力是衡量免疫功能和机体状态的指标,反映了机体对外界环境的防御能力[4]。碱性磷酸酶(AKP)是其中重要的一种机体功能调节酶,通过促进营养的转运和吸收来加强机体的非特异性免疫能力[5]。当鱼类受到环境胁迫时,碱性磷酸酶活性被激发以抵抗外界条件对自身的影响。目前已有研究表明环境条件(如水温[6-7]、盐度[8-9]、溶解氧[10-11]、重金属[12-13]、有机污染物[14-15]等)的变化能引起鱼体内碱性磷酸酶活性的变化,产生应激反应。
鱼类在水体中不同环境下的生命体征也可以用抗氧化酶活力来反映,从而判定鱼类是否受到外界环境的胁迫。超氧化物歧化酶(SOD)是生物体内一种重要的抗氧化酶,主要通过催化歧化作用将过氧化物自由基转化为过氧化氢(H2O2)和氧(O2),将生物体内有害的活性氧清除[16]。过氧化氢酶(CAT)通过催化分解作用将过氧化氢歧化分解为水(H2O)和氧气(O2),防止细胞受到过氧化氢的毒害作用,为机体提供抗氧化防御能力[7]。目前国内外关于鱼体内抗氧化酶活性受温度[17-20]、盐度[18-20]、溶解氧[21-22]等环境条件胁迫而发生变化的研究很多,但关于中华乌塘鳢的研究却尚未报道。
笔者通过对低氧状态下中华乌塘鳢不同组织内免疫酶和抗氧化酶活性的测定,探究低氧胁迫下中华乌塘鳢不同组织酶活性的差异及低氧条件对酶活性的影响,旨在初步探究中华乌塘鳢的耐低氧机制,为中华乌塘鳢的人工养殖和运输提供一定的理论基础,同时为实现其他生物在低氧条件下的存活提供研究方向。
1 材料与方法
1.1 试验鱼来源和试验用水
试验用鱼为广西海域直接捕捞的样品鱼,选取生命体征良好、平均体重(74.45±13.95)g、平均体长(17.55±1.25)cm的健康中华乌塘鳢进行试验。
试验用水为经沉淀和砂滤的天然海水,盐度为25%~27%,pH为8.1~8.2[8]。
1.2 试验方法
1.2.1 试验设计。
试验采用密封玻璃容器作为呼吸室进行中华乌塘鳢的耗氧试验,基于非侵入式光学氧传感器进行溶解氧测定,将溶氧膜固定于玻璃容器内壁中间位置,注满海水放入试验鱼进行测定,以保持室温25 ℃和密闭条件。
试验设置8个组,Ⅰ组为对照组,只加满海水不放入试验鱼;Ⅱ~Ⅷ组加满海水分别放入10条鱼,Ⅱ~Ⅷ组溶解氧浓度在鱼的呼吸作用下随时间而明显下降,使用溶解氧测定仪(非侵入式光学氧传感器,规格为PreSens Microx 4)每隔1 min对试验容器内海水的溶解氧进行测定(海水的初始溶解氧浓度为6.0 mg/L),当溶解氧浓度降至约3.5、1.0、0.5、0.3、0.05、0、0 mg/L(溶解氧浓度降至0 mg/L后2 h)时分别进行取样,在冰上进行无菌解剖,取肝脏、肠、鳃3种组织装入冷存管中并按顺序编号用液氮冷冻保藏,分别对3种组织的碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)进行酶活测定。
1.2.2 酶活性测定方法。
将冷冻的组织准确称重,按质量体积比1∶9(g∶mL)加入定量生理盐水在冰浴条件下配制成10%的组织匀浆,并保持4 ℃温度,以2 500 r/min的转速离心10 min,取上清液以供测定酶活性。酶活均使用南京建成生物有限公司试剂盒进行测定,按照说明书进行操作。
碱性磷酸酶(AKP)的活力单位定义为1 g组织蛋白在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位,然后再将金氏单位换算成国标。
超氧化物歧化酶(SOD)的活力单位定义为1 mg组织蛋白在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活力单位[11]。
过氧化酶(CAT)的活力单位定义为1 mg组织蛋白1 s分解1 mol的过氧化氢(H2O2)的量为1个酶活力单位[12]。
1.3 数据处理
使用Microsoft Excel 2013和SPSS 16.0统计软件进行数据处理和分析,结果均以平均值±标准误(Mean±SD)表示。
2 结果与分析
2.1 中华乌塘鳢耗氧率测定
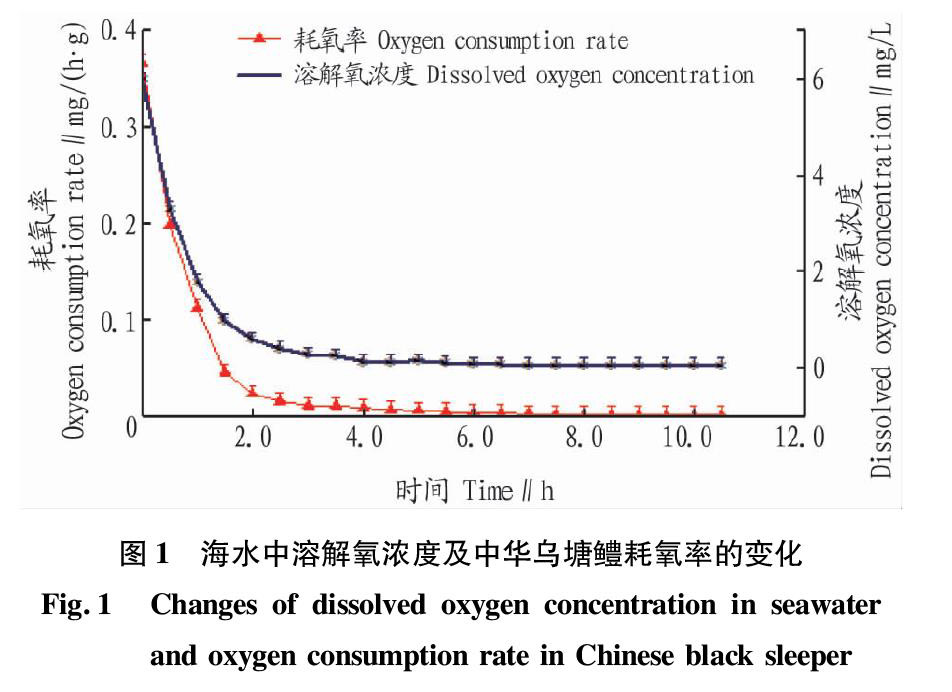
将中华乌塘鳢置于密闭的容器中,对其耗氧率进行测定。从图1可以看出,在2 h内,中华乌塘鳢的耗氧率从最初的0.2 mg/(h·g)降低至002 mg/(h·g)。随着溶解氧浓度的进一步降低,中华乌塘鳢表现出明显的活力降低,仅有鳃和鳍微动,其耗氧率也缓慢下降,接近于零。持续4 h后,耗氧率降至零(容器内海水溶解氧浓度为0 mg/L),中华乌塘鳢仍能在这种状态下存活4 h左右。
2.2 低氧胁迫下不同组织AKP活性的变化
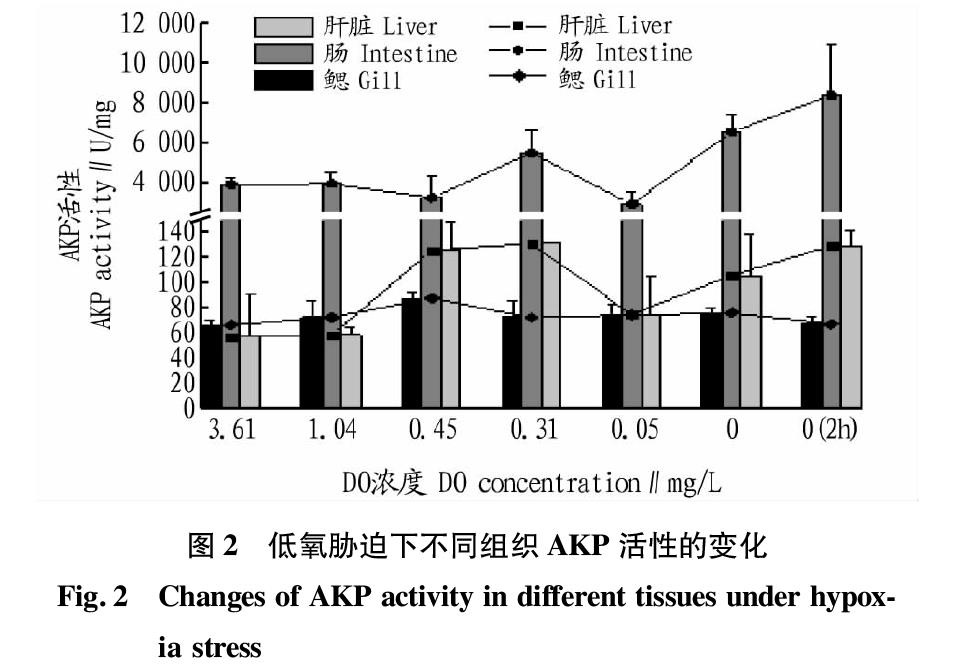
对中华乌塘鳢不同组织中的AKP活性进行测定,观察发现在低氧状态下肝脏组织中AKP活性为10~20 U/mg,肠组织中AKP活力为400~1 200 U/mg,鳃中AKP活性为9~12 U/mg。从图2可以看出,肠组织中AKP活性远高于肝脏和鳃,而肝脏中AKP活性略高于鳃。这表明肠组织是中华乌塘鳢体内AKP酶的主要分布区,在溶解氧较低的状态下肠组织受到影响,会分泌更多的AKP以适应环境的变化。
因为中华乌塘鳢体内不同组织所含AKP活性的差异较大,分别对肝脏、肠和鳃中溶解氧浓度对AKP活性的影响进行分析。从图2可以看出,随着溶解氧浓度的逐渐降低,肝脏和肠中AKP活性基本不发生变化。当溶解氧浓度进一步降低时,AKP活性开始上升;溶解氧濃度达到0.31 mg/L时,AKP活性出现峰值随后开始下降(P>005);当溶解氧浓度达到0.05 mg/L时,AKP活性再次升高(P>0.05)。鳃中AKP活性也随着溶解氧浓度的降低呈现先上升后下降的趋势,但变化范围并不大,且各试验组间无显著差异(P>005)。
2.3 低氧胁迫下不同组织抗氧化酶活性的变化
对中华乌塘鳢不同组织中SOD和CAT活性分别进行测定,发现低氧状态下肝脏组织中SOD活性为550~750 U/mg,肠组织中SOD活性为170~200 U/mg,鳃中SOD活性为50~75 U/mg(图3)。从图3可以看出,SOD活性在肝脏、肠和鳃中从高到低依次为肝脏、肠、鳃,且肝脏中SOD活性远高于其他组织。CAT活性在中华乌塘鳢体内各组织中的分布比例与SOD活性相似,其活性分别为肝脏35~55 U/mg,肠组织2~5 U/mg以及鳃组织0.4~0.8 U/mg(图4)。这表明抗氧化酶分布在中华乌塘鳢体内的不同组织中,但肝脏所占的比重较大,且SOD活性相较于CAT活性高得多。
图3呈现出肝脏、肠和鳃组织中SOD活性随着溶解氧浓度下降的变化趋势。肝脏和肠组织中SOD活性的变化趋势与AKP活性相似,SOD活性先不随溶解氧浓度而变化,当溶解氧浓度达到1.04 mg/L时SOD活性开始上升,达到峰值时开始呈下降趋势,最终当溶解氧浓度几乎为0 mg/L时,SOD活性又逐渐增大(P>0.05)。鳃中的SOD活性随溶解氧浓度的下降呈上升下降交替变化的趋势,当溶解氧浓度下降为005 mg/L时,SOD活性不再下降而呈现明显的上升趋势(P>0.05)。
图4分别显示出肝脏、肠和鳃组织中CAT活性随着溶解氧浓度下降的变化趋势。肝脏和肠中CAT活性随着溶解氧浓度的降低而呈现出先升高后下降的趋势,且各试验组间无显著差异(P>0.05),当溶解氧完全耗尽时,试验鱼体内CAT活性开始上升(P>0.05)。鳃中CAT的活性始终保持在0.5 U/mg左右,几乎不随溶解氧浓度的变化而发生变化(P>0.05)。
3 讨论
3.1 低氧胁迫对不同组织AKP活性的影响
鱼类在整个生存过程中主要依靠非特异性免疫系统抵抗外界条件的影响。AKP作为生物体内第四道防线中非常重要的非特异性免疫酶之一,其活力是鱼类自身免疫系统的重要指标[23]。该研究发现在中华乌塘鳢肝脏、肠和鳃组织中肠组织的AKP活性较高,且受氧浓度的影响较大,而肝脏的AKP活性略高于鳃。依据相关文献报道,肠组织与营养物质消化、吸收和转运有着密切关系[24-25],这与AKP的作用相适配,因此在中华乌塘鳢肠内AKP活性较高。肝脏是生物体内主要的解毒器官,通过AKP的作用将有毒物质分解,以维持稳定状态[26-28],因此肝脏中也存在一定量的AKP。鳃主要具有呼吸、滤食和排泄等功能,并不是鱼类的免疫器官,因此AKP的活性较小。
当溶解氧浓度大于0.45 mg/L时,中华乌塘鳢的生命体征良好,体内的免疫性酶不受溶解氧变化的影响而保持稳定状态。随着溶解氧浓度的进一步下降,中华乌塘鳢做出应激反应,通过提高AKP的活性来加强自身的非特异性免疫能力。当溶解氧浓度达到0.31 mg/L时,中华乌塘鳢为了维持基本生命体征而降低自身新陈代谢水平,使机体进入近似休眠状态,AKP活性也随之下降。当溶解氧浓度下降至0.05 mg/L时,试验鱼呼吸受阻,生命体征出现异常,抗氧化酶通过将体内的自由基转换,以得到更多的氧气维持呼吸,而转化过程中产生的有毒有害物质可以被AKP降解,因此AKP的活性升高。
3.2 低氧胁迫对不同组织抗氧化酶活性的影响
与其他有氧生物一样,鱼体内具有完善的抗氧化防御系统,以抵抗正常新陈代谢活动时产生的对身体有害的活性氧物質[29]。SOD和CAT是抗氧化酶系统的重要组成部分,对于维持体内自由基平衡有重要的作用[30]。肝脏是生物体内新陈代谢和氧气消耗的主要组织,肝脏中SOD通过歧化作用将过氧化物自由基转化为过氧化氢(H2O2)和氧气(O2)以在低氧状态下维持生命,而CAT可将转化产物过氧化氢(H2O2)分解为水(H2O)和氧气(O2),在得到生命所需氧气的同时将过氧化氢分解,以提高自身抗氧化能力。抗氧化酶分布在中华乌塘鳢体内的不同组织中,但肝脏所占的比重较大,且SOD的活性相较于CAT活性高得多。
当溶解氧浓度大于0.45 mg/L时,中华乌塘鳢体内抗氧化防御系统相关的SOD和CAT通过自身的活性调节来维持体内自由基的平衡,并未随着溶解氧的降低有明显变化。当溶解氧浓度进一步下降时,中华乌塘鳢开始出现应激反应通过提高抗氧化酶活性来加强机体抗氧化能力,维持生命体征的正常。当溶解氧浓度降低至0.31 mg/L时,抗氧化酶活性降低,中华乌塘鳢表现出明显的活力减少,仅有鳃和鳍微动,整体新陈代谢水平下降。当溶解氧浓度基本耗尽时,试验鱼无法吸收水中的氧进行呼吸,只能通过调节抗氧化酶活性来促进氧化自由基的分解生成氧气,以供自身呼吸。
该研究通过对中华乌塘鳢在低氧条件下耗氧率及不同组织中免疫酶和抗氧化酶活性变化进行分析,观察发现中华乌塘鳢在溶解氧浓度开始下降的过程中耗氧率快速下降,免疫酶和抗氧化酶的活性有明显的上升趋势;然而,当溶解氧浓度降至0.31 mg/L时,中华乌塘鳢活力明显降低。为了维持其生命特征,整个机体的新陈代谢水平开始下降,导致免疫酶和抗氧化酶下降。随着氧气的进一步消耗,中华乌塘鳢的耗氧率降为0 mg/(h·g),免疫活性酶和抗氧化活性酶的活性明显升高,使其仍能在这种状态下维持4 h左右。初步认为中华乌塘鳢的耐氧机制大约在溶解氧浓度为0.31 mg/L时开始启动,通过降低自身的新陈代谢水平维持生命特征,使机体处于近似于休眠状态。当水中溶解氧几乎为零时,为了维持机体基本的生命特征,体内的酶又重新被激活,肝脏中抗氧化酶通过分解体内氧化自由基来维持生命,同时免疫酶将产生的有毒有害物质转运,并在肠组织中通过免疫酶的作用将其降解吸收。
参考文献
[1] 钟爱华,李明云.中华乌塘鳢的生物学特性及人工育苗研究进展[J].浙江海洋学院学报(自然科学版),2002,21(3):269-272.
[2] 张华军,李卓佳,张家松,等.凡纳滨对虾免疫指标变化与其养殖环境理化因子的关系[J].大连海洋大学学报,2011,26(4):356-361.
[3] 郑守专.中华乌塘鳢池塘养殖技术[J].现代农业科技,2012(18):271-272.
[4] 谢丽玲,谢俊,赵斌,等.重金属污染下龟壳攀鲈组织中ACP和AKP的活力比较[J].生态毒理学报,2016,11(3):323-330.
[5] 薛晓强,赵月,王帅,等.饲料脂肪水平对血鹦鹉幼鱼肝脏免疫及抗氧化酶的影响[J].中国渔业质量与标准,2018(3):61-67.
[6] 彭婷,胡庭俊,林勇,等.低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响[J].水产科学,2012,31(5):259-263.
[7] 李文龙,梁兴明,梁萌青,等.温度对大菱鲆幼鱼生长及免疫相关酶活性的影响[J].水产科学,2017,36(3):311-316.
[8] 支兵杰,刘伟,赵春刚,等.盐度对大麻哈鱼幼鱼消化酶及碱性磷酸酶活力的影响[J].上海海洋大学学报,2009,18(3):289-294.
[9] 白秀娟,卢伙胜,刘晓彬,等.盐度、pH胁迫对茂名海域文昌鱼磷酸酶活性的影响[J].海洋通报,2009,28(4):42-46.
[10] 王晓雯,朱华,马国庆.高溶氧对西伯利亚鲟幼鱼非特异性免疫指标的影响[J].四川农业大学学报,2017,35(1):93-98.
[11] 郑慧,李彬,荣小军,等.盐度和溶解氧对刺参非特异性免疫酶活性的影响[J].渔业科学进展,2014,35(1):118-124.
[12] 孔祥会,刘占才,郭彦玲,等.汞暴露对草鱼器官组织中碱性磷酸酶活性的影响[J].中国水产科学,2007,14(2):270-274.
[13] 詹付凤,赵欣平.重金属镉对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J].四川动物,2007,26(3):641-643.
[14] 田丽粉,任仲,崔毅,等.胜利原油对褐牙鲆仔稚鱼的急性毒性和幼鱼碱性磷酸酶的影响[J].海洋水产研究,2008,29(6):95-100.
[15] 刘伍香,杜青平,李彦旭,等.1,2,4-三氯苯对斑马鱼体内SOD、CAT和AKP活性影响[C]//持久性有机污染物论坛2011暨第六届持久性有机污染物全国学术研讨会论文集.北京:中国化学会,2011.
[16] LUSHCHAK V I,LUSHCHAK L P,MOTA A A,et al.Oxidative stress and antioxidant defenses in goldfish Carassius auratus during anoxia and reoxygenation[J].American journal of physiology regulatory integrative & comparative physiology,2001,280(1):100-107.
[17] 冯广朋,庄平,章龙珍,等.温度对中华鲟幼鱼代谢酶和抗氧化酶活性的影响[J].水生生物学报,2012,36(1):137-142.
[18] 郭黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[19] 强俊,任洪涛,徐跑,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响[J].应用生态学报,2012,23(1):255-263.
[20] 杨健,陈刚,黄建盛,等.温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J].广东海洋大学学报,2007,27(4):25-29.
[21] 况新宇,王晓雯,朱华.高溶氧量对西伯利亚鲟抗氧化酶活力及肝脏损伤相关指标的影响[J].水产科技情报,2016,43(4):198-202.
[22] 杨凯.溶氧水平对黄颡鱼生长、代谢及氧化应激的影响[D].武汉:华中农业大学,2010.
[23] WAN X,BI J C,GAO X J,et al.Partial enteral nutrition preserves elements of gut barrier function,including innate immunity,intestinal alkaline phosphatase (IAP)level,and intestinal microbiota in mice[J].Nutrients,2015,7(8):6294-6312.
[24] 張健东,陈刚.中华乌塘鳢耗氧率和窒息点的研究[J].水产养殖,2002(4):28-31.
[25] 庄平,王妤,章龙珍,等.盐度骤降对点篮子鱼存活率及肝脏抗氧化酶活性的影响[J].复旦学报(自然科学版),2011,50(3):366-372.
[26] 丰程程,张颖,张永泉,等.哲罗鱼胚胎至仔稚幼鱼期主要免疫指标和抗氧化酶的活性变化[J].淡水渔业,2013,43(6):35-38,50.
[27] MCCORMICK S D.Endocrine control of osmoregulation in teleost fish[J].American zoologist,2001,41(4):781-794.
[28] 施兆鸿,岳彦峰,彭士明,等.饲料脂肪水平对褐菖鲉血清生化指标、免疫及抗氧化酶活力的影响[J].中国水产科学,2013,20(1):101-107.
[29] DE ZOYSA M,WHANG I,LEE Y,et al.Transcriptional analysis of antioxidant and immune defense genes in disk abalone(Haliotis discus discus)during thermal,lowsalinity and hypoxic stress[J].Comparative biochemistry & physiology part B:Biochemistry & molecular biology,2009,154(4):387-395.
[30] IM E,KIM Y S,KIM Y S,et al.Mo1755 myeloid differentiation factor 88(MYD88)is the linchpin of antitumor immunity against phosphatase and tensin homologue(PTEN)associated intestinal tumor development and metastasis[J].Gastroenterology,2015,148(4):703.
- 如何有效组织大班幼儿参观活动
- 浅谈幼儿园游戏中教师的组织和指导
- 生成活动中教师主导作用的发挥
- 顺应发展,让幼儿与游戏材料有效互动
- 贯彻指南要求,让幼儿快乐成长
- 高职高专英语文化教学之我见
- 创意产业发展对高职文化创意设计类专业的影响
- 高职院校建筑工程类专业特色办学模式研究
- 高职院校提升学生质量要解决的几个突出问题
- 浅谈高职高专医学类院校开设《物理学》课程的重要性
- 关于信息化对职业教育管理发展推动的探讨
- 论高职院校图书馆开展人文素质教育的有效途径
- “以赛促教、以赛促学”
- 高职培训实效性研究
- 高职数字出版专业人才培养模式探索与实践
- 高职汽车运用技术专业设置与人才培养目标探讨
- 高职英语教学中文化导入的模式研究
- 高职院校教学资源网站建设现状与建设思路
- 浅谈高职学生能力的培养
- 试论英语写作大赛对高职院校公共英语写作教学的影响
- 国内外高职院校课程体系的比较及启示
- 体育教学中的交流活动刍议
- 浅析篮球游戏在篮球教学中应用的作用及教学要求
- 对优化高校体育教学模式的全面思考
- 多元立体式舞蹈教学对幼师生发展价值的探讨
- marketing
- marketing/advertising/promotion/publicity/public relations
- marketing board
- marketingboard
- marketing communications
- quantifier
- quantifiers
- quantifiers'
- quantifies
- quantify
- quantifying
- quantitative
- quantitatively
- quantitativeness
- quantitativenesses
- quantitativist
- quantities
- quantitively
- quantitiveness
- quantitivenesses
- quantity
- quantity survey
- quantitysurveyor
- quantity surveyor
- quantity surˌveyor
- 中华人民共和国国务院
- 中华人民共和国国家安全部
- 中华人民共和国国庆日
- 中华人民共和国国徽
- 中华人民共和国国旗
- 中华人民共和国国歌
- 中华人民共和国宪法
- 中华人民共和国开国大典
- 中华人民共和国教育法
- 中华人民共和国民事诉讼法
- 中华人民共和国民法通则
- 中华人民共和国监察部
- 中华人民共和国第一届全国人民代表大会第一次会议
- 中华人民共和国行政诉讼法
- 中华人民共和国首都
- 中华全国体育总会
- 中华全国妇女联合会
- 中华全国学生联合会
- 中华全国工商业联合会
- 中华全国归国华侨联合会
- 中华全国总工会
- 中华全国文艺界抗敌协会
- 中华全国青年联合会
- 中华大地上出现的优秀杰出人才
- 中华大字典