邵彪 周小兰 王琳琳 陈刚


摘 要:为改善产品品质,肉制品加工过程中常常添加植物源性成分,当前转基因农作物的商品化及其在市场上的广泛流通导致肉制品中被带入植源性转基因成分的风险增加。以转基因植物中常涉及的调控元件CaMV 35S启动子、NOS终止子以及标记基因NPTⅡ为检测目标,设计相应的引物和Taq man探针,利用载体pRⅠ 101-AN DNA为模板,通过优化反应体系和反应参数,建立肉制品中植源性转基因成分的单重和多重荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测方法。通过比较分析,考察多重荧光定量PCR检测方法的灵敏性、重复性和准确性,结果表明,多重荧光定量PCR检测方法灵敏度高、重复性好且与单重体系的检测结果具有很好的一致性。
关键词:多重荧光定量PCR;肉制品;植源性转基因成分
Development of a Multiplex Fluorescence Quantitative Polymerase Chain Reaction Assay for Detecting
Added Genetically Modified Ingredients Derived from Plants in Meat Products
SHAO Biao1, ZHOU Xiaolan2, WANG Linlin1, CHEN Gang1,*
(1.Nantong Products Quality Supervision and Inspection Institute, Nantong 226011, China;
2.Analysis and Testing Center, Nantong University, Nantong 226019, China)
Abstract: Plant-derived components are often added to meat products during processing to improve their quality. The commercialization and wide circulation in the market of genetically modified crops bring increasing risk of introducing genetically modified components into meat products. In this study, a multiplex fluorescence quantitative polymerase chain reaction (PCR) assay was described for detecting added genetically modified ingredient derived from plants in meat products. Specific primers and Taq man probes targeting the CaMV 35S promoter, NOS terminator and neomycin phosphotransferase Ⅱ (nptⅡ) marker gene were designed and the pRⅠ 101-AN DNA vector was used as template. The sensitivity, repeatability and accuracy of the multiplex PCR assay were confirmed by comparison with traditional PCR. Consistent results were obtained using the two methods.
Keywords: multiplex fluorescence quantitative polymerase chain reaction; meat products; genetically modified ingredient derived from plants
DOI:10.7506/rlyj1001-8123-201801007
中圖分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2018)01-0041-05
引文格式:
邵彪, 周小兰, 王琳琳, 等. 肉制品中植源性转基因成分多重荧光定量PCR检测方法的建立[J]. 肉类研究, 2018, 32(1): 41-45. DOI:10.7506/rlyj1001-8123-201801007. http://www.rlyj.pub
SHAO Biao, ZHOU Xiaolan, WANG Linlin, et al. Development of a multiplex fluorescence quantitative polymerase chain reaction assay for detecting added genetically modified ingredients derived from plants in meat products[J]. Meat Research, 2018, 32(1): 41-45. DOI:10.7506/rlyj1001-8123-201801007. http://www.rlyj.pub
肉制品因其独特的风味深受广大消费者的喜爱,是人们日常饮食的重要组成部分。随着经济的大幅增长和人民生活水平的持续提高,我国肉制品产量和消费量均居世界前列。在现代肉制品加工过程中,为改善肉制品的品质、优化产品质量、确保营养均衡,植物源性成分,如植物蛋白[1-2]、淀粉[3-4]、膳食纤维[5-6]、食用胶[7-8]、植物油以及各种调味品等被运用到肉制品加工中。
近20多年,转基因作物随着基因工程技术的成熟而迅速发展,截至2016年全球转基因作物种植面积累计达21 亿hm2[9],我国转基因植物种植面积也在逐年递增[10-11]。目前,在全世界范围内,转基因大豆、水稻、玉米、油菜籽、甜菜、水果、甜椒、西红柿和土豆等产品在市场上大量流通[12-17]。随着转基因植物的大规模商品化,多种转基因农作物及其加工产品已广泛应用于食品制造业,因此,在肉制品加工过程中添加植物源成分的同时,转基因成分会间接地、不可避免地渗入到肉制品领域,这已引起国内外学者的关注[18-20]。
目前,针对转基因成分的检测,基于DNA的检测无疑是最为有效的手段,常用的方法包括聚合酶链式反应(polymerase chain reaction,PCR)、多重PCR、荧光定量PCR以及多重荧光定量PCR等[21-24]。然而肉制品作为深加工产品,往往需要经过复杂的加工程序,在此过程中,DNA会受到物理、化学或酶因子等因素的影响,遭到不同程度的破坏,给PCR和荧光定量PCR等单一检测对象的方法带来很大的挑战和风险。若检测目标DNA被破坏,就会产生假阴性现象。多重荧光定量PCR将基于DNA的检测技术推向更高的台阶,它是在荧光定量PCR的基础上,通过使用多对引物和相应的探针,实现在同一个反应体系中对多个目标序列进行同时检测[25]。CaMV 35S启动子、NOS终止子以及标记基因NPTⅡ是转基因工程中常用的调控元件,也是转基因检测常用的检测对象[26-30]。本研究拟以CaMV 35S啟动子、NOS终止子以及标记基因NPTⅡ特异片段序列为检测目标,旨在建立肉制品中植源性转基因成分的多重荧光定量PCR检测方法。
1 材料与方法
1.1 材料与试剂
大豆、大米、面粉、生鲜肉和肉制品均购于超市。
植物转基因表达载体pRⅠ 101-AN DNA(其结构中含有CaMV 35S启动子、NOS终止子和标记基因NPTⅡ)、Premix Ex Taq?(Perfect Real Time) 大连TaKaRa公司;DNA Marker Ⅰ、2×Taq PCR MasterMi、DNA提取试剂盒 天根生化科技有限公司;E.Z.N.A. Gel Extraction Kit(V-spin) 美国Omega公司;荧光定量PCR八连管(平盖) 美国Axygen公司。
1.2 仪器与设备
Stratagene Mx 3000P实时荧光定量PCR仪 美国Agilent公司;MG96G梯度型PCR仪 杭州朗基科学仪器有限公司;CF15RX离心机 日本Hitachi公司;Eppendorf Research? Plus微量移液器 德国Eppendorf公司;Power Pac Basic电泳仪、Mini-Sub Cell GT电泳槽 美国Bio-Rad公司。
1.3 方法
1.3.1 引物和荧光探针
以转基因植物常用的调控元件CaMV 35S启动子、NOS终止子以及标记基因NPTⅡ为检测对象,分别选取其特异片段序列为检测目标[26-30]。借助Oligo 6及Primer Premier等引物分析软件设计相应的上、下游引物及荧光探针,并委托TaKaRa公司合成,对应的探针5端分别用荧光试剂标记,3端用荧光淬灭剂标记。所设计的引物和探针如表1所示。
1.3.2 样品DNA的提取
大豆、大米和面粉样品:用粉碎机磨成粉末状,并过80 目筛,按照植物细胞组织基因组DNA提取试剂盒方法提取样品DNA。
生鲜肉、肉制品样品:经剪碎或研磨、均质后,按照组织基因组DNA提取试剂盒方法提取样品DNA。
1.3.3 PCR反应体系与参数
以载体pRⅠ 101-AN DNA为模板,将其在4 ℃、10 000 r/min条件下离心2 min,弃去上清液,沉淀重新溶解到1 mL无菌水中,分别利用设计出的引物扩增目标基因片段。反应体系:2×Taq PCR MasterMix 25 μL、上下游引物(10 μmol/L)各2 μL、模板DNA 4 μL,加水至50 μL。反应条件:94 ℃预变性5 min,94 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,35 个循环;最后72 ℃延伸10 min。
1.3.4 核酸电泳
PCR反应结束后进行1.8%琼脂糖凝胶电泳,电压100 V,时间45 min。电泳结束后,用溴化乙锭(ethidium bromide,EB)染色10 min。
1.3.5 单重荧光定量PCR反应体系与参数
通过比较、优化体系组成和退火温度,最终确定单重荧光定量PCR反应体系为25 μL,体系组成:Premix Ex Taq?(Perfect Real Time)12.5 μL、上下游引物(10 μmol/L)各1 μL、探针0.5 μL、模板DNA 2 μL,加水至25 μL。反应参数:95 ℃变性90 s,以95 ℃、5 s,58 ℃、30s,72 ℃、30 s扩增40 个循环,在58 ℃运行程序结束时开始收集荧光信号。
1.3.6 多重荧光定量PCR反应体系与参数
通过比较、优化体系组成和退火温度,最终确定多重荧光定量PCR反应体系为50 μL,体系组成:Premix Ex Taq?(Perfect Real Time)25 μL、上下游共计6 个引物(10 μmol/L)各1 μL、探针0.5 μL、模板DNA 2 μL,加水至50 μL。反应参数:95 ℃变性90 s,以95 ℃、5 s,58 ℃、30 s,72 ℃、30 s扩增40 个循环,在58 ℃运行程序结束时开始收集荧光信号。
1.3.7 特异性分析
分别以非转基因大豆、大米及面粉的基因组DNA作为模板,以载体pRⅠ 101-AN DNA作为阳性对照模板,检验本研究所设计的引物和探针的特异性。
1.3.8 灵敏度实验和标准曲线的建立
将载体pRⅠ 101-AN DNA标准模板按10 倍梯度稀释,分别用本研究建立的荧光定量PCR方法检测体系进行检测,考察检测下限,根据循环阈(cycle threshold,Ct)值对方法的灵敏度进行评价。同时,根据各模板的拷贝数和相应的Ct值,建立荧光定量PCR标准曲线。
1.3.9 多重荧光定量PCR的重复性
将同一浓度的混合模板利用本研究所建立的多重荧光定量PCR检测方法进行3 次分析,比较扩增结果。
1.3.10 多重荧光定量PCR与单重荧光定量PCR的准确性比较
分别用多重荧光定量PCR与单重荧光定量PCR检测方法对相同样品进行分析检测,比较结果的一致性,考察多重荧光定量PCR方法的准确性。
2 结果与分析
2.1 目标片段验证
泳道1. DNA Marker Ⅰ(DL100);泳道2~4. 分别为CaMV 35S启动子、NOS终止子和标记基因NPTⅡ扩增的目标片段。
由图1可知,3 种目标片段的1.8%琼脂糖凝胶电泳图谱表明,扩增产物条带单一,所扩增片段大小均与目标相符。
2.2 单重荧光定量PCR检测方法分析
2.2.1 灵敏度实验及标准曲线
根据实验结果,本研究所建立的各方法灵敏度基本能达到1 pg。
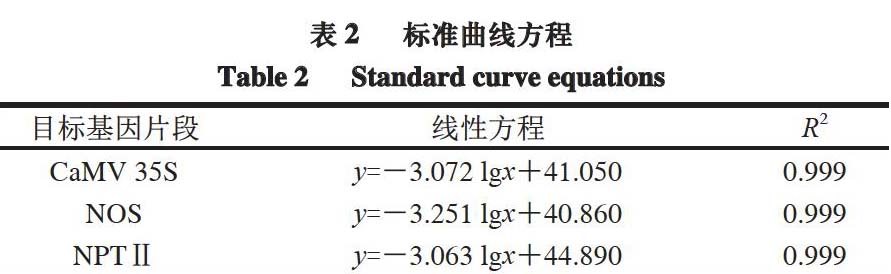
以各标准模板拷贝数的对数值为横坐标,对应的Ct值为纵坐标,绘制标准曲线。由表2可知,各标准曲线的R2均为0.999,表明各标准曲线的线性关系良好。
2.2.2 特异性实验
本研究所设计的引物和探针的荧光定量PCR分析结果表明,载体pRⅠ 101-AN DNA标准模板有典型的荧光扩增曲线,而非转基因大米、大豆与空白对照及阴性对照的实验结果类似,无荧光扩增曲线,这表明本研究所设计的引物和探针具有特异性。
2.3 多重荧光定量PCR检测方法分析
2.3.1 扩增曲线
3 条横线为荧光阈值,仪器设置为3~15 个循环的荧光信号标准偏差的10 倍。下同。
在同一反应体系下,以植物转基因表达载体
pRⅠ 101-AN DNA为模板,加入不同的引物和探针进行分析。由图2可知,CaMV 35S、NOS和NPTⅡ片段可以检测到相应的荧光信号,而空白对照和阴性对照实验无荧光扩增曲线。
2.3.2 标准曲线
利用多重荧光定量PCR体系,分别加入与各单重荧光定量PCR相同的模板和探针,在同一体系下同时进行测试。
由图3可知,相同模板条件下,多重荧光定量PCR与单重荧光定量PCR的测定结果有很好的一致性,而空白对照和阴性对照实验无荧光扩增曲线。根据拷贝数和Ct值建立的针对CaMV 35S启动子检测的标准曲线方程为y=-3.152 lgx+40.190(R2=0.999);NOS终止子检测的标准曲线方程为y=-2.983 lgx+39.660(R2=0.998);标记基因NPTⅡ检测的标准曲线方程为y=-2.967 lgx+39.740(R2=0.999),均具有良好的线性关系。
2.3.3 重复性分析
由图4可知,采用已建立的方法对同一浓度的模板DNA进行3 次重复测定,所得扩增曲线基本吻合,因此本研究建立的多重荧光定量PCR方法有很好的可重复性,测定结果稳定可靠。
2.4 多重荧光定量PCR与单重荧光定量PCR检测结果的比较
利用单重荧光定量PCR检测CaMV 35S启动子、NOS终止子和标记基因NPTⅡ的方法已较为成熟,并形成了检测标准。为考察本研究所建立的多重荧光定量PCR检测方法的可行性,将人工污染的同一种肉制品样品随机编号,分别用多重荧光定量PCR和单重荧光定量PCR方法进行检测。由表3可知,2 种方法所得到的Ct值基本一致,表明本研究所建立的多重荧光定量PCR检测方法具有良好的可靠性。
3 结 论
实时荧光定量PCR检测方法具有快速、特异、灵敏等优越性[31-32],本研究围绕肉制品中植物源性转基因成分的检测分别建立单重荧光定量PCR和多重荧光定量PCR方法,结果表明,2 种方法具有相似的灵敏度,在样品测定中显示出很好的一致性。因此,应用多重荧光定量PCR同时对多个基因靶序列进行检测是可行的。这可以很好地解决肉制品经过复杂加工过程后DNA遭到破坏带来的问题,同时也在一定程度上减少了检测成本,并且使实验操作更加便捷。
参考文献:
[1] 高雪琴. 大豆分离蛋白和卡拉胶复配对调理猪肉制品品质的影响及机理研究[D]. 南京: 南京农业大学, 2015: 51.
[2] 郭玉华, 李钰金. 植物蛋白与乳蛋白在肉制品加工中的应用[J]. 肉类研究, 2011, 25(5): 28-32.
[3] 刘文营, 林海龙, 车夏宁, 等. 变性淀粉及其在肉制品加工中的應用研究进展[J]. 农产品加工, 2017(1): 97-100.
[4] 陈岩. 肉制品中淀粉含量两种标准检测方法的比较[J]. 肉类工业, 2016(11): 28-29. DOI:10.3969/j.issn.1008-5467.2016.11.009.
[5] 黄良哲, 林欢, 王海滨, 等. 不同溶解性膳食纤维的功能特性差异浅析及其在肉制品中应用[J]. 食品安全质量检测学报, 2014, 5(9): 2783-2790.
[6] 孙常文, 庞明利, 杨海军, 等. 功能性膳食纤维在肉制品中的应用[J]. 农产品加工, 2013(12): 32-33. DOI:10.3969/j.issn.1671-9646.2013.12.018.
[7] 赵光辉. 食用胶对熏煮香肠品质的影响研究[D]. 郑州: 河南农业大学, 2014: 14-20.
[8] 白明, 尹金兰. 肉制品中常见食用胶及其应用[J]. 食品安全导刊, 2010(1): 50-52.
[9] 国际农业生物技术应用服务组织. 2016年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2017, 37(4): 1-8. DOI:10.13523/j.cb.20170401.
[10] 杜建中, 郝曜山, 王亦学, 等. 我国转基因主粮作物产业化进展、存在问题及对策[J]. 生物技术进展, 2016, 6(3): 159-168. DOI:10.3969/j.issn.2095-2341.2016.03.002.
[11] 康国章, 李鸽子, 许海霞. 我国作物转基因技术的发展与现状[J]. 现代农业科技, 2017(22): 27-29. DOI:10.3969/j.issn.1007-5739.2017.22.013.
[12] 彭永刚, 张磊, 朱祯. 国内外转基因农作物研发进展[J]. 植物生理学报, 2013, 49(7): 611-614.
[13] 崔宁波, 张正岩, 张曲薇. 转基因玉米材料的选育及产业化研究进展[J]. 河南农业科学, 2017, 46(6): 13-22.
[14] 沈平, 武玉花, 梁晋刚, 等. 转基因作物发展及应用概述[J]. 中国生物工程杂志, 2017, 37(1): 119-128. DOI:10.13523/j.cb.20170117.
[15] 崔宁波, 张正岩. 转基因大豆研究及应用进展[J]. 西北农业学报, 2016, 25(8): 1111-1124. DOI:10.7606/j.issn.1004-1389.2016.08.001.
[16] 寇坤, 蒋洪蔚, 曲姗姗. 世界转基因农作物的应用现状与发展趋势[J]. 中国农业信息, 2016(14): 19. DOI:10.3969/j.issn.1672-0423.2016.07.007.
[17] 石永峰. 浅淡转基因农作物(粮食)20 年的发展状况[J]. 粮食问题研究, 2016(2): 25-31. DOI:10.3969/j.issn.1003-2576.2016.02.007.
[18] TASKI-AJDUKOVIC K, NIKOLIC Z, VUJAKOVIC M, et al. Detection of genetically modified organisms in processed meat products on Serbian food market[J]. Meat Science, 2009, 81(1): 230-232.
DOI:10.1016/j.meatsci.2008.07.024.
[19] GREINER R, KONIETZNY U, VILLAVICENCIO A L C H. Qualitativeand quantitative detection of genetically modified maize and soy in processed foods sold commercially in Brazil by PCR-based
methods[J]. Food Control, 2005, 16(8): 753-759. DOI:10.1016/j.foodcont.2004.06.015.
[20] 叶可萍, 祝长青, 周光宏. 利用Taq man实时荧光PCR检测市售肉制品中转基因大豆成分[J]. 食品与发酵工业, 2010, 36(12): 160-164. DOI:10.13995/j.cnki.11-1802/ts.2010.12.037.
[21] 王颢潜, 陈锐, 李夏莹, 等. 转基因产品成分检测技术研究进展[J]. 生物技术通报, 2018(3): 1-7.
[22] QUERCI M, BULCKE M V D, ZEI J, et al. New approaches in GMO detection[J]. Analytical and Bioanalytical Chemistry, 2010, 396(6): 1991-2002. DOI:10.1007/s00216-009-3237-3.
[23] VENTURELLI G L, BROD F C, ROSSI G B, et al. A specific endogenous reference for genetically modified common bean (Phaseolus vulgaris L.) DNA quantification by real-time PCR targeting lectin gene[J]. Molecular Biotechnology, 2014, 56(11): 1060-1068. DOI:10.1007/s12033-014-9786-5.
[24] 胡金強, 雷俊婷, 孙新城, 等. 植物源性转基因食品PCR衍生技术研究进展[J]. 食品工业科技, 2015, 36(22): 379-383; 388.
[25] 李金峰, 赵芳, 赵俊龙, 等. 肉食品中3 种食源性致病菌多重荧光PCR检测[J]. 中国公共卫生, 2009, 25(8): 990-991. DOI:10.3321/j.issn:1001-0580.2009.08.071.
[26] DATUKISHVILI N, KUTATELADZE T, GABRIADZE I, et al. New multiplex PCR methods for rapid screening of genetically modified organisms in food[J]. Frontiers in Microbiology, 2015, 6(6): 757. DOI:10.3389/fmicb.2015.00757.
[27] JIANG Lingxi, YANG Litao, RAO Jun, et al. Development and in house validation of the event specific qualitative and quantitative PCR detection methods for genetically modified cotton MON15985[J]. Journal of the Science of Food and Agriculture, 2010, 90(3): 402-408. DOI:10.1002/jsfa.3829.
[28] WU Yuhua, WANG Yulei, LI Jun, et al. Development of a general method for detection and quantification of the P35S promoter based on assessment of existing methods[J]. Scientific Reports, 2014, 4(2): 7358. DOI:10.1038/srep07358.
[29] 中华人民共和国上海出入境檢验检疫局, 中华人民共和国厦门出入境检验检疫局, 中华人民共和国黑龙江出入境检验检疫局, 等.
甜菜中转基因成分检测 普通PCR方法和实时荧光PCR方法:
SN/T 3959—2014[S]. 北京: 中国标准出版社, 2014.
[30] 中华人民共和国质量监督检验检疫总局动植物检疫实验所, 中华人民共和国广东出入境检验检疫局, 中华人民共和国辽宁出入境检验检疫局, 等. 植物及其加工产品中转基因成分实时荧光PCR定性检验方法: SN/T 1204—2003[S]. 北京: 中国标准出版社, 2003.
[31] PARK H J, KIM H J, PARK S H, et al. Direct and quantitative analysis of Salmonella enterica Serovar Typhimurium using real-time
PCR from artificially contaminated chicken meat[J]. Journal of Microbiology and Biotechnology, 2008, 18(8): 1453-1458.
[32] CARDARELLI P, BRANQUINHO M R, FERREIRA R T B, et al. Detection of GMO in food products in Brazil: the INCQS experience[J]. Food Control, 2005, 16(10): 859-866. DOI:10.1016/j.foodcont.2004.07.010.
- 陈鹤琴的“活教育”理论及其对现代幼儿园教育的启示
- 幼儿园游戏中学前教育创新与实践探究
- 幼儿园户外体育活动的优化策略研究
- 陶行知“生活教育理论”对幼儿园音乐教学的启示
- 我们一起成长
- 网络信息化时代下幼儿园与家长有效沟通方法及措施
- 像树一样生长
- 小班健康活动
- 关于幼儿学习兴趣的培养途径和方法
- 浅谈小学德育工作中如何培养学生的良好行为习惯
- 课堂“微”时代
- 浅谈小学语文写话教学该如何开展
- 信息技术支持的小学数学教学策略分析
- 提升小学生数学思维品质的教学策略
- 小学数学课堂生活化教学方法
- 新课程背景下加强小学数学口算能力的实践与研究
- 浅谈小学数学教育如何培养学生的独立思考能力
- 浅谈合作学习在小学语文教学中的应用
- 小学语文口语交际教学现状与有效改善分析
- 培养一年级学生数学课堂良好习惯
- 谈小学数学几何图形教学的弊端与策略
- 浅析德育理念在小学美术教育中的渗透
- 小学低年级数学教学中数形结合思想的渗透
- 浅谈信息技术与小学美术教学整合应用创新
- 新时期下的小学信息技术教学
- asphyctic
- asphyxia
- asphyxial
- asphyxias
- asphyxiate
- asphyxiated
- asphyxiates
- asphyxiating
- asphyxiation
- asphyxiations
- asphyxiators
- aspic
- aspics
- aspiration
- aspirational brand
- aspirationalbrand
- aspirationally
- aspirations
- aspire
- aspire-after
- aspired
- aspirer
- aspirers
- aspires
- aspire to
- 天狗吃了日头——有今儿个没明儿个
- 天狗吃太阳——吃了就要吐
- 天狗吃太阳——有今儿个,没明儿个
- 天狗吃太阳——没法下口
- 天狗吃太阳——没法子下口
- 天狗吃月
- 天狗吃月亮——想得美
- 天狗堕
- 天狗堕地
- 天狗星坠
- 天狗难吃月妹
- 天狱
- 天狼
- 天狼无角
- 天狼星
- 天狼芒角
- 天王
- 天王巨星
- 天王星
- 天王老子
- 天王补心丹
- 天珍
- 天球
- 天球仪
- 天理