王乐 成晓瑜 马晓钟 李享 张顺亮 李迎楠 刘文营 曲超 王守伟


摘 要:以金華火腿为研究对象,猪腿肉为对照,分别考察从生火腿、加热烹饪后火腿和加热烹饪-体外模拟消化后火腿中所提取的3 种粗肽的抗氧化活性和血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性。结果表明:金华火腿加热烹饪后所提粗肽的游离巯基(—SH)含量降至28.97 nmol/mg,ABTS+·清除率和Fe2+螯合能力降低,但是当粗肽质量浓度达5 mg/mL时,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率由生状态时的35.9%提高至52.8%,氧自由基吸收能力也略有提高,ACE抑制率增至43.01%;加热烹饪-模拟消化后,除DPPH自由基清除率显著降低外,其他抗氧化指标均显示金华火腿粗肽的抗氧化活性显著提高,ACE抑制率也增至63.02%(P<0.05)。与猪腿肉粗肽相比,金华火腿粗肽具有更高的抗氧化和ACE抑制活性,并且经模拟消化后粗肽的生物活性进一步提高,显示出金华火腿对人体健康具有有益生理作用的潜能。
关键词:金华火腿;加热烹饪;体外模拟消化;抗氧化活性;ACE抑制活性
Comparison of Antioxidant and Angiotensin Converting Enzyme Inhibitory Activities of Crude Peptide Extract from Jinhua Ham after Cooking and in Vitro Simulated Gastrointestinal Digestion
WANG Le1, CHENG Xiaoyu1, MA Xiaozhong2, LI Xiang1, ZHANG Shunliang1, LI Yingnan1, LIU Wenying1, Qu Chao1, WANG Shouwei1,*
(1.Beijing Key Laboratory of Meat Processing Technology, China Meat Research Center, Beijing Academy of Food Science,
Beijing 100068, China; 2.Jinzi Ham Co.Ltd., Jinhua Jinzi Ham Co.Ltd., Jinhua 321016, China)
Abstract: This study aimed to evaluate and compare antioxidant and angiotensin converting enzyme (ACE) inhibitory activities of crude peptide extract from Jinhua ham before and after cooking and in vitro simulated gastrointestinal digestion. Fresh pork meat was used as control. After cooking, the free thiols (—SH) content of crude peptide extract from Jinhua ham decreased to 28.97 nmol/mg, and both ABTS+· scavenging capacity and Fe2+ chelating capacity also decreased. However, the DPPH radical scavenging capacity of crude peptide extract from the cooked ham at 5 mg/mL concentration was 52.8%, higher than that (35.9%) of crude peptide extract from the raw ham. The oxygen radical absorbance capacity (ORAC) was also slightly increased to 43.01% after cooking. Crude peptide extract from the cooked ham showed a significant reduction in DPPH radical scavenging capacity after further digestion but exhibited a significant elevation in other antioxidant properties as well as an increase (to 63.02%) in ACE inhibitory activity (P < 0.05). Compared with the control, crude peptide extract from Jinhua ham possessed stronger antioxidant and ACE inhibitory activities, and these activities were increased in the crude peptide extract obtained after its digestion. In summary, Jinhua ham appears to have a potential beneficial effect on human health.
Keywords: Jinhua ham; cooking; simulated gastrointestinal digestion; antioxidant activity; angiotensin converting enzyme inhibitory activity
DOI:10.7506/rlyj1001-8123-201801003
中图分类号:TS201.4 文献标志码:A 文章编号:1001-8123(2018)01-0016-07
引文格式:
王乐, 成晓瑜, 马晓钟, 等. 金华火腿加热烹饪和体外模拟消化后粗肽抗氧化性和ACE抑制活性比较研究[J]. 肉类研究, 2018, 32(1): 16-22. DOI:10.7506/rlyj1001-8123-201801003. http://www.rlyj.pub
WANG Le, CHENG Xiaoyu, MA Xiaozhong, et al. Comparison of antioxidant and angiotensin converting enzyme inhibitory activities of crude peptide extract from jinhua ham after cooking and in vitro simulated gastrointestinal digestion[J]. Meat Research, 2018, 32(1): 16-22. DOI:10.7506/rlyj1001-8123-201801003. http://www.rlyj.pub
近年来,人们对食品的营养与功能倍加关注,消费者希望通过合理的膳食从食物中获取所需的能量和营养。目前,人体健康面临着氧化应激的威胁,氧化应激被认为是活性氧的形成和抗氧化防御之间的失衡,能够抑制细胞脂质、蛋白质和DNA等的正常功能[1-2]。在应对氧化应激方面,食物中的活性肽具有抗氧化活性,能够保护细胞免受氧化损伤[3]。此外,生物活性肽还具有抗高血压、抗血栓、抗菌和免疫调节等生物活性[4]。血管紧张素转化酶(angiotensin converting enzyme,ACE)是一种负责调节血压的酶,具有调节心血管和肾脏的功能,已有报道证实摄取具有ACE抑制作用的食物蛋白可以实现对中度高血压病症的控制[5]。
肉类是人体获取高品质蛋白和必需氨基酸的重要来源,同时也被证实含有具有抗高血压、抗氧化或抗炎活性的功能成分[6]。通常,生物活性肽能够通过消化道上皮细胞进入毛细血管,然后运送到机体的特定部位发挥其生物功能[7]。Escudero等[8]研究西班牙干腌火腿肽的ACE抑制活性,他们将得到的肽段给药自发性高血压大鼠8 h后,其血压下降了(25.62±4.50) mmHg(P<0.05)。肉类一般需经烹饪后食用,烹饪的时间和温度会对其所含蛋白质的特性和消化产生影响,进而影响肉类潜在的生物活性[9]。短时间轻度热处理可以提高猪肉和牛肉的抗氧化活性[10],而长时间剧烈热处理可能会引起肉的热氧化,导致抗氧化物质的消耗和总抗氧化能力的降低[11]。肉中的多数蛋白质构象在70 ℃时发生显著变化,有利于消化酶与其识别位点的接近[12]。加熱烹饪后的肉类会在消化道中胃肠蛋白酶的作用下发生降解,肉类肽的生物活性可能会受到影响,释放的肽在胃肠道发挥作用或通过血流被吸收和分配到特定器官和组织[13-14]。因此,通常使用胃肠酶对肉类进行模拟消化,确定生物活性肽的生物可给性和有效性[15-16]。
金华火腿中的蛋白质在内源蛋白酶作用下降解会产生大量的多肽和氨基酸等[17]。目前对加热烹饪、加热烹饪-体外模拟消化金华火腿后提取的粗肽抗氧化活性和ACE抑制活性的研究还未见报道。本研究以金华火腿为研究对象,并与猪腿肉对比,分析比较从生火腿、加热烹饪后火腿及加热烹饪-体外模拟消化后火腿中提取的3 种粗肽的抗氧化活性和ACE抑制活性。这对于探究加热烹饪和模拟消化金华火腿后,其中所含粗肽是否仍具有生物活性以及生物活性的变化情况具有较大意义,能够为金华火腿的营养保持及其食用后对人体的健康价值研究提供参考。
1 材料与方法
1.1 材料与试剂
猪腿肉为符合金华火腿生产要求的原料腿肉,由金华金字火腿有限公司提供;金华火腿由金华金字火腿有限公司提供,分别随机选取3 条。猪腿肉和金华火腿均取股二头肌肉样,分析前置于-20 ℃冰箱中保存。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、ACE、荧光素钠、2,2-偶氮(2-甲基丙基)(2,2-azobis-(2-amidinopropane-dihydrochloride),AAPH)、马尿酰组胺酰亮氨酸(N-Hippuryl-His-Leu hydrate,HHL)、5,5-二硫双(2-硝基苯甲酸)(5,5-dithio bis-(2-nitrobenzoic acid),DTNB)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,trolox)(均为分析纯) 美国Sigma公司;ABTS抗氧化能力检测试剂盒 上海碧云天生物技术有限公司;菲洛嗪(分析纯) 生工生物工程(上海)股份有限公司;胃蛋白酶(分析纯) 美国Amresco公司;胰蛋白酶(分
析纯) 美国Gibco公司;其余试剂均为国产分析纯。
1.2 仪器与设备
AL104电子天平 瑞士Mettler-Toledo公司;FSP-625匀浆机 日本Nihonseiki Kaisha公司;RE52旋转蒸发器
上海亚荣生化仪器厂;Sorvall LYNX-4000离心机 美国赛默飞世尔科技公司;LGJ-30D冷冻干燥机 北京四环科学仪器厂有限公司;VORTEX-5涡旋振荡器 海门市其林贝尔仪器制造有限公司;2800可见分光光度计 尤尼
柯(上海)仪器有限公司;Synergy H4酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1 样品处理
1.3.1.1 生状态
猪腿肉和金华火腿均取股二头肌肉样,去除瘦肉中的脂肪和结缔组织,切碎斩匀。取其中一部分置于
-20 ℃冰箱中作为生状态的猪腿肉和金华火腿肉样,另一部分供加热烹饪处理用。
1.3.1.2 加热烹饪
参考Wen Siying等[18]的方法,将上述生状态的猪腿肉和金华火腿肉样分别装入袋中,75 ℃水浴煮制30 min,用温度计测得肉样中心温度为70~73 ℃。
1.3.2 生状态和加热烹饪后肉样中粗肽的提取
参考Zhu Chaozhi等[19]的方法。分别取生状态(或加热烹饪后)肉樣25 g于三角瓶中,加入100 mL 0.01 mol/L的HCl溶液,冰浴匀浆(8 000 r/min、10 min);将匀浆液于4 ℃条件下离心(12 000×g、20 min),向上清液中加入3 倍体积乙醇,于4 ℃条件下静置20 min;再次于4 ℃条件下离心(12 000×g,20 min),取上清液抽滤后旋转蒸发,浓缩液经冷冻干燥后即为生状态(或加热烹饪后)肉样的粗肽粉。
1.3.3 体外模拟消化
参考Simonetti等[20]的方法,使用胃蛋白酶和胰蛋白酶对加热烹饪后的肉样进行体外模拟消化。分别取25 g加热烹饪后的肉样置于250 mL去离子水中,低速均质1 min;用3 mol/L HCl溶液将样液pH值调至2,按照
酶∶样品=1∶3 000(m/m)加入胃蛋白酶,置于37 ℃恒温摇床中反应2 h;再用1 mol/L NaHCO3溶液将样液pH值调至7.2,使胃蛋白酶失活;再按照酶∶样品=1∶250(m/m)加入胰蛋白酶,置于37 ℃恒温摇床中振荡3 h,之后加热至95 ℃,保持10 min使酶失活。冷却后于4 ℃条件下离心(5 000×g、20 min),收集上清液,抽滤后冷冻干燥,即为加热烹饪-模拟消化肉样粗肽粉。
1.3.4 游离巯基(—SH)的测定
参考Ellman[21]的方法。取250 μL粗肽液与2.5 mL磷酸钠缓冲液(0.1 mol/L,pH 8.0,含1 mmol/L乙二胺四乙酸(elhylene diamine tetraacetic acid,EDTA))混合均匀,加入50 μL DTNB溶液(将4 mg DTNB溶于1 mL磷酸缓冲液),振荡均匀,室温静置30 min,于412 nm波长处测定溶液吸光度。用反应缓冲液代替样品作为空白对照。
DTNB的摩尔消光系数为14 150 mol/(L·cm),巯基含量以每毫克肽所含巯基的纳摩尔数表示,单位
为nmol/mg。
1.3.5 ABTS+·清除能力的测定
参考Serpen等[10]的方法,使用ABTS抗氧化能力检测试剂盒于734 nm波长处测定吸光度。采用Trolox作为标准物质,以ABTS+·清除率与Trolox浓度为坐标绘制标准曲线,ABTS+·清除能力以每克肽相当于Trolox当量的微摩尔数表示,单位μmol Trolox/g。其中,ABTS+·清除率按照公式(1)计算。
(1)
式中:A空白为去离子水与ABTS工作液混合后的吸光度;A样品为粗肽液与ABTS工作液混合后的吸光度。
1.3.6 DPPH自由基清除率的测定
参考Wang Lusha等[22]的方法。分别将猪腿肉和金华火腿的生状态、加热烹饪及加热烹饪-模拟消化粗肽粉配制成质量浓度为1、2、3、4、5 mg/mL的粗肽液,将0.2 mmol/L的DPPH-95%乙醇溶液与粗肽液按照体积比1∶1混合,振荡混匀,室温放置30 min后于517 nm波长处测定吸光度。以0.2 mmol/L的DPPH-95%乙醇溶液与去离子水按照体积比1∶1混合作为对照,以95%乙醇溶液与粗肽液按照体积比1∶1混合作为空白对照。按照公式(2)计算DPPH自由基清除率。
(2)
式中:A样品、A对照和A空白分别为样品组、对照组和空白对照组溶液的吸光度。
1.3.7 氧自由基吸收能力(oxygen radical absorption capacity,ORAC)的测定
参考Jensen等[23]的方法。ORAC反应在75 mmol/L磷酸盐缓冲液(pH 7.4)体系中进行,将20 μL粗肽液或一定浓度梯度的Trolox标准品加入96 孔黑色酶标板,再向孔中加入200 μL 0.96 μmol/L的荧光素钠,37 ℃温育10 min后迅速加入20 μL AAPH溶液(119 mmol/L)启动反应。以激发波长485 nm,发射波长538 nm测定荧光强度,每3 min测定1 次。ORAC值以每克肽等同于Trolox当量的微摩尔数表示,单位μmol Trolox/g。
1.3.8 Fe2+螯合能力的测定
参考Xing Lujuan等[24]的方法。分别将猪腿肉和金华火腿生状态、加热烹饪及加热烹饪-模拟消化粗肽粉配制成质量浓度为1、2、3、4、5 mg/mL的粗肽液。取1 mL粗肽液,加入0.05 mL FeCl2(2 mmol/L),混匀后加入0.2 mL菲洛嗪(5 mmol/L),剧烈混匀,室温下静置10 min,于562 nm波长处测定吸光度。按照公式(3)计算Fe2+螯合率。以去离子水代替粗肽液作为空白组。
(3)
式中:A样品为样品溶液吸光度;A空白为空白组溶液吸光度。
1.3.9 ACE抑制活性的测定
参考Hernández-Ledesma等[25]的方法。将40 μL粗肽液加入到100 μL硼酸盐缓冲液(含0.3 mol/L NaCl、5 mmol/L HHL,pH 8.3)中,37 ℃保温3 min;再加入20 μL ACE溶液(0.1 U/mL),混合均匀,37 ℃温育30 min;之后加入250 μL HCl溶液(1 mol/L)终止反应;加入1.5 mL乙酸乙酯萃取马尿酸,振荡30 s后静置5 min,吸取1 mL乙酸乙酯层于试管中,置于90 ℃烘箱中使其受热蒸发后,加入2 mL蒸馏水,在228 nm波长处测定溶液吸光度。按照公式(4)计算ACE抑制率。
(4)
式中:A为样品溶液的吸光度;Aa为用硼酸盐缓冲液代替粗肽液时溶液的吸光度;Ab为用硼酸盐缓冲液代替ACE和粗肽液时溶液的吸光度。
1.4 数据处理
所有指标均平行测定3 次,結果用平均值±标准差表示。采用Excel软件对数据进行分析,用Origin 8.0软件进行数据整理和绘图,采用SPSS 22.0软件对数据进行单因素方差分析(analysis of variance,ANVOA)和Duncans多重比较。
2 结果与分析
2.1 粗肽的抗氧化活性
2.1.1 基于—SH的抗氧化能力
Prakash等[26]的研究表明,氧化应激的发生会导致—SH
减少和二硫键增加,—SH含量的变化可以反映—SH清除自由基和螯合金属离子的能力。因此,本研究采用测定—SH含量的方式表征生状态、加热烹饪、加热烹饪-体外模拟消化3 种状态下的猪腿肉和金华火腿中粗肽的抗氧化活性。
由表1可知,生状态猪腿肉和金华火腿粗肽均含有一定量的—SH,且与猪腿肉相比,金华火腿粗肽含有更多的—SH,其含量为(40.99±0.85) nmol/mg。这可能与猪腿肉氨基酸序列中本身存在—SH有关,而金华火腿成熟过程中,蛋白质在内源酶的作用下降解可能使部分
—SH暴露,导致—SH含量升高。
加热烹饪猪腿肉和金华火腿后,二者所提粗肽中的—SH含量均显著下降(P<0.05),这一趋势与Simonetti等[20]报道的猪肉经加热后肽中—SH含量降低的结果一致。研究表明,较高温度的热处理(70~125 ℃)会导致—SH减少,二硫键增加[27-28]。加热烹饪容易诱导活性氧产生[13],含有—SH的氨基酸由于巯基的高反应敏感性,特别容易与自由基发生反应,—SH的含量降低可能是由蛋白质表面的半胱氨酸(Cys)中的可接近性—SH被氧化导致的[29]。加热烹饪后,金华火腿粗肽和猪腿肉粗肽的—SH含量分别为(28.97±0.49)、(23.65±1.31) nmol/mg,与生状态相比,分别损失29%和36%,猪腿肉粗肽的—SH损失约为金华火腿粗肽的1.24 倍,表明金华火腿粗肽具有更好的氧化稳定性,其与猪腿肉粗肽相比具有更强的抗氧化能力。
加热烹饪-模拟消化猪腿肉和金华火腿后,二者所提粗肽中的—SH含量均显著升高(P<0.05)。金华火腿模拟消化后粗肽中的—SH含量与生状态时相比提高了40%,与加热烹饪后相比提高了98%。Sarmadi等[30]发现,酶水解可以促使许多具有抗氧化活性的肽产生。Taylor等[31]发现在肉类的消化过程中,含Cys的肽会被释放出来,如谷胱甘肽,这些肽在胃肠消化道内比游离氨基酸更加稳定;由于巯基未被氧化,以肽形式存在的Cys即使在肠道内仍具有活性。加热烹饪-模拟消化后,与猪腿肉粗肽相比,金华火腿粗肽的—SH含量更高,且差异显著(P<0.05),说明加热烹饪后金华火腿中的蛋白质识别位点对蛋白酶更具可接近性和易感性,因此模拟消化后所提粗肽中的—SH含量更高。
2.1.2 基于电子转移(single electron transfer,SET)机制的抗氧化能力
SET机制主要基于评估抗氧化剂通过转移电子达到清除自由基或还原一些组分的能力,主要包括ABTS+·清除活性、DPPH自由基清除活性和铁离子还原能力等[32]。
2.1.2.1 ABTS+·清除能力
小写字母不同,表示同种肉样在不同状态下所提粗肽间差异显著(P<0.05);大写字母不同,表示不同肉样在同一状态下所提粗肽间差异显著(P<0.05)。下同。
由图1可知,金华火腿粗肽的ABTS+·清除率均显著高于猪腿肉粗肽(P<0.05),这与具有抗氧化活性的肽链均较短有关[4],而金华火腿成熟过程中在内源酶作用下会降解产生大量多肽和小肽,因此金华火腿粗肽的ABTS+·清除率较高。与生状态肉样所提粗肽相比,加热烹饪猪腿肉和金华火腿粗肽的ABTS+·清除率均有所降低,这可能是由于多肽疏水性基团暴露,表面疏水性提高,使其更容易与水溶性的ABTS+·发生作用。加热烹饪-模拟消化猪腿肉和金华火腿粗肽的ABTS+·清除率均显著提高(P<0.05),分别为155.7 μmol trolox/g和668.8 μmol trolox/g,分别约为对应生状态肉样粗肽的2.8 倍和5.0 倍,这可能是由于模拟消化促使蛋白质降解为小肽或游离氨基酸,极性基团数量增多,导致亲水性增强。
2.1.2.2 DPPH自由基清除能力
由图2~3可知,随着猪腿肉和金华火腿粗肽液质量浓度的增加,其DPPH自由基清除能力逐渐增强,这说明肽段中可能含有具有电子供体效应的物质,如含有亲核侧链的Cys残基等,这些物质可以阻断自由基链式反应。3 种状态下,金华火腿粗肽的DPPH自由基清除率均高于猪腿肉粗肽,这与ABTS+·清除率的测定结果一致。
与生状态肉样粗肽相比,加热烹饪猪腿肉和金华火腿后所提粗肽的DPPH自由基清除率均有所提高,当粗肽质量浓度达5 mg/mL时,金华火腿粗肽的DPPH自由基清除率由生状态时的35.9%提高至52.8%(P<0.05),猪腿肉粗肽的DPPH自由基清除率由生状态时的24.7%提高至32.9%。加热烹饪会影响肉类蛋白质的结构,可能使粗肽中更多的疏水性基团位点暴露,导致疏水性提高,使其更易捕获脂溶性的DPPH自由基。这与ABTS+·清除率的测定结果相反,进一步证实了加热烹饪后肉样粗肽疏水性增强的推断。
加热烹饪-模拟消化猪腿肉和金华火腿后,二者所提粗肽的DPPH自由基清除率均显著下降(P<0.05),甚至显著低于生状态时的水平。模拟消化过程促进肉类蛋白质降解为许多小肽或游离氨基酸,极性基团数量增多,表面疏水性降低,可能不利于脂溶性的DPPH自由基与肽的结合。这与ABTS+·清除率的测定结果相反,进一步证实了加热烹饪-模拟消化后肉样粗肽疏水性减弱的推断。
2.1.3 基于氢原子转移(hydrogen atom transfer,HAT)机制的抗氧化能力
HAT机制主要侧重于评估通过供应氢原子使自由基猝灭所表现出的抗氧化能力,主要包括ORAC和总自由基清除能力等[32]。
由图4可知,生状态猪腿肉和金华火腿所提粗肽均表现出ORAC,ORAC值分别为33.4 μmol trolox/g和40.7 μmol trolox/g(P<0.05),这可能是由于肽段中富含供氢体,具有提供氢质子的能力,从而可以阻断自由基链式反应,实现氢转移,达到抑制自由基的目的。加热烹饪猪腿肉和金华火腿后,二者所提粗肽的ORAC变化并不显著。加热烹饪-模拟消化金华火腿后,所提粗肽的ORAC值显著提高,较生状态所提粗肽约提高了55%,加热烹饪后的金华火腿可能对蛋白酶更具易感性,模拟消化后蛋白质进一步降解,促使肽的亲水性提高,这与Jensen等[23]对牛肉进行加热和模拟消化后得到的变化趋势一致。
2.1.4 Fe2+螯合能力
Fe2+是一些自由基的前体,这些自由基对食品组分和人体健康都具有较大威胁[33]。由图5~6可知,随着粗肽液质量浓度的增加,猪腿肉和金华火腿粗肽的Fe2+螯合能力均呈上升趋势。生状态猪腿肉和金华火腿所提粗肽均表现出一定的Fe2+螯合能力。3 种状态下,金华火腿粗肽的Fe2+螯合能力均显著高于猪腿肉粗肽
(P<0.05),與上述其他指标测定结果一致。Qian等[34]
发现短肽中暴露的中性和酸性氨基酸,如天冬氨酸,因其带有游离羧基而具有抑制金属离子诱导自由基产生的作用。因此,金华火腿粗肽较强的Fe2+螯合能力可能与其含有较多能与Fe2+螯合的中性和酸性氨基酸肽段有关。加热烹饪金华火腿后,所提粗肽的Fe2+螯合能力显著下降(P<0.05),热处理能够影响肉类蛋白质的结构,这可能使多肽的二级结构发生变化或多肽极性降低。加热烹饪-模拟消化猪腿肉和金华火腿后,二者所提粗肽的Fe2+螯合能力均显著提高。当粗肽液质量浓度达5 mg/mL时,金华火腿粗肽的Fe2+螯合能力达到最高,螯合率达81%,是加热烹饪后的1.5 倍;猪腿肉粗肽的Fe2+螯合率达51%,是加热烹饪后的2.2 倍。模拟消化可能使肉类中大量含中性和酸性氨基酸的肽被释放出来,致使Fe2+螯合能力提高。
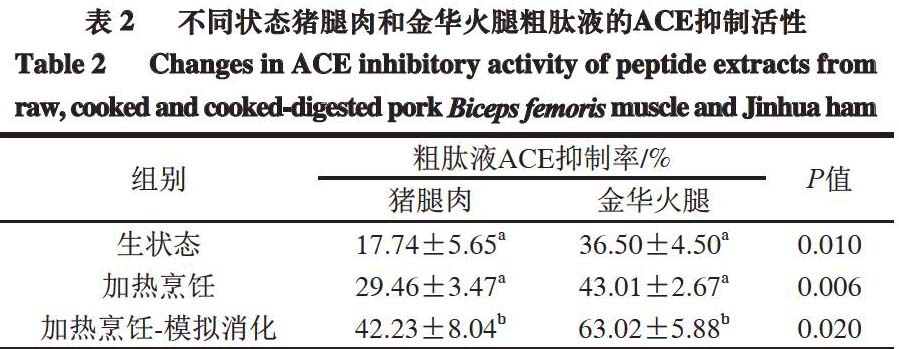
2.2 粗肽的ACE抑制活性
一般情况下,生物活性肽在肉类母体蛋白质中是无活性或潜伏性的,但是在宰后肉类加工或蛋白质水解过程中,内源性酶的作用可以使其活性释放[6]。
由表2可知,生状态猪腿肉和金华火腿粗肽均表现出ACE抑制活性,说明肌肉蛋白质发生降解,从而表现出ACE抑制活性。
加热烹饪猪腿肉和金华火腿后,二者所提粗肽的ACE抑制活性略有增强,与Bauchart等[35]报道的加热烹饪后生牛肉肌肉中的生物活性肽含量增加的研究结果一致。这是由于加热烹饪使肉类结构发生变化,如肌原纤维断裂、肌浆蛋白凝胶形成或收缩、结缔组织溶解,诱导肽的释放。
加热烹饪-模拟消化猪腿肉和金华火腿后,二者所提粗肽的ACE抑制活性均显著增强(P<0.05)。金华火腿模拟消化后所提粗肽的ACE抑制率与生状态时所提粗肽相比提高了73%,与加热烹饪后所提粗肽相比提高了47%,这与Ahhmed等[36]的研究结果一致,他们发现猪排酶解物的ACE抑制活性比未消化时高。金华火腿粗肽的ACE抑制活性较高可能与其加热烹饪后具有较高的氧化稳定性有关,因为加热过程中的蛋白质氧化会降低蛋白质对消化酶的易感性。此外,Kawakami等[37]认为,大多数通过蛋白酶消化释放的ACE抑制肽含有脯氨酸、赖氨酸或芳香族氨基酸等,并且由于不会被肠肽酶进一步降解而十分稳定。
3 结 论
本研究结果表明,金华火腿是抗氧化和抑制ACE活性肽的良好来源。猪腿肉粗肽也具有一定的抗氧化和ACE抑制活性,但是显著低于金华火腿粗肽。加热烹饪金华火腿前后所提粗肽的—SH含量均显著高于猪腿肉粗肽,说明金华火腿粗肽具有较高的氧化稳定性。肽的抗氧化能力受分子质量、氨基酸组成、结构和疏水性等多种因素影响,加热烹饪后,金华火腿粗肽的ABTS+·清除率和Fe2+螯合能力降低,而DPPH自由基清除率和ORAC有所提高,ACE抑制活性也显著提高,这些结果表明,虽然加热烹饪金华火腿后所提粗肽的各活性评价指标变化不完全一致,但仍可以保留一定的生物活性。此外,加热烹饪-体外模拟消化金华火腿后所提粗肽的
—SH含量和Fe2+螯合能力显著提高,ABTS+·清除率和ORAC提高至生状态时的5.0 倍和1.5 倍,ACE抑制活性提高至生状态时的1.7 倍。体外模拟消化促使肉类中生物活性肽的产生,与猪腿肉粗肽相比,金华火腿粗肽表现出更高的抗氧化和ACE抑制活性,展现出对人体健康具有有益生理作用的潜能。
参考文献:
[1] APAK R, ?ZY?REK M, G??L? K, et al. Antioxidant activity/capacity measurement. 1. classification, physicochemical principles, mechanisms, and electron transfer (ET)-based assays[J]. Journal of Agricultural and Food Chemistry, 2016, 64(5): 997-1027. DOI:10.1021/acs.jafc.5b04739.
[2] 李興太, 张春英, 仲伟利, 等. 活性氧的生成与健康和疾病关系研究进展[J]. 食品科学, 2016, 37(13): 257-270. DOI:10.7506/spkx1002-6630-201613046.
[3] NIKI E. Antioxidant capacity of foods for scavenging reactive oxidants and inhibition of plasma lipid oxidation induced by multiple oxidants[J]. Food Function, 2016, 7(5): 2156-2168. DOI:10.1039/c6fo00275g.
[4] S?NCHEZ A, V?ZQUEZ A. Bioactive peptides: a review[J]. Food Quality and Safety, 2017. DOI:10.1093/fqs/fyx006.
[5] HERN?NDEZ-LEDESMA B, DEL MAR CONTRERAS M, RECIO I. Antihypertensive peptides: production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35. DOI:10.1016/j.cis.2010.11.001.
[6] LAFARGA T, HAYES M. Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients[J]. Meat Science, 2014, 98(2): 227-239. DOI:10.1016/j.meatsci.2014.05.036.
[7] 陶文扬, 孙陪龙, 孙玉敬. 抗氧化成分在消化过程中变化的研究进展[J]. 食品科学, 2017, 38(9): 271-279. DOI:10.7506/spkx1002-6630-201709043.
[8] ESCUDERO E, MORA L, FRASER P D, et al. Purification and identification of antihypertensive peptides in spanish dry-cured ham[J]. Journal of Proteomics, 2013, 78: 499-507. DOI:10.1016/j.jprot.2012.10.019.
[9] SAYD T, CHAMBON C, SANT?-LHOUTELLIER V. Quantification of peptides released during in vitro digestion of cooked meat[J]. Food Chemistry, 2016, 197: 1311-1323. DOI:10.1016/j.foodchem.2015.11.020.
[10] SERPEN A, G?KMEN V, FOGLIANO V. Total antioxidant capacities of raw and cooked meats[J]. Meat Science, 2012, 90(1):
60-65. DOI:10.1016/j.meatsci.2011.05.027.
[11] DAVIS P J, WILLIAMS S C. Protein modification by thermal processing[J]. Allergy, 1998, 53(46): 102-105. DOI:10.1111/j.1398-9995.1998.tb04975.x.
[12] BAX M, AUBRY L, FERREIRA C, et al. Cooking temperature is a key determinant of in vitro meat protein digestion rate: investigation of underlying mechanisms[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2569-2576. DOI:10.1021/jf205280y.
[13] SOLADOYE O P, JU?REZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2): 106-122. DOI:10.1111/1541-4337.12127.
[14] SANGSAWAD P, ROYTRAKUL S, YONGSAWATDIGUL J. Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated in vitro gastrointestinal digestion of cooked chicken breast[J]. Journal of Functional Foods, 2017, 29: 77-83. DOI:10.1016/j.jff.2016.12.005.
[15] ESCUDERO E, SENTANDREU M A, ARIHARA K, et al. Angiotensin Ⅰ-converting enzyme inhibitory peptides generated from in vitro gastrointestinal digestion of pork meat[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2895-2901. DOI:10.1021/jf904204n.
[16] ZHU C Z, ZHANG W G, ZHOU G H, et al. Identification of antioxidant peptides of Jinhua ham generated in the products and through the simulated gastrointestinal digestion system[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 99-108. DOI:10.1002/jsfa.7065.
[17] ZHU Chaozhi, ZHANG Wangang, KANG Zhuangli, et al. Stability of an antioxidant peptide extracted from Jinhua ham[J]. Meat Science, 2014, 96(2): 783-789. DOI:10.1016/j.meatsci.2013.09.004.
[18] WEN Siying, ZHOU Guanghong, LI Li, et al. Effect of cooking on in vitro digestion of pork proteins: a peptidomic perspective[J]. Journal of Agricultural and Food Chemistry, 2014, 63(1): 250-261. DOI:10.1021/jf505323g.
[19] ZHU Chaozhi, ZHANG Wangang, ZHOU Guanghong, et al. Isolation and identification of antioxidant peptides from Jinhua ham[J]. Journal of Agricultural and Food Chemistry, 2013, 61(6): 1265-1271. DOI:10.1021/jf3044764.
[20] SIMONETTI A, GAMBACORTA E, PERNA A. Antioxidative and antihypertensive activities of pig meat before and after cooking and in vitro gastrointestinal digestion: comparison between Italian autochthonous pig Suino Nero Lucano and a modern crossbred pig[J]. Food Chemistry, 2016, 212: 590-595. DOI:10.1016/j.foodchem.2016.06.029.
[21] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[22] WANG Lusha, HUANG Jichao, CHEN Yulian, et al. Identification and characterization of antioxidant peptides from enzymatic hydrolysates of duck meat[J]. Journal of Agricultural and Food Chemistry, 2015, 63(13): 3437-3444. DOI:10.1021/jf506120w.
[23] JENSEN I, DORT J, EILERTSEN K. Proximate composition, antihypertensive and antioxidative properties of the semimembranosus muscle from pork and beef after cooking and in vitro digestion[J]. Meat Science, 2014, 96(2): 916-921. DOI:10.1016/j.meatsci.2013.10.014.
[24] XING Lujuan, HU Yaya, HU Hongyan, et al. Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J]. Food Chemistry, 2016, 194: 951-958. DOI:10.1016/j.foodchem.2015.08.101.
[25] HERN?NDEZ-LEDESMA B, MIRALLES B, AMIGO L, et al. Identification of antioxidant and ACE-inhibitory peptides in fermented milk[J]. Journal of the Science of Food and Agriculture, 2005, 85(6): 1041-1048. DOI:10.1002/jsfa.2063.
[26] PRAKASH M, SHETTY M S, TILAK P, et al. Total thiols: biomedical importance and their alteration in various disorders[J]. 2009, 8(2): 536-547.
DOI:10.1111/j.1469-7580.2009.01129.x.
[27] HAAK L, RAES K, VAN DYCK S, et al. Effect of dietary rosemary and α-tocopheryl acetate on the oxidative stability of raw and cooked pork following oxidized linseed oil administration[J]. Meat Science, 2008, 78(3): 239-247. DOI:10.1016/j.meatsci.2007.06.005.
[28] GATELLIER P, KONDJOYAN A, PORTANGUEN S, et al. Effect of cooking on protein oxidation in n-3 polyunsaturated fatty acids enriched beef. Implication on nutritional quality[J]. Meat Science, 2010, 85(4): 645-650. DOI:10.1016/j.meatsci.2010.03.018.
[29] SANT?-LHOUTELLIER V, ASTRUC T, MARINOVA P, et al. Effect of meat cooking on physicochemical state and in vitro digestibility of myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 2008, 56(4): 1488-1494. DOI:10.1021/jf072999g.
[30] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: a review[J]. Peptides, 2010, 31(10): 1949-1956. DOI:10.1016/j.peptides.2010.06.020.
[31] TAYLOR P G, MARTINEZ-TORRES C, ROMANO E L, et al. The effect of cysteine-containing peptides released during meat digestion on iron absorption in humans[J]. American Journal of Clinical Nutrition, 1986, 43(1): 68-71.
[32] GUPTA D. Methods for determination of antioxidant capacity: a review[J]. International Journal of Pharmaceutical Sciences and Research, 2015, 6(2): 546-566. DOI:10.13040/IJPSR.0975-8232.6(2).546-66.
[33] SIAH C W, TRINDER D, OLYNYK J K. Iron overload[J]. Clinica Chimica Acta, 2005, 358(1/2): 24-36. DOI:10.1016/j.cccn.2005.02.022.
[34] QIAN Z, JUNG W, KIM S. Free radical scavenging activity of a novel antioxidative peptide purified from hydrolysate of bullfrog skin, Rana catesbeiana Shaw[J]. Bioresource Technology, 2008, 99(6): 1690-1698. DOI:10.1016/j.biortech.2007.04.005.
[35] BAUCHART C, R?MOND D, CHAMBON C, et al. Small peptides (<5 kDa) found in ready-to-eat beef meat[J]. Meat Science, 2006, 74(4): 658-666. DOI:10.1016/j.meatsci.2006.05.016.
[36] AHHMED A M, MUGURUMA M. A review of meat protein hydrolysates and hypertension[J]. Meat Science, 2010, 86(1): 110-118. DOI:10.1016/j.meatsci.2010.04.032.
[37] KAWAKAMI A, KAYAHARA H. Synthesis of Leu-Lys-Tyr derivatives and their interaction with angiotensin I converting enzyme[J]. Eiyo to Shokuryo, 1993, 46(5): 425-428. DOI:10.4327/jsnfs.46.425.
- “精准供给”背景下高职院校创新创业教育载体的优化研究
- 全面依法治国背景下职业院校法治意识培育的阈限与路径创新
- 1+X证书制度下中职教育质量监控问题及其改进
- 职教本科发展的英国经验与启示
- 以标准为引领促进本科职教健康有序发展
- 发展职教本科是我国当前产业需求背景下的必然选择
- 职教本科:工程教育与职业教育在生产系统中的形塑
- 异化与回归:高职院校创新创业教育价值取向的重塑
- 学术论文发表三论:重细节、多沟通与“马拉松”
- 立德树人背景下中职生态课堂构建研究
- 新时代职业学校德育模式的实施途径研究
- 职业教育服务区域经济社会发展研究
- 我国职业教育治理现代化研究热点与脉络演进
- 区域职业教育发展命运共同体:类型与融合的实践创新
- 职业教育类型属性下的普职融通:特点、使命与行动
- 现代职业教育的价值内涵、发展困境与战略选择
- 技术素养的内涵变化与技术型人才培养的变革
- 职业院校教学诊改:科学主义与人文主义的博弈
- 学术论文写作三论:高立意、明规范与“说行话”
- 产业转型升级背景下中等职业学校专业设置问题研究
- “1+X”证书制度下中职建筑专业“双师型”教师教学能力提升研究
- 中职教师工作量的科学核算与合理安排
- 互动与协同增效:巴西职业技能竞赛和职业技术教育与培训的研究与借鉴
- 美国替代性职教教师执照:经验与启示
- 混合式教学模式在工程实训教学中的应用
- thermally
- thermals
- thermo
- thermoacidophile
- thermochromic
- thermochromism
- thermochromy
- thermocompression
- thermo-elastic
- thermogenetic, thermogenic
- thermogravimetric
- thermo-junction
- thermokarst
- thermolability
- thermomagnetism
- thermometer
- thermometers
- thermometrically
- thermo-multiplier
- thermonastic
- thermoneutrality
- thermonuclear
- thermo-nuclear
- thermopower
- thermoremanence
- 著作难以预期脱稿
- 著作,论述
- 著先鞭
- 著力
- 著号
- 著名
- 著名学者
- 著名学者和优秀人才
- 著名学者和很有才德的人
- 著名 无名
- 著名的专家
- 著名的人或事物
- 著名的人物
- 著名的医生
- 著名的博学之士
- 著名的句子或词组
- 著名的大山
- 著名的大山大河
- 著名的学府
- 著名的学说、学派、学问
- 著名的寺院
- 著名的将领
- 著名的戏曲演员
- 著名的文学家
- 著名的文章