田士东 张生军 杜秉霖
摘 ? ? ?要:简述了离子液体、低共熔离子液体、固载化离子液体用于NOx去除的研究现状,讨论了离子液体吸收NOx的规律和反应机理,进一步介绍了离子液体在NOx分析检测中应用的研究进展。对近年来的最新研究成果进行了系统的总结,分析了目前存在的主要问题,提出低成本、高效的离子液体及其材料,离子液体去除NOx工艺系统,灵敏度高、选择性好的NOx分析检测方法是未来的重点研究方向,为新型NOx排放控制技术的发展提供了参考。
关 ?键 ?词:离子液体;吸收;分离;传感器;NOx
中图分类号:X 511 ? ? ? 文献标识码: A ? ? ? 文章编号: 1671-0460(2019)12-2939-05
Abstract: Current status of research on the removal of NOx by ionic liquids (ILs), deep eutectic ILs and immobilized ILs was briefly described, and the absorption regular pattern and mechanism were discussed. Furthermore, the application of ILs in NOx analysis and detection was introduced. The latest development in recent years was systematically summarized, and the main problems existing at present were analyzed. Finally, it was pointed that future research directions include development of ILs and their materials with low cost and high efficiency, new process of NOx removal, NOx analysis and detection method with high sensitivity and good selectivity. The paper can provide reference for the development of new technology for NOx emissions control.
Key words: Ionic liquids; Absorption; Separation; Sensor; NOx
氮氧化物(NOx)是一类典型的大气污染物,其主要来源于化石能源燃烧以及自然界中有机物分解两个过程。随着现代社会的快速发展,大量的NOx被排入环境中,例如,2015年我国NOx排放总量高达1851.9万t。大规模的NOx排放是造成光化学烟雾[1]、雾霾[2]等严重生态灾害的关键因素之一,对其进行有效控制成为世界范围内各国关注的重点。近年来,我国在NOx排放控制上开展了大量的工作,各个行业均对NOx排放提出了明确的指标。2018年国务院印发的《打赢蓝天保卫战三年行动计划》明确指出“到2020年,NOx排放总量比2015年下降15%以上,重点区域NOx全面执行大气污染物特别排放限值”。由此可见,我国在NOx排放控制上还需要开展大量的工作。目前现有的NOx排放控制技术主要有低氮燃烧、SCR法、SNCR法、活性炭法、氧化-吸收法等[3]。由于不同来源的废气在工况和组成上具有显著的差异性,各种技术难以完全适用。因此,积极开发新型NOx去除技术以及NOx分析检测方法对于现有技术体系的完善和升级具有非常重要的意义。
近年来,离子液体(ILs)作为一种具有蒸气压低、热稳定性好、结构可设计性强等优点的新型溶剂,成为有机合成与催化[4]、液液萃取[5]、气体分离[6]、生物质转化[7]、新能源电池[8]、生物医药[9]等各个领域内关注和研究的热点。目前离子液体在环境污染物控制方面取得了突破性进展,已经有多项创新技术处于工业试验或商业推广阶段。例如,ION ENGINEERING公司开发了低能耗的CO2捕集新技术,可将吨CO2处理成本降至20美元(传统技术为50~100美元)[10];SHELL公司开发了可高效处理SO2并实现其回收及资源化利用的脱硫新技术[11];PETRONAS公司开发了去除率高达99.998%的天然气脱汞新技术[12]等。此外,由于离子液体具有良好的电化学性质,在分析检测方面也显示出较大的应用潜力[13]。关于离子液体在NOx排放控制中应用的研究虽然起步较晚,但是也取得了一系列进展。在下文中对近年来关于离子液体、低共熔离子液体、固载化离子液体用于NOx去除以及离子液体用于NOx分析检测的最新研究进展进行了系统的总结,分析了研究现状及目前存在的问题,为今后的发展方向提出了一些建议。
1 ?离子液体用于NOx去除
NOx的存在形式主要有N2O、NO、N2O3、NO2、N2O4、N2O5等[3],其中N2O是一类温室气体,其温室效应潜能是CO2的180倍[14],对其进行排放控制引起研究者的广泛关注。Revelli等[15]在温度为0~100℃、压力为0~300 bar的实验条件下测定了N2O在[Bmim][BF4]、[Bmim][SCN]、[Dmim][MP]、[(ETO)2IM][Tf2N]、[(OH)2IM][Tf2N]等五种离子液体中的溶解度,结果表明,[Bmim][BF4]和[(ETO)2IM][Tf2N]是最為理想的离子液体,N2O在其中的溶解度分别高达95、105 g N2O/kg IL,这为离子液体作为高效的N2O吸收剂提供了可能。Anthony等[16]在温度为10~50 ℃、压力为0~13 bar的实验条件下测定了N2O、CO2、O2等多种气体在[Bmim][Tf2N]中的溶解度,结果表明,N2O在10、25、50 ℃时的亨利常数分别为25.7 ± 0.3、33.6 ± 0.3、49.5 ± 0.8 bar,其溶解度随着温度的升高而呈现下降趋势;通过对比不同气体的溶解度发现,N2O和CO2的溶解度非常接近,远远大于其他气体,这为不同气体的选择性分离提供了基础依据。针对N2O和CO2在短链离子液体中溶解度接近,难以分离的难题,Langham等[17]发现N2O在长链离子液体[Oleylmim][Tf2N]中的溶解度大于CO2,通过调节离子液体阳离子的链长是一种实现N2O和CO2分离的有效方法。此外,研究者还针对N2O-IL/CO2-IL二元以及N2O-CO2-IL三元气液相平衡开展了大量的实验研究,并建立了热力学模型,这些研究均为N2O和CO2的选择性分离奠定了基础[18-21]。
NO和NO2是大气中NOx的主要成分,也是目前各行业大气污染物在线检测的重要指标,离子液体用于NO和NO2去除显示出较大的应用潜力。Yuan等[22]研究了NO2在[Emim][OTF]、[Bmim][OTF]、[Hmim][OTF]等三种离子液体中的溶解规律,结果表明,NO2在离子液体中的溶解度与初始分压、吸收温度、阳离子的空间位阻等因素密切相关;在P0 = 60 kPa的实验条件下,不同离子液体对NO2的吸收能力遵循如下规律:[Hmim][OTF]>[Bmim][OTF]>[Emim][OTF];通过多次吸收-解吸循环实验发现,该过程是可逆的,且离子液体吸收能力并未出现明显下降,这为其潜在的应用提供了依据。由于离子液体黏度比较大,严重影响传质效果,Liu等[23]提出利用离子液体[Bmim][PF6]-有机碱复合吸收剂吸收NO2,结果表明,与纯离子液体相比,复合吸收剂的黏度大幅度下降,且表现出较好的吸收能力,这为离子液体在实际中的应用提供了新的思路。在真实烟气中,NOx的浓度较低,且主要以NO的形式存在,而离子液体对低浓度NO吸收效果较差。为了提高吸收效率,Li等[24]在一定的吸收压力下研究了离子液体[Bmim][OAc]对NO的去除规律,结果表明,[Bmim][OAc]对低浓度NO的去除率可以达到93.5%,这一重要的发现极大地推进了离子液体在低浓度NO处理中的应用。在理论研究方面,Huang等[25]采用密度泛函理论研究了NO2(或N2O4)与离子液体[Emim][OTF]之间的作用规律,结果表明,阴离子和NO2(或N2O4)之间的作用力是决定离子液体吸收性能的关键因素,而阳离子和NO2(或N2O4)之间的π-π作用力并不明显,该研究结果为新型高效离子液体的设计与合成指明了方向。
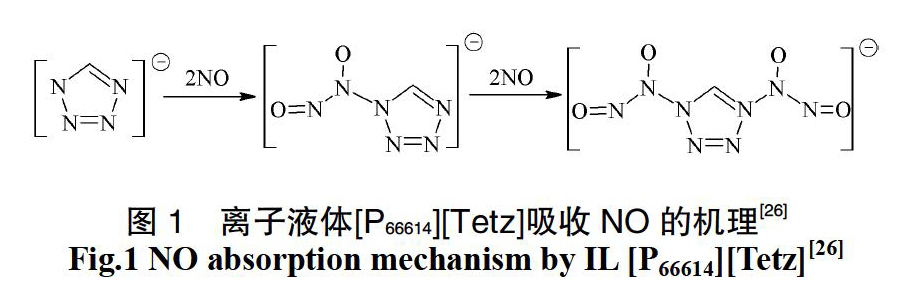
通过对离子液体引入特殊官能团,可以设计、合成出功能化离子液体,其不仅具有常规离子液体的性质,同时还具有提高NOx吸收量和选择性的作用。Chen等[26]以含氮杂环化合物为阴离子设计合成出功能化离子液体[P66614][Tetz],由于含有多个活性位点,[P66614][Tetz]表现出非常高的NO吸收能力。例如,在温度为30 ℃、压力为1 bar的实验条件下,[P66614][Tetz]对NO的吸收量为4.52 mol NO/mol IL,而常规离子液体[P66614][Tf2N]对NO的吸收量仅为0.25 mol NO/mol IL;同时,[P66614][Tetz]对低浓度NO(0.1 bar)也表现出较好的吸收性能,其吸收量仍然高达3.26 mol NO/mol IL。此外,他们结合实验结果、量子化学计算、NMR和FT-IR表征对作用机理进行了研究,结果表明,NO和离子液体的阴离子通过多个反应位点生成了具有R1R2N?(NO?)?N=O结构的新型阴离子,其反应机理见图1。上述研究结果为高效、高吸收量的功能化离子液体的设计与合成指明了方向。Sun等[27]设计合成出金属基功能化离子液体[Bmim]2[FeCl4],并研究了其对NO的吸收规律及作用机理,结果表明,在温度为30 ℃、NO浓度为0.2%的实验条件下,[Bmim]2[FeCl4]对NO的吸收量可以达到0.205 mol NO/mol IL;[Bmim]2[FeCl4]显示出良好的再生性能,经过多个吸收/解吸循环,其对NO的吸收能力并无明显下降;FT-IR结果表明,[Bmim]2[FeCl4]与NO发生了显著的化学作用,Fe2+为主要的吸收活性物种。由于功能化离子液体可以对低浓度NO通过化学作用实现高效吸收,在真实废气处理中具有更大的优势。因此,功能化离子液体的设计、合成与与应用将成为以后的重要研究方向。
离子液体除了对NOx具有良好的吸收作用以外,同时还显示出一定的催化潜力。Kunov-Kruse等[28]发现在有O2和H2O存在的情况下,阴离子可以将NO催化氧化成硝酸,在反应过程中生成的硝酸可以通过氢键作用被吸收到离子液体中(吸收量可以达到1 mol HNO3/mol IL),而吸收了硝酸的离子液体可以通过加热的方式实现再生及循环利用,这一重要发现为离子液体作为催化氧化-吸收材料用于NOx去除提供了新的思路。此外,Rasmussen等[29]发现基于金属氧化物离子液体的催化剂可用于NO的还原脱除,通过对比实验发现,[TMG2][CrO4]-TiO2表现出最好的催化还原活性,在反应温度为180 ℃、NO初始浓度为1 000 ppm的实验条件下,NO的转化率大于80%,而采用商用SCR催化剂时,NO的转化率低于30%。由此可见,基于金属氧化物离子液体的催化剂有望开发出新型高效的低温SCR脱硝技术,在以后工作中还需要加强催化剂的制备方法、性能评价、失活机理及再生等方面的研究。
2 ?低共熔离子液体用于NOx去除
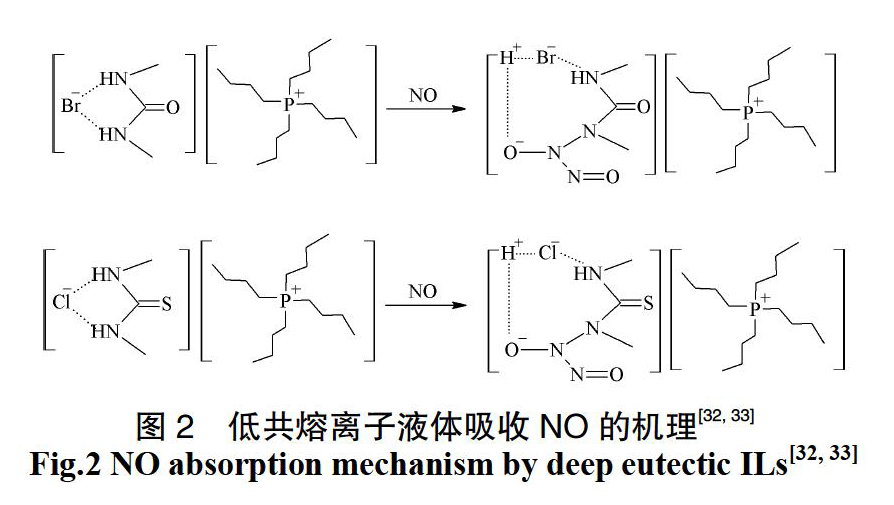
由于在离子液体的制备过程中一般需要溶剂,且涉及化学反应、纯化等多个步骤,制备工艺比较复杂,如何简化离子液体的制备工艺也是目前研究者关注的焦点。一般来讲,低共熔离子液体主要由含卤素离子的盐与氢键供体(含氨基、羧基、羟基等官能团的化合物)按照一定的比例混合而成,具有原料来源广泛、制备工艺简单等优点,目前已在多个领域取得了应用[30]。关于低共熔离子液体用于NOx去除也开展了大量的研究工作。Duan等[31]以季铵盐和己内酰胺为原料制备了一系列低共熔离子液体[TBAX][CPL](X = F、Cl、Br),并研究了其对NO和NO2的吸收规律及机理,结果表明,反应温度和离子液体组成是影响其吸收NOx的关键因素,通过对比发现,在反应温度为25 ℃时,[TBABr][CPL](摩尔比为1∶2)对NO和NO2具有最大的吸收量,分别可以达到0.170和0.809(摩尔分数);1H-NMR结果表明[TBABr][CPL]对NOx的吸收属于物理反应,且吸收过程是可逆的,[TBABr][CPL]经过多次循环使用性能基本保持不变。上述研究结果为低共熔离子液体用于NOx去除提供了借鉴。Zhang课题组分别以季鏻盐和1,3-二甲基脲[32]、季鏻盐和1,3-二甲基硫脲[33]为原料制备了一系列低共熔离子液体,并研究了这些离子液体对NO的吸收规律及机理,结果表明,[P4444Cl][1,3-DMTU](摩尔比为1∶3)具有最大的NO吸收量,可以达到4.25 mol NO/mol IL,同时这些离子液体具有非常优良的重复使用性能;FT-IR、NMR结果表明低共熔离子液体吸收NO是通过化学作用实现的(图2),在反应过程中,NO和氢键供体可以生成新的化学结构?N?(NO?)?N=O,这为低浓度NO的化学吸收提供了新的思路。在理论研究方面,Waite等[34]采用量子化学方法研究了NO2在由氯化胆碱和氢键供体(尿素、甲基脲、硫脲)组成的低共熔离子液体中的溶剂化结构及吸收机理,结果表明,NO2在低共熔离子液体中的溶剂化结构主要是由氢键供体决定的,改变氢键供体不仅可以改变NO2的配位机制,同时还会改变NO2与胆碱以及氯离子的配位机制,在所研究的氢键供体中,硫脲具有最好的效果。由此可见,通过对氢键供体结构进行优化来制备可以高效吸收NOx的低共熔離子液体将成为以后的研究重点。
3 ?固载化离子液体用于NOx去除
虽然离子液体具有非常多的优良性质,但是其黏度远远大于传统溶剂,这将严重阻碍其在工业中的真实应用。为了降低传质阻力,将高黏度的离子液体固载于多孔材料上成为解决该问题的有效方法[35, 36]。目前,关于固载化离子液体用于NOx去除的研究相对较少。Thomassen等[37]发现将高黏度的离子液体均匀地分散在比表面较大的多孔材料上可以形成液膜(或小液滴),这将极大地提高离子液体对NOx的吸收速率以及离子液体的再生速率。同时,他们还发现以TiO2为载体的固载化离子液体对NO表现出非常好的吸收性能[37, 38]。由此可见,通过选择合适的载体,将离子液体制备成脱硝材料,并开发与之配套的固定床/移动床脱硝工艺对于实现离子液体脱硝技术的工业应用具有非常重要的意义。
4 ?离子液体用于NOx分析检测
NOx的分析检测是其减排控制的基础,因此开发新型高效的NOx分析检测技术也具有重要的价值。由于离子液体具有优良的电化学性质,基于离子液体的电化学气体传感器的开发成为目前研究的热点[39]。Broder等[40]采用循环伏安法在不同尺寸的Pt电极上(10、100、500 μm)研究了NO2在[C2mim][Tf2N]中的电化学氧化行为,结果表明,NO2在离子液体介质中主要以二聚体形式N2O4存在,在电化学氧化过程中可以发现两个明显的氧化峰,通过计算得到NO2在离子液体介质中的扩散系数为1.6×10–10 m2/s,溶解度约为51 mmol/L,这为离子液体介质应用于NO2传感器提供了基础理论依据。Toniolo等[41]基于离子液体的优点开发了可用于检测NOx的气体传感器,通过伏安法测试表明,NO2和NO具有非常接近的氧化电位,而其他可能的干扰性气体,如CO、H2S、SO2等,在非常高的电位下才能发生氧化反应,因此,利用该传感器可以实现NOx和其他气体的选择性分析检测;在NOx浓度为0.01~1 000 ppm的实验条件下对气体传感器进行的测试结果表明,在室温条件下,其检测限可以达到0.96 ppb,而在100 ℃的条件下,检测限可以达到0.55 ppb。上述研究结果为工业废气中低浓度NOx以及环境中痕量NOx的分析检测提供了可能。此外,其他研究者如Nadherna等[42, 43]以及Kubersky等[44, 45]对基于离子液体NOx传感器的开发也做了一定的研究。除了气体传感器,溶蚀器也在环境污染物分析检测中发挥了重要的作用,关于溶蚀器涂覆材料的开发是研究者关注的重点。Wolf等[46]首次将离子液体用作溶蚀器涂覆材料,结果表明,在室温条件下,离子液体[Bmim][I]对NO2的吸收量和去除率远远大于KI/PEG。由此可见,[Bmim][I]是一种新型高效的涂覆材料,这为离子液体在NOx分析检测方面的应用开辟了新的方向。
5 ?结 语
随着人们环保意识的提高,NOx的排放控制已经成为环保领域内的一大研究热点。近年来备受关注的新型溶剂离子液体在NOx排放控制中的应用取得了非常大的进展,这些研究成果为新型NOx排放控制技术的发展奠定了深厚的基础。从目前的研究来看,主要存在如下问题:(1)离子液体种类繁多,采用实验手段进行筛选工作量巨大,但是目前尚未建立科学有效的预测方法,难以借助计算机等现代手段进行离子液体结构的设计;针对常规离子液体吸收量小、制备工艺复杂、成本高、黏度大等缺点,研究者分别开发了功能化离子液体、低共熔离子液体、固载化离子液体,但是目前尚未开发出可以完全克服现有离子液体固有缺点的新产品,这将严重阻碍其在工业中的进一步应用;(2)关于离子液体脱除NOx工艺的研究主要集中在反应温度、NOx濃度、离子液体种类等关键影响因素的考察,对于废气中的干扰组分如SO2、H2O等对离子液体吸收NOx过程的影响规律以及吸收动力学、热力学等研究涉及较少,而关于离子液体脱硝工艺系统及核心反应器的设计及开发的研究尚未开展;(3)离子液体在NOx分析检测中的应用目前仅处于实验室研究阶段,仍存在灵敏度低、检测限低、选择性差等问题函待解决。综合考虑上述问题,低成本、高效的离子液体及其材料,离子液体去除NOx工艺系统,灵敏度高、选择性好的NOx分析检测方法是未来的重点研究方向。随着科技的不断发展,新型溶剂离子液体必将在NOx排放控制中发挥越来越重要的作用,为大气污染物治理技术的全面升级提供支撑。
参考文献:
[1]Tiao G C, Box G E P, Hamming W J. Analysis of Los Angeles photochemical smog data: a statistical overview[J]. J. Air Poll. Control Assoc., 1975, 25(3): 260-268.
[2]Wang G H, Zhang R Y, Gomez M E, et al. Persistent sulfate formation from London Fog to Chinese haze[J]. Proc. Natl. Acad. Sci. USA, 2016, 113(48): 13630-13635.
[3]Skalska K, Miller J S, Ledakowicz S. Trends in NOx abatement: a review[J]. Sci. Total Environ., 2010, 408(19): 3976-3989.
[4]Welton T. Room-temperature ionic liquids. Solvents for synthesis and catalysis[J]. Chem. Rev., 1999, 99(8): 2071-2084.
[5]Huddleston J G, Willauer H D, Swatloski R P, et al. Room temperature ionic liquids as novel media for clean liquid-liquid extraction[J]. Chem. Commun., 1998 (16): 1765-1766.
[6]Lei Z G, Dai C N, Chen B H. Gas solubility in ionic liquids[J]. Chem. Rev., 2014, 114(2): 1289-1326.
[7]Zhu S D, Wu Y X, Chen Q M, et al. Dissolution of cellulose with ionic liquids and its application: a mini-review[J]. Green Chem., 2006, 8(4): 325-327.
[8]Lewandowski A, Swiderska-Mocek A. Ionic liquids as electrolytes for Li-ion batteries-an overview of electrochemical studies[J]. J. Power Sources, 2009, 194(2): 601-609.
[9]Egorova K S, Gordeev E G, Ananikov V P. Biological activity of ionic liquids and their application in pharmaceutics and medicine[J]. Chem. Rev., 2017, 117(10): 7132-7189.
[10]New carbon capture technology promises cleaner power plants[EB/OL]. New Atlas, [2009-02-27]. https://newatlas.com/ionic-liquid-CO2-emissions-control/11105/.
[11]Roy P, Birnbaum R, Sarlis J. Use a Cansolve SO2 scrubbing system to better link your batch-operated furnace with its by-product sulphuric acid plant[J]. J. S. Afr. Inst. Min. Metall., 2007, 107(5): 305-313.
[12]Abai M, Atkins M P, Hassan A, et al. An ionic liquid process for mercury removal from natural gas[J]. Dalton Trans., 2015, 44(18): 8617-8624.
[13]Sun P, Armstrong D W. Ionic liquids in analytical chemistry[J]. Anal. Chim. Acta, 2010, 661(1): 1-16.
[14]Lashof D A, Ahuja D R. Relative contributions of greenhouse gas emissions to global warming[J]. Nature, 1990, 344: 529-531.
[15]Revelli A L, Mutelet F, Jaubert J N. Reducing of nitrous oxide emissions using ionic liquids[J]. J. Phys. Chem. B, 2010, 114(24): 8199-8206.
[16]Anthony J L, Anderson J L, Maginn E J, et al. Anion effects on gas solubility in ionic liquids[J]. J. Phys. Chem. B, 2005, 109(13): 6366-6374.
[17]Langham J V, O'Brien R A, Davis J H, et al. Solubility of CO2 and N2O in an imidazolium-based lipidic ionic liquid[J]. J. Phys. Chem. B, 2016, 120(40): 10524-10530.
[18]Shiflett M B, Niehaus A M S, Yokozeki A. Separation of N2O and CO2 using room-temperature ionic liquid [bmim][BF4][J]. J. Phys. Chem. B, 2011, 115(13): 3478-3487.
[19]Shiflett M B, Niehaus A M S, Elliott B A, et al. Phase behavior of N2O and CO2 in room-temperature ionic liquids [bmim][Tf2N], [bmim][BF4], [bmim][N(CN)2], [bmim][Ac], [eam][NO3], and [bmim][SCN][J]. Int. J. Thermophys., 2012, 33(3): 412-436.
[20]Shiflett M B, Elliott B A, Niehaus A M S, et al. Separation of N2O and CO2 using room-temperature ionic liquid [bmim][Ac][J]. Sep. Sci. Technol., 2012, 47(2): 411-421.
[21]Pereira L M C, Oliveira M B, Llovell F, et al. Assessing the N2O/CO2 high pressure separation using ionic liquids with the soft-SAFT EoS[J]. J. Supercrit. Fluids, 2014, 92: 231-241.
[22]Yuan G, Zhang F, Geng J, et al. Highly efficient reversible adsorption of NO2 in imidazole sulfonate room temperature ionic liquids[J]. RSC Adv., 2014, 4(74): 39572-39575.
[23]Liu B Y, Zhang P W. The application of ionic liquid composite materials in denitrification from flue gas[C]. 2017 Asia-Pacific Engineering and Technology Conference, 2017: 2412-2417.
[24]Li X S, Zhang L Q, Li L W, et al. NO removal from flue gas using conventional imidazolium-based ionic liquids at high pressures[J]. Energy Fuels, 2018, 32(5): 6039-6048.
[25]Huang J Y, Fu A P, Li H L, et al. Density functional study of the mechanism of nitric oxide captured by [Emim][OTf] ionic liquids[C]. Proceedings of the 2016 International Conference on Advanced Materials and Energy Sustainability, 2017: 156-162.
[26]Chen K H, Shi G L, Zhou X Y, et al. Highly efficient nitric oxide capture by azole-based ionic liquids through multiple-site absorption[J]. Angew. Chem. Int. Ed., 2016, 55(46): 14364-14368.
[27]Sun Y, Ren S H, Hou Y C, et al. Absorption of nitric oxide in simulated flue gas by a metallic functional ionic liquid[J]. Fuel Process. Technol., 2018, 178: 7-12.
[28]Kunov-Kruse A J, Thomassen P L, Riisager A, et al. Absorption and oxidation of nitrogen oxide in ionic liquids[J]. Chem. Eur. J., 2016, 22(33): 11745-11755.
[29]Rasmussen S B, Huang J, Riisager A, et al. Flue gas cleaning with alternative processes and reaction media [J]. ECS Trans., 2007, 3(35): 49-59.
[30]Zhang Q H, Vigier K D O, Royer S, et al. Deep eutectic solvents: syntheses, properties and applications[J]. Chem. Soc. Rev., 2012, 41(21): 7108-7146.
[31]Duan E H, Guo B, Zhang D D, et al. Absorption of NO and NO2 in caprolactam tetrabutyl ammonium halide ionic liquids[J]. J. Air & Waste Manage. Assoc., 2011, 61(12): 1393-1397.
[32]Jiang B, Lin W R, Zhang L H, et al. 1,3-Dimethylurea tetrabutylphosphonium bromide ionic liquids for NO efficient and reversible capture[J]. Energy Fuels, 2016, 30(1): 735-739.
[33]Sun Y L, Wei G S, Tantai X W, et al. Highly efficient nitric oxide absorption by environmentally friendly deep eutectic solvents based on 1,3-dimethylthiourea[J]. Energy Fuels, 2017, 31(11): 12439-12445.
[34]Waite S L, Li H, Page A J. NO2 solvation structure in choline chloride deep eutectic solvents-the role of the hydrogen bond donor[J]. J. Phys. Chem. B, 2018, 122(15): 4336-4344.
[35]Zhang J M, Zhang S J, Dong K, et al. Supported absorption of CO2 by tetrabutylphosphonium amino acid ionic liquids[J]. Chem. Eur. J., 2006, 12(15): 4021-4026.
[36]Zhang Z M, Wu L B, Dong J, et al. Preparation and SO2 sorption/desorption behavior of an ionic liquid supported on porous silica particles[J]. Ind. Eng. Chem. Res., 2009, 48(4): 2142-2148.
[37]Thomassen P, Kunov-Kruse A J, Mossin S, et al. Separation of flue gas components by SILP (supported ionic liquid-phase) absorbers[J]. ECS Trans., 2012, 50(11): 433-442.
[38]Kolding H, Thomassen P, Mossin S, et al. Absorption of flue-gas components by ionic liquids[J]. ECS Trans., 2014, 64(4): 97-108.
[39]Gebicki J, Kloskowski A, Chrzanowski W, et al. Application of ionic liquids in amperometric gas sensors[J]. Crit. Rev. Anal. Chem., 2016, 46(2): 122-138.
[40]Broder T L, Silvester D S, Aldous L, et al. Electrochemical oxidation of nitrite and the oxidation and reduction of NO2 in the room temperature ionic liquid [C2mim][NTf2][J]. J. Phys. Chem. B, 2007, 111(27): 7778-7785.
[41]Toniolo R, Dossi N, Pizzariello A, et al. A membrane free amperometric gas sensorbased on room temperature ionic liquids for the selective monitoring of NOx[J]. Electroanalysis, 2012, 24(4): 865-871.
[42]Nadherna M, Opekar F, Reiter J. Ionic liquid-polymer electrolyte for amperometric solid-state NO2 sensor[J]. Electrochim. Acta, 2011, 56(16): 5650-5655.
[43]Nadherna M, Opekar F, Reiter J, et al. A planar, solid-state amperometric sensor for nitrogen dioxide, employing an ionic liquid electrolyte contained in a polymeric matrix[J]. Sens. Actuators B, 2012, 161(1): 811-817.
[44]Kubersky P, Altsmid J, Hamacek A, et al. An electrochemical NO2 sensor based on ionic liquid: influence of the morphology of the polymer electrolyte on sensor sensitivity[J]. Sensors, 2015, 15(11): 28421-28434.
[45]Kubersky P, Syrovy T, Hamacek A, et al. Towards a fully printed electrochemical NO2 sensor on a flexible substrate using ionic liquid based polymer electrolyte[J]. Sens. Actuators B, 2015, 209: 1084-1090.
[46]Wolf J C, Niessner R. High-capacity NO2 denuder systems operated at various temperatures (298-473 K)[J]. Anal. Bioanal. Chem., 2012, 404(10): 2901-2907.
- 通信工程的成本控制研究与探索
- 阐述光纤通信技术的应用现状及其发展趋势
- 移动通信客户投诉的智能诊断方法研究
- 关于面向计算思维训练的计算机课程改革
- 关于河南省高职教学资源库建设的思考
- 成才视野下的高中语文多媒体教学探索
- 高职院校科研与学科建设的关系探讨
- 基于OTN的1588v2时间同步传送技术方案探讨
- Web前端开发技术以及优化研究
- 呼吸机呼吸模式的控制技术专利综述
- 自动化控制设备的维护问题分析
- 基于运营商的数据质量管控体系探讨
- 长途MSTP专线升速调测流程解析
- 双机热备专利技术
- 半实物仿真电台面板自识别设计与实现
- OTN 网络中的SNCP保护
- 末端PTN网元失效告警定位技术的研究
- 关于云计算数据中心大数据安全技术分析
- 企业网络信息安全存在的问题及对策
- 计算机控制系统中PC机与现场设备通信软件开发研究
- 计算机网络防御策略求精关键技术研究
- 对10kV配网供电运行可靠性优化的研究
- 终端站光端设备扩容改造的选配策略与实现
- 试论集成电路的检测及维护方法
- WLAN技术在地铁通信领域中的应用
- alleviators
- alley
- alleyed
- alleys
- allfinanz
- all for
- all-for-best
- all-for-the-best
- all go
- all gone
- all-hand
- allhands
- all-hands
- all-heap
- all-hot-and-bothered
- all-hot-bothered
- alliable
- alliance
- alliances
- alliance's
- allied
- !allies
- allies
- alligator
- alligatored
- 四射
- 四小
- 四小名旦
- 四小虎
- 四小龙
- 四尽
- 四履所至
- 四山五岳
- 四山合抱
- 四岳
- 四嶽
- 四川
- 四川、重庆地区
- 四川清音
- 四川的担担面
- 四川的盖碗茶
- 四川盆地
- 四川相书
- 四川省
- 四川虓将
- 四川评书
- 四平
- 四平八满
- 四平八稳
- 四平市