
收稿日期:2014-07-30 修回日期:2015-06-07 网络出版时间:2015-07-24
网络出版地址:http://www.cnki.net/kcms/detail/13.1334.TV.20150724.1124.007.html
基金项目:国家水体污染控制与治理科技重大专项基金资助项目(2008ZX07012-002-004);北京市委、市政府重点工作及区县政府应急预启动项目(Z10110605540000)
作者简介:尹 涛(1979-),男,山东菏泽人,博士研究生,主要从事湖泊富营养化及水华机理研究。E-mail:yintaowood@163.com
通讯作者:丁爱中(1969-),男,安徽怀宁人,教授,博士生导师,主要从事水污染控制、水生态与环境修复研究。E-mail:ading@bnu.edu.cn
摘要:在水华发生期间,采集南海子湖藻液,置于光反应器FMT150在不同条件下培养,结果表明:在12h周期性条件培养下,藻液的溶解氧、二氧化碳、叶绿素荧光呈12 h周期性响应,同时,OD680出现24 h的日周期;12 h后,将周期性条件转变成恒定条件,叶绿素荧光开始时表现为12 h周期性,随后周期逐渐变长。由此认为,浮游植物群落存在周期性。
关键词:水华;浮游植物;周期性;富营养化;南海子湖
中图分类号:X524 文献标志码:A 文章编号:
1672-1683(2015)04-0650-04
Physiological responses of phytoplankton to the periodic changes of
environment during water bloom in Nanhaizi Lake of Beijing
YIN Tao,DING Ai-zhong
(College of Water Sciences/ Key Laboratory for Water and Sediment
Sciences of Ministry of Education,Beijing Normal University,Beijing 100875,China)
Abstract:Algae liquid was taken from the Nanhaizi Lake during the bloom course and was put into the photobioreactor FMT150 and cultured under different conditions.The results showed that (1) under the 12-hour periodic cultivation conditions,the dissolved oxygen,carbon dioxide,chlorophyll fluorescence of algae solution appear with a 12-hour periodic response,and OD680 shows the daily periodicity of 24 hours;and (2) after 12 hours,the periodic conditions were changed to the constant conditions,chlorophyll fluorescence shows the 12-hour periodicity at first and then the periodicity starts to increase gradually.The results suggested that periodicity exists in the community of phytoplankton.
Key words:water bloom;phytoplankton;periodicity;eutrophication;Nanhaizi Lake
水华是藻类在适宜的条件下、短时间内生物量急剧升高的一种现象,水华是由多种藻组成的复杂的微生态系统,其中包括蓝藻、绿藻、硅藻以及细菌和浮游动物等。水华的发生原因以及过程已有许多研究,水华的生成机理有多种假设,尚没有定论。水华中的浮游植物是由多种藻组成的,其受到营养盐、光照、水动力条件对单一藻类的生理影响有很多研究[1-3]。但是对其作为一个群体的周期性研究的尚不多。
周期性是自然界的普遍现象。人类活动周期为24 h。植物有生长有周期性[4-5]。20世纪80年代之前,人们认为微生物等原核生物不存在日周期性[6],后来发现微生物也存在生理日周期性[7-8]。单一藻也存在生理周期性[9]。种群也具有生理周期性[10],一个生态系统也有周期性[11-12]。水华是多种微生物等组成的复杂的微生态系统,因此也可能具有周期性。周期性有多种,其中典型的有日周期性。日周期性是生物的生物钟控制的,表现为大约24 h的周期性波动,生物的表现浮游植物日周期性参数有多种,包括溶解氧、二氧化碳、pH等。因此,为验证浮游植物群落的周期性,可以对上述参数进行考查。鉴于野外湖泊水体的复杂性,外界环境的复杂变化可以掩盖系统的周期性,因此精确控制温度、光照对于发现生态系统的周期性有重要作用。
为研究水华发生过程中的浮游植物对环境周期性变化的响应,在水华爆发期间的南海子湖进水口采集藻液,并在设定温度、光照条件下培养分析,结果表明藻液的叶绿素荧光等参数存在日周期性。浮游植物存在生理周期性,从新的角度反映了南海子湖水华过程,有利于进一步精确了解水华的发生原因及过程,对于水华的预警和控制具有重要意义。
1 材料和方法
1.1 样品采集及分析
南海子湖面积约300 150 m2,水深1.5 m,每年5月到10月易发生水华。2013年5月从北京南海子湖进水口区(北纬9°46′19″,东经16°27′22.1″)用广口瓶取浓水华藻液,然后取其中的50 ml与300 ml湖泊水混合后,置于改造过的生物反应器FMT-150中培养,设定蓝光光照强度最小为0 μE,最大光强为40 μE;红光光照强度最小光强为0 μE,最大光强为30 μE;温度的最高值为25 ℃、最低值为15 ℃;试验起始光强为0 μE,起始温度为15 ℃;周期均为12 h。在进行72 h培养后,设定蓝光光强为20 μE,红光为15 μE;设定恒定温度20 ℃。
1.2 藻液及湖泊水质
水华藻类主要有蓝藻包括平裂藻(Merismopedia sp.)、微囊藻(Microcysis sp.)、纤维藻(Ankistrodesmus sp.)、鞘丝藻(Lyngbya sp.);螺旋藻(pirulina sp.);绿藻包括盘星藻(Pediastrum sp.)、栅藻(Scenedesmus sp.)、并联藻属(Ulothrix sp.)、小球藻(Chlorella sp.)、十字藻(Crucigenia sp.);硅藻中有针杆藻(Synedra sp.)、舟形藻(Navicula sp.)、曲壳藻(Achnanthes sp.)、小环藻(Cyclotella sp.)。
湖泊水的总氮为2.14 mg/L,总磷0.15 mg/L。
1.3 生物反应器FMT-150
采用的FMT-150光反应器精确地控制温度与光照,满足研究水华微生物群落的周期性生理响应。长方体前后由(0.1 m×0.2 m)透明玻璃板构成,厚度为0.02 m,可容纳350 mL溶液。温度由置于容器底部和上层溶液之间的帕尔贴热电偶控制。容器装置由可以拆卸的溶解氧电极(Mettler Toledo)以及二氧化碳电极(Mettler Toledo)组成。光源置于长方体容器后,为12排4列蓝(λmax≈455 nm,Δλ 1/2=20 nm)与4列红(λmax≈627 nm,Δλ 1/2=20 nm)相间的led灯组成。底部设置有荧光计和光密度计,用来监测藻类的叶绿素荧光和OD值。
2 结果与分析
2.1 设定12 h周期条件下浮游植物群落的生理响应
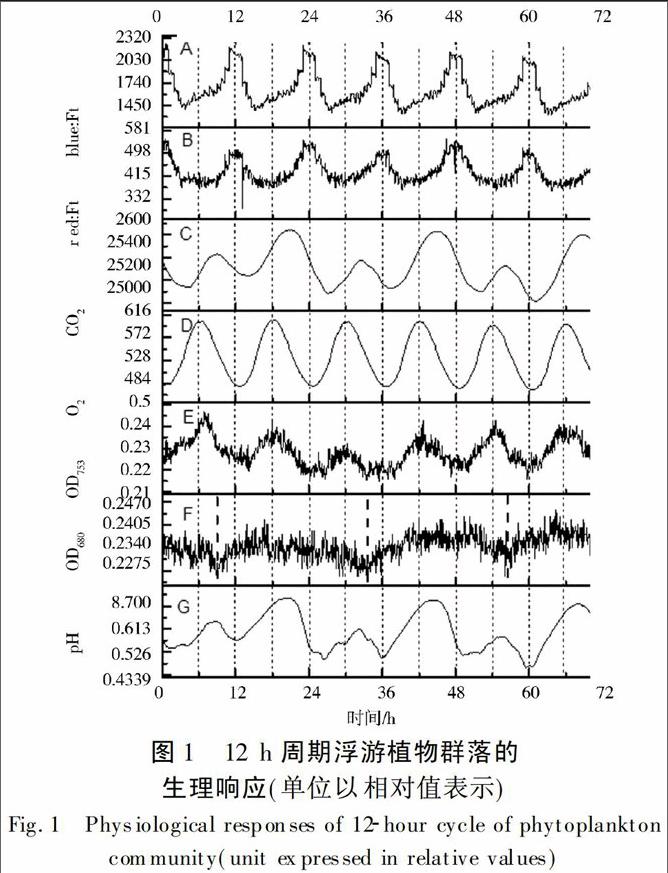
叶绿素荧光反映浮游植物的生理状态(图1A、图1B)。光强与从0 h到6 h处逐渐升高,然后从6 h到12 h逐渐下降,所以叶绿素荧光强度随光照、温度增强而减弱,随着光照、温度减弱而增强;氧气随光照强度增强而增强。对比两种叶绿素荧光,随着光强的增强,蓝色叶绿素荧光blueFt强度急剧降低,而红色叶绿素荧光redFt降低较为缓和,两者周期相同,表明在光强上升时浮游植物对蓝光有较强的光化学转化能力;而随着光强的增强,光化学反应降低幅度较快。
OD735与藻类的生物量成正比, OD680反映藻的散射,同时还反映叶绿素在680 nm的吸光度[13]。在12 h设定周期条件下,OD680出现24 h的周期变化(图1 F),OD735出现12 h周期变化。OD680周期性变化反映了藻密度的变化,可能是因为糖原颗粒的强散射[14-15]。粗虚线间隔约为24 h,表明藻生物量的变化存在着日周期(图1F)。两者出现周期性不同的原因可能是OD680对设定的光照与温度周期不敏感,只是反映了日周期,而OD735对设定的光照与温度周期敏感,因此随着设定的周期波动而波动。藻类生物量的变化遵循日周期变化,而所测得的OD735反映了叶绿素含量,表明叶绿素含量与设定光照周期一致。二氧化碳和酸碱度趋势类似,两者大小波峰相间出现,两个大波峰间的时间间隔为24 h,表明浮游植物群体存在日周期。此周期性是藻类在长期演进过程中形成的,并不随人为设定的周期而改变。
2.2 恒定光强恒定温度下培养浮游植物群落的生理响应
在进行长时间12 h周期性培养后,设定恒定光照和温度,叶绿素荧光依然表现出周期性;改变设定条件后,蓝色叶绿素荧光Ft表现出12 h的周期性质(见图2A),随后迅速形成24 h的周期性。这表明经过长期12 h的周期性驯化,藻类叶绿素可以形成短暂的12 h周期,随后迅速转化为24 h的日周期。荧光24 h周期性反映了藻类内在的生长周期,并不因外界条件的恒定而改变,其本质是由内部的基因系统决定的。这是因为,可变荧光只可能来自光系统Ⅱ[16],叶绿素荧光室温下的变化只反映光系统Ⅱ的光化学反应[17-18]。蓝光的周期性比较显著,而红光的周期性不显著,说明光系统Ⅱ对蓝光的吸收存在周期性,而对红光的吸收不显著。
如图2C中的二氧化碳和图2G中的pH显示24 h周期性,表明虽然温度和光照恒定,但是浮游植物以及水体中微生物的呼吸作用显示出日周期性。可见日周期是植物的内在性质,并不随外在条件的改变而改变。如图2E,OD735值的周期性不显著,图2F,OD680有两个不是十分显著的波谷,间隔约为30 h。图D,氧气浓度的周期性不显著,表明光合系统裂解水产生氧气的过程主要受光强的影响,而光合作用电子传递链相关的化学反应不影响PSⅡ锰簇裂解水,随后的化学反应中间产物不影响水的裂解及电子传递。
3 讨论
藻类光合系统吸收的光能转化途径有三个,一是通过光化学变化生成有机物,转化为化学能,二是产生热耗散转化为热能,三是转化为荧光,这三种途径是相互联系的:叶绿素荧光反映光合作用系统的化学合成的过程,可作为探针来研究植物的光合作用过程;光合作用化学能的转化过程伴随着水体中碳酸氢根的吸收,影响了水体的酸碱度及二氧化碳在水体中的含量;而OD680、OD735 反映了藻类的数量以及叶绿素含量,说明在生化反应过程中,叶绿素的含量呈现周期性的变动。
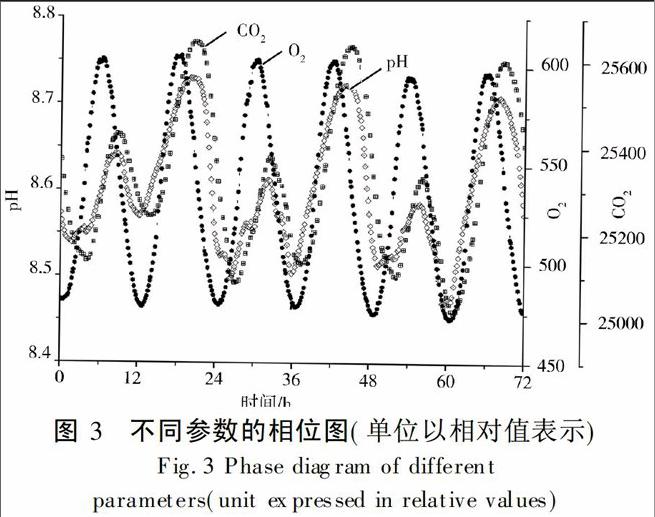
浮游植物生理参数随着设定条件显示出周期性,其中参数二氧化碳、OD680、pH均存在日周期,荧光的周期长度小于日周期。设定条件为12 h周期时,氧气、二氧化碳、pH、依次达到波峰(图3),二氧化碳和氧气浓度值并不随温度和光照强度同时达到最高点,而是有所滞后,表明藻类的生化过程时间顺序有先后。生成氧气的合成代谢影响着生成二氧化碳的分解代谢,在周期性光照的情况下,藻液的生理参数依次达到峰值。二氧化碳在呼吸作用中是生成物,在合成作用中是底物,二氧化碳以及pH的变化反映了藻类呼吸作用的周期性变化。由亨利定律知,水体中在6
藻类的叶绿素荧光周期与设定周期一致,而且在条件改变后依然延续原来的周期性,表明浮游植物种群存在群体效应[22]。浮游植物群落出现日周期表明日周期不只是在单个藻类之间存在,而且可以通过群体效应使浮游植物群体存在日周期。浮游植物群体出现了类似单一藻类的日周期,其原因可能是光合系统以及生化反应系统的统一进行导致的。每一种藻有其内在的生化反应系统,多种藻组合成一个生化反应系统,整个系统中有促成群体效应的效应子,结果多种浮游植物可以通过群体效应达到步调一致。因此,浮游植物的日周期是单种藻内在的日周期性和群体效应共同作用的结果。
在浅水湖泊中,在连续几天晴朗,温度适合,无风的天气容易爆发水华。这可能是这种条件下光照周期与藻类的日周期性一致,同时由于群体相应,以至于群体的日周期性和外界条件相一致,易导致藻类快速增殖。自然水体中光照由于云层的关系,温度和光照并不能总是与藻类的日周期完全重合,因此其周期性往往被多云、水体扰动等修饰,相对不容易发生水华。所以日周期性和外界条件变化的一致,以及在群体效应的作用下浮游植物生理产生“共振”容易导致水华发生。
4 结论
浮游植物群落具有日周期性,日周期是通过不同藻的内在基因以及群体效应实现的。
(1)设定12 h周期条件,叶绿素荧光、氧气、二氧化碳、OD735均呈现12 h周期性波动,但是OD680呈24 h周期性,表现为与设定周期不同的特征。
(2)在长时间的12 h周期条件下培养,转为恒定条件下培养,蓝色叶绿素荧光显示出12 h日周期,表明微生态系统受原设定条件的影响,表现为“惯性”;二氧化碳则显示出24 h日周期性。
(3)在恒定条件下浮游植物群落本应表现为恒定状态,实际上表现为周期性,是由于多种微生物通过群体效应等细胞通讯机制实现的。
参考文献(References):
[1] CHENG P,WANG J,LIU T.Effects of nitrogen source and nitrogen supply model on the growth and hydrocarbon accumulation of immobilized biofilm cultivation of B.braunii[J].Bioresource Technology,2014,166(0):527-33.
[2] GUERRERO-CABRERA L,RUEDA J A,GARC A-LOZANO H,et al.Cultivation of Monoraphidium sp.,Chlorella sp.and Scenedesmus sp.algae in Batch culture using Nile tilapia effluent[J].Bioresource Technology,2014,161(0):455-60.
[3] RANGA RAO A,RAVISHANKAR G A,SARADA R.Cultivation of green alga Botryococcus braunii in raceway,circular ponds under outdoor conditions and its growth,hydrocarbon production[J].Bioresource Technology,2012,123(0):528-33.
[4] AMSLER C D,NEUSHUL M.Diel periodicity of spore release from the kelp Nereocystis luetkeana (Mertens) Postels et Ruprecht[J].Journal of Experimental Marine Biology and Ecology,1990,134(2):117-27.
[5] KRAMER C L,PADY S M,CLARY R,et al.Diurnal periodicity in aeciospore release of certain rusts[J].Transactions of the British Mycological Society,1968,51(5):679-IN6.
[6] GOLDEN S S.Timekeeping in bacteria:the cyanobacterial circadian clock[J].Current Opinion in Microbiology,2003,6(6):535-40.
[7] BAGDE U S,RANGARI A K.Periodicity of coliform bacteria in an aquatic environment[J].Water Science and Technology,1999,40(7):151-7.
[8] EDMUNDS JR L N.Physiology of Circadian Rhythms in Micro-Organisms[M]//ROSE A H,TEMPEST D W.Advances in Microbial Physiology.Academic Press.1985:61-148.
[9] RAO M U,KALIAPERUMAL N.Diurnal periodicity of spore-shedding in some red algae of Visakhapatnam coast[J].Journal of Experimental Marine Biology and Ecology,1987,106(2):193-9.
[10] SOURNIA A.Circadian Periodicities in Natural Populations of Marine Phytoplankton[M]//FREDERICK S R,MAURICE Y.Advances in Marine Biology.Academic Press.1975:325-89.
[11] HOULIEZ E,LIZON F,LEFEBVRE S,et al.Phytoplankton photosynthetic activity dynamics in a temperate macrotidal ecosystem (the Strait of Dover,eastern English Channel):Time scales of variability and environmental control[J].Journal of Marine Systems,0):
[12] PARKER R A.Environmental periodicity and ecosystem stability[J].Ecological Modelling,1975,1(2):91-103.
[13] NEDBAL L,TRTILEK M,ERVEN J,et al.A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high‐content analysis of suspension dynamics[J].Biotechnology and bioengineering,2008,100(5):902-10.
[14] SCHNEEGURT M A,SHERMAN D M,NAYAR S,et al.Oscillating behavior of carbohydrate granule formation and dinitrogen fixation in the cyanobacterium Cyanothece sp.strain ATCC 51142[J].Journal of bacteriology,1994,176(6):1586-97.
[15] SHERMAN L A,MEUNIER P,COL N-L PEZ M S.Diurnal rhythms in metabolism:a day in the life of a unicellular,diazotrophic cyanobacterium[J].Photosynthesis research,1998,58(1):25-42.
[16] GOVINDJE E.Sixty-Three Years Since Kautsky:Chlorophyll <I>a</I> Fluorescence[J].Functional Plant Biology,1995,22(2):131-60.
[17] BOLH R-NORDENKAMPF H,QUIST G.Chlorophyll fluorescence as a tool in photosynthesis research[M].Photosynthesis and production in a changing environment.Springer.1993:193-206.
[18] SCHREIBER U,BILGER W.Rapid assessment of stress effects on plant leaves by chlorophyll fluorescence measurements[M]//TENHUNEN J,CATARINO F,LANGE O,et al.Plant Response to Stress.Springer Berlin Heidelberg.1987:27-53.
[19] ROENNEBERG T,MITTAG M.The circadian program of algae[J].Seminars in Cell & Developmental Biology,1996,7(6):753-63.
[20] BASSLER B L.Small Talk:Cell-to-Cell Communication in Bacteria[J].Cell,2002,109(4):421-4.
[21] ZHANG L-H.Quorum quenching and proactive host defense[J].Trends in Plant Science,2003,8(5):238-44.
[22] ZANG T,LEE B W K,CANNON L M,et al.A naturally occurring brominated furanone covalently modifies and inactivates LuxS[J].Bioorganic & Medicinal Chemistry Letters,2009,19(21):6200-4.
- 运用问题教学法,让高中英语课堂更高效
- 高中英语课堂提问的认知思维导向研究
- 微课趣味点亮,成就卓越新课堂
- 对高中英语课堂评价的有效性研究
- “五步合句法”巧解定语从句
- 中学英语教学中英汉文化差异问题的研究(1)
- 从语篇入手,提升学生逻辑思维能力
- 中学英语教学中英汉文化差异问题的研究
- 小学英语口语教学中的情景教学法应用
- 初中英语教学中口语表达能力培养分析
- 初中英语阅读教学策略探究
- 初中英语学生自学能力培养方法研究
- 中学英语教学中学生口语表达能力的培养分析
- 浅谈初中英语谚语习语的教学
- 英语阅读教学的有效性策略探讨
- 以学科核心素养为导向的初中英语阅读教学
- 论高中英语教学中合作学习的实施
- 试论如何提高高中英语教学效果
- 浅谈新目标英语教学中的人文教育
- 论如何开辟高中英语教学的新天地
- 分层教学法视角下的初中英语教学策略探讨
- 信息技术在高中英语教学中的应用初探
- 浅谈多媒体技术在高中英语教学中的运用
- 关于多媒体辅助教学在高中英语教学中应用的研究
- 农村初中英语高效课堂小组合作学习初探
- parers
- pares
- pare sth (back/down)
- paretoanalysis
- pareto aˌnalysis
- paretooptimal
- pareto's principle
- paretosprinciple
- par-for-course
- par for the course
- par-for-the-course
- paring
- parisclub
- paris club
- parish
- parish council
- parishes
- parishional
- parishioner
- parishioners
- parishionership
- parishionerships
- parisians
- parities
- parity
- 辩答
- 辩给
- 辩者,求服人心也,非屈人口也
- 辩舌
- 辩覆
- 辩解
- 辩解或推托的理由
- 辩解掩盖
- 辩解的话
- 辩解罪过
- 辩解诉说
- 辩言
- 辩议
- 辩论
- 辩论不同意见
- 辩论事理
- 辩论会
- 辩论清楚
- 辩论的根据
- 辩论诘难
- 辩论赛
- 辩论驳正
- 辩论,争论
- 辩讼
- 辩证