
摘 要:近年来,金属钼的广泛应用导致很多钼矿区水体中的钼含量超标严重,严重威胁人们的饮水安全。利用化学沉淀法进行水处理已有较为广泛的应用。这种方式具有适用范围广、处理效果好、可回收利用有用物质、吸附剂可重复利用等优点。本文对沉淀法去除水中重金属钼展开具体研究。
关键词:沉淀法;重金属;钼;去除方法
中图分类号:TU991.2文献标识码:A文章编号:1003-5168(2020)13-0130-03
Study on Removal of Heavy Metal Molybdenum
in Water by Precipitation Method
LIANG Yan
(Harqin Left Wing Mongolian Autonomous County Branch of Chaoyang City Ecological Environment Bureau,Chaoyang Liaoning 122300)
Abstract: In recent years, the widespread application of metallic molybdenum has led to serious molybdenum content in water bodies in many molybdenum mining areas, seriously threatening people's drinking water safety. The chemical precipitation method has been widely used in water treatment. This method has the advantages of wide application range, good treatment effect, recyclable useful substances, and reusable adsorbent. In this paper, a specific study on the removal of heavy metal molybdenum in water by precipitation was carried out.
Keywords: precipitation method;heavy metals;molybdenum;removal method
随着工业的发展,水污染成为人类生存和发展所面临的主要环境问题之一。其中,重金属如钼、铬、汞、铅、镍是对生物体危害极大且极难处理的一类重金属污染物。重金属污染有如下两个特点:主要通过食物进入人体,不易排泄,能在人体的一定部位积累,使人慢性中毒且极难治疗;可以通过生物、食物链富集,由极低浓度,经动植物食物链的放大作用,富集到较高浓度。因此,重金属污染受到广泛关注。
1 材料与方法
钼酸钙沉淀原理如下:化学沉淀法是使废水中呈溶解状态的重金属转变为不溶于水的重金属化合物的方法,向模拟废水钼酸铵中投加定量的氯化钙,使水中的钼酸根离子和钙离子结合生成钼酸钙沉淀。在微溶性铵盐类的饱和溶液中,在一定温度下,根据同离子效应,钼酸根离子和钙离子的浓度乘积超过钼酸钙的溶度积([Ksp]=1.46·10-8),它们就结合为钼酸钙沉淀。
2 试验步骤
2.1 钼标准曲线的绘制
2.1.1 钼标准储备液的配制。称取0.150 g在105 ℃干燥至恒重的三氧化钼并将其置于50 mL烧杯中,加入5~10粒固体氢氧化钠及10 mL纯水,搅拌至其全部溶解,将溶液移入1 000 mL容量瓶中,用纯水定容。
2.1.2 钼标准使用溶液。吸取钼标准储备溶液5.00 mL并将其置于500 mL容量瓶中,用纯水定容。此溶液1.00 mL含1 μg钼。吸取此溶液5.00 mL并将其置于500 mL容量瓶中,纯水定容。此溶液1.00 mL含0.01 μg钼。
2.1.3 试剂配比。一是硫酸溶液(2+1)。50 mL硫酸([ρ]=1.84 g/mL)在不断搅拌下緩缓加入100 mL纯水中,冷却至室温。二是酒石酸钾钠(500 g/L)。取250 g酒石酸钾钠溶于纯水中,稀释至500 mL。三是氯化亚锡溶液(200 g/L)。取20 g氯化亚锡溶于少量盐酸([ρ]=1.19 g/mL),用纯水稀释至100 mL,用时现配。四是硫氰酸钾溶液(100 g/L)。取50 g硫氰酸钾溶于纯水中,稀释至500 mL。五是异戊醇-四氯化碳混合溶液(1+1)。戊醇与四氯化碳等体积混合。
2.1.4 标准曲线绘制。吸取0.00、0.25、0.50、1.00、2.00、4.00、6.00、8.00 mL钼标准溶液并将其置于一系列100 mL分液漏斗中,补加纯水至50 mL,分别加入2.0 mL硫酸溶液、1.0 mL酒石酸钾钠溶液,摇匀,加入1.0 mL氯化亚锡溶液,摇匀,放置片刻。再加入2.0 mL硫氰酸钾溶液,混匀后放置2 min。再向溶液中加入1.50 mL异戊醇-四氯化碳混合溶液,充分振荡30 s,放置分层后,将有机相移入10 mL比色管中(为防止有机溶剂的挥发,上层可保留少量水溶液)。在465 nm波长处,用1 cm比色皿,以试剂空白作参比测量吸光度。
根据表1数据,以分液漏斗钼的含量[m]为横坐标,吸光度[A]为纵坐标绘制钼标准曲线,如图1所示。
由钼标准曲线可得,其函数方程为:
y=0.059 6x-0.010 3? ? ? ? ? ? ? ? ? ?(1)
式中,[x]为经空白校正后的吸光度;[y]为钼的质量,μg。
水样中钼的质量浓度计算公式为:
ρMo=m/v? ? ? ? ? ? ? ? ? ? ? ? ? (2)
式中,ρMo为水样中钼的质量浓度,mg/L;[m]为从标准曲线上查得的分液漏斗中钼的含量,μg;[v]为所取水样的体积,mL。
2.2 模拟含钼废水的配制
试验根据计算配制一定浓度的钼酸铵溶液,作为模拟的含钼废水。
2.3 钼酸钙沉淀试验
根据化学方程式自行配置钼酸钙溶液,将其作为试验模拟的废水。
2.3.1 pH值对沉淀效果的影响。在试验温度、溶液浓度都一定的条件下,改变样品不同的pH值,分别取pH为1、4、7、10、13为研究条件。
2.3.2 温度对沉淀效果的影响。溶液的pH和浓度保持固定,逐渐改变试验反应的温度,进而研究试验效果。试验温度分别设为50、60、70、80、90 ℃。
2.3.3 溶液浓度对沉淀效果的影响。溶液的pH和反应温度一定,分别对不同浓度的废水进行研究。改变铁胶体的加入量,分别为22.281 8、18.281 8、14.281 8、10.281 8、6.281 8 g。
2.3.4 反应时间对沉淀效果的影响。在pH、温度、浓度确定的条件下改变试验的反应时间,考察试验的动力学结果。反应时间分别设为5、30、60、120、180 min。
3 结果与讨论
3.1 pH对钼酸钙沉淀的影响
自行配制浓度为0.22 g/mL的含钼废水,氯化钙加入2.318 3 g。调整不同的pH,在80 ℃的试验温度下反应大约20 min。溶液中生成钼酸钙沉淀,过滤稀释后得待测溶液。
在温度和钼浓度含量一定,pH=1的情况下,钼酸钙的去除率可达89.75%;当pH=4时,去除率为85.75%,曲线总体上变化不大,趋于平缓;当pH=7时,钼酸钙的去除率降低到67.99%,曲线呈现下降趋势。当pH=10时,钼酸钙的去除率为75.02%;当pH=13时,钼酸钙的去除率为83.20%,曲线又呈现上升趋势。总体来看,钼酸钙沉淀试验中,pH为酸性和碱性时,去除率均较高,在中性的条件下,去除率最低。pH=4时去除率最高。可见,pH=4是钼酸钙沉淀的最佳酸碱度值。整个趋势线呈抛物线形状。
3.2 温度对钼酸钙沉淀的影响
自行配制5份钼酸铵浓度为0.06 g/mL的模拟含钼废水,分别向其投加2.318 3 g相同质量的氯化钙,在pH=4的条件下依次改变温度,观察沉淀效果,过滤掉钼酸钙沉淀物。
钼酸钙沉淀试验中,当反应温度[T]=50 ℃时,去除率为35.55%;当温度升高为60 ℃时,去除率升高为51.93%;再把温度升高10 ℃时,钼酸钙的去除率升高到78.25%;温度为80 ℃时去除率升至88.43 ℃;而温度为90 ℃时去除率略降至87.19 %;而在室温的条件下去除率不到10%,基本上不会生成或极少生成钼酸钙沉淀;如果反应温度继续增加到大于90 ℃,那么钼酸钙的去除率会减少,曲线会总体下降,呈抛物线形状[1]。总体分析来看,反应温度对钼酸钙沉淀试验有很大的影响,随着温度的升高,钼的去除率升高,在室温的条件下也有反应发生但是反应缓慢,沉淀微量。在80 ℃的温度下,钼酸钙的去除效率最高,其他温度下亦有沉淀效果,但是去除率很低。根据公式[ΔG=ΔH-TΔS]计算得出,钼酸钙的吉布斯函数为[ΔG]=-9 104.195<0,表明反应正向进行,能够产生沉淀,化学反应式为:
Ca2++MoO42-→CaMoO4↓? ? ? ? ? ? ? ? ? ? ? ? ? ?(3)
3.3 浓度对钼酸钙沉淀的影响
自行配制5份钼酸铵浓度为0.22、0.18、0.14、0.10、0.06 g/mL的模拟含钼废水。分别向其投加2.318 3 g相同量的氯化钙。在pH=4、温度为80 ℃的试验条件下,含钼废水的浓度保持一定,改变钼酸铵的加入量,总体曲线趋势发生变化。根据化学方程式的计算,当添加22.281 8 g的钼酸铵时,去除率为80.99%;减少钼酸铵的加入量,即添加18.281 8 g钼酸铵时,去除率降至79.16%;当钼酸铵加入14.281 8 g时,钼酸钙的去除率又降为76.31%;当添加的钼酸铵为10.281 8 g时,去除率为72.26%;添加最少量(6.281 8 g)的钼酸铵时,钼酸钙的去除率下降至34.30%。从总体趋势分析可知,随着含钼废水初始浓度的增大,去除率有所上升,当含钼废水中的钼酸铵和添加的氯化钙的质量比为11∶1时,去除率最高,比例为3∶1时,去除率最低。
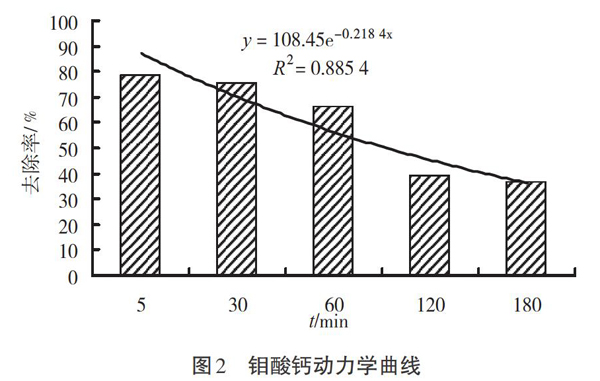
3.4 钼酸钙动力学分析
自行配制5份钼酸铵浓度为0.06 g/mL的模拟含钼废水,均添加2.318 3 g的氯化钙,在反应温度[T]=80 ℃、pH=4的條件下,控制反应时间分别为5、30、60、120、180 min。试验数据分析结果如图2所示。
图2分析结果显示,当反应时间控制在5 min左右时,去除率较高,为78.59%;当反应时间增加到30 min时,去除率为75.66%,较5 min时的去除率略微下降,无明显变化;反应时间增加为60 min时,去除率降为66.19%;反应时间为120 min时去除率为39.44%;反应时间增大到最大值180 min时,去除率则降为36.53%。从总体来看,反应时间和钼酸钙的去除率成反比,即反应时间越长,钼酸钙的去除率越低,反应就越不完全。根据反应的动力学公式,人们还能计算出不同反应时间钼酸钙的去除率。
3.5 钼酸钙沉淀法最佳工艺
在酸性和碱性的条件下,钼酸钙的沉淀效果不同,pH=7时的中性条件不利于沉淀的发生;反应温度为70~90 ℃时的去除沉淀率较高,其中80 ℃时的去除率最高可达80%;含钼废水的初始浓度越高,去除率越大。综合来看,其最佳的反应条件为:反应浓度比为11∶1,反应时间为5~30 min,pH=1,反应温度为80~90 ℃,去除率可达90%。
4 结论
本试验以含钼废水为研究对象,采用钼酸钙沉淀法来处理含钼废水,控制每个试验的影响因素,并且依次改变影响因素,通过一系列试验和数据分析得出以下结论。对于钼酸钙沉淀试验来说,酸性或碱性的条件下沉淀效果最佳,去除率可达80%;中性条件下沉底去除效果不好,去除率仅为67.99%;80~90 ℃时钼酸钙沉淀效果最好,去除率为88.43%;初始浓度越大,去除效率越高,最好的去除率为80.99%。
参考文献:
[1]姜瑞雪,王龙,张丽.强化混凝在微污染水源水处理中的应用[J].水资源保护,2006(5):68-70.
收稿日期:2020-04-19
作者简介:梁艳(1986—),女,本科,工程师,研究方向:生态环境建设、环保法律法规、环境监测管理。
- 兴国:易地搬迀解民忧 幅幅春联颂党恩
- 科技种菇助农增收
- 贫困群众的笑容是冬日里最暖的风景线
- 社区治理对生态移民收入恢复的影响研究
- 引入私募股权投资对中小科技企业产生的影响
- 新时代赣商工匠精神弘扬的路径研究
- 地方政府税收优惠承诺的效力探析
- 客家女性在苏区文艺中的作用和地位
- 城市形象与城市旅游竞争力研究述评
- 乡村振兴背景下农村垃圾治理研究
- 基于“反规划”视角下的乡村旅游规划理论研究
- 文化和旅游部、国务院扶贫办大力推进非遗扶贫就业工坊建设
- 春风送真情 就业暖民心
- 聚焦脱贫攻坚 展示奋进中国
- 2019年中央单位定点扶贫分类评价工作正式启动
- 高质量脱贫攻坚作示范
- 农家妇女苏秀华的脱贫故事
- 最美是初心 静待花竞放
- 智慧改变命运,勤劳创造辉煌
- 产业来造血 党员创先锋
- 乡村振兴引领新时代农业农村发展
- 双线申报 三方审核 双线告知
- 凝心聚力向幸福出发
- 脱贫感党恩 扶贫暖人心
- 一名转业军人的乡情乡音
- squiralty
- squire
- squired
- squiredom, squirehood, squireship
- squireless
- squirelike
- squires
- squiret
- squiring
- squirism
- squirm
- squirmed
- squirmer
- squirmers
- squirmier
- squirmiest
- squirming
- squirmingly
- squirms
- squirmy
- squirocracy
- squirrel
- squirreled
- squirreling
- squirrelish
- 示纪形容词
- 示范
- 示范户
- 示范方法
- 示范朗读
- 示范田
- 示范,作为榜样
- 示號
- 示覆
- 示警
- 示训
- 示诚
- 示诲
- 示谕
- 示象形容词
- 示贬于褒
- 示踪元素
- 示 部
- 示重
- 礼
- 礼下于人,必有所求
- 礼下于人,必有所求。
- 礼不亲授
- 礼不可缺
- 礼中