海蜇病原菌轮虫弧菌的分离及鉴定
高杨

摘 要:海蜇生长阶段分为螅状体、碟状体、水母体三个阶段。海蜇溃烂病主要发生在水母体阶段。从伞部凹陷、溃烂的海蜇(Rhopilema esculentum Kishinouye)体内分离到3株优势菌株DS2020072901、DS2020072902、DS2020072903。通过全自动细菌分析仪及16S rDNA基因序列同源性分析鉴定,分别为溶藻弧菌、副溶血弧菌、轮虫弧菌(Vibrio rotiferianus)。其中轮虫弧菌为首次在患病海蜇中分离得到,初步判定为致病菌。人工感染试验确定了海蜇溃烂病的病原菌为轮虫弧菌。药敏分析结果显示,该菌株对氟苯尼考、多西环素、恩诺杀星、诺氟沙星、氧氟沙星、环丙沙星等抗生素敏感。
关键词:海蜇(Rhopilema esculentum Kishinouye);轮虫弧菌(Vibrio rotiferianus);药敏试验
海蜇(Rhopilema esculentum Kishinouye)是海水立体生态养殖模式中重要的养殖生物,具有较高的营养价值和药用价值。随着养殖环境的恶化,近年来海蜇病害日益严重,疾病成为制约海蜇养殖健康发展的关键因素[1]。海蜇易发生的病害有气泡病、长脖、平头、萎缩、头部溃烂、烂边、鲺病、小虾附着等[1-4]。轮虫弧菌作为水产养殖病害新发病原[5],可引起青蟹幼体、半滑舌鳎、许氏平鲉等养殖品种的皮肤溃疡症。作者通过对丹东东港市某立体养殖池患病的海蜇伞体部和口腕部进行细菌分离与鉴定, 16s rDNA序列分析,感染试验和药敏试验,分析影响海蜇生长和病害发生的原因,为海蜇的健康养殖提供理论参考。
1 材料与方法
1.1 试验材料
2020年7月29日,东港市某立体养殖池海蜇出现伞部凹陷、溃烂等症状(见封三,图1)。患病海蜇伞盖下充满棕黄色黏液,游动缓慢,紧贴池边游动,顶网,影响生长。
1.2 试验方法
1.2.1 肉眼检查及剖检 将患病海蜇通过肉眼观察体表症状,解剖伞体部和口腕部,对胃腔、中胶层和口柱进行镜检,并记录。
1.2.2 细菌分离 在无菌条件下,用接种环穿刺挑取海蜇的胃腔、中胶层和口柱, 用接种环接种于2216E琼脂海水培养基和硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(TCBS)培养基上[1],划线分离,28 ℃恒温培养箱培养24 h,挑取优势菌的单菌落,在胰酪大豆胨琼脂培养基(TSA)平板上纯化培养。将纯化后的分离株在常温和低温(-80 ℃)下保种。
1.2.3 细菌鉴定
1.2.3.1 分子生物學鉴定 对分离菌株进行常规16s rDNA基因序列鉴定,将得到的产物送至上海生工生物工程有限公司进行测序。将测序结果在NCBI网站上进行BLAST比对。选取同源性较高的序列,采用 Clustal X 1.83软件进行多重序列比对分析,并通过MEGA 6软件采用邻接法构建系统发育树。
1.2.3.2 生化鉴定 采用法国生物梅里埃公司生产的微生物自动分析系统进行生化特征分析。
1.2.4 人工感染试验 试验用海蜇为东港地区某立体养殖池健康海蜇10尾,体重400~500 g,暂养于四个200 L水族箱中,温度控制在18 ℃,充气增氧。试验组与对照组各10 L水体分别放入3尾海蜇,采用浸泡感染方法,每组采用致病菌的菌悬液浓度约107cfu/mL,对照组加入同等体积培养基。观察记录发病症状及死亡情况。
1.2.5 药敏试验 对所分离并经鉴定的致病菌株,采用琼脂扩散纸片法(K-B)进行对常用抗菌类药物的敏感性测定。
2 结果与分析
2.1 菌株形态特征
在海蜇的胃腔和口柱内分离获得3株优势菌,分别编号为DS2020072901、DS2020072902和DS2020072903。菌落呈淡黄色、圆形、湿润;表面光滑、不透明;菌落直径1.5~2 mm,其中DS2020072901菌落形状呈弥散型。革兰氏染色后在显微镜下观察均为革兰氏阴性菌。
2.2 菌株的生理、生化鉴定
由全自动细菌分析仪对病原菌的生理生化检测结果可知,3株菌初步鉴定为弧菌属细菌。
2.3 菌株16s rDNA基因序列分析及致病菌株系统发育树的构建
将分离菌所扩增的16s rDNA基因序列进行BLAST比对结果显示,从胃腔和口柱内分离出的菌株 DS2020072901、DS2020072902和DS2020072903分别为溶藻弧菌、副溶血弧菌和轮虫弧菌。由于溶藻弧菌和副溶血弧菌在健康海蜇上均分离得到过,因此初步判断轮虫弧菌为该病的致病菌。从胃腔和口柱内分离出的菌株DS2020072903的基因与轮虫弧菌(Vibrio rotiferianus)相应基因的相似率达99%。将致病菌所扩增的16s rDNA基因序列提交到GenBank,获得序列号为MW990094,所构建的系统发育树见图2,致病菌株与轮虫弧菌聚为一支。
2.4 人工感染试验
试验组的5尾海蜇感染后的4~5 d死亡2尾,发病3尾,解剖观察,对发病海蜇进行细菌分离与鉴定,结果与原致病菌一致 。
2.5 药敏试验
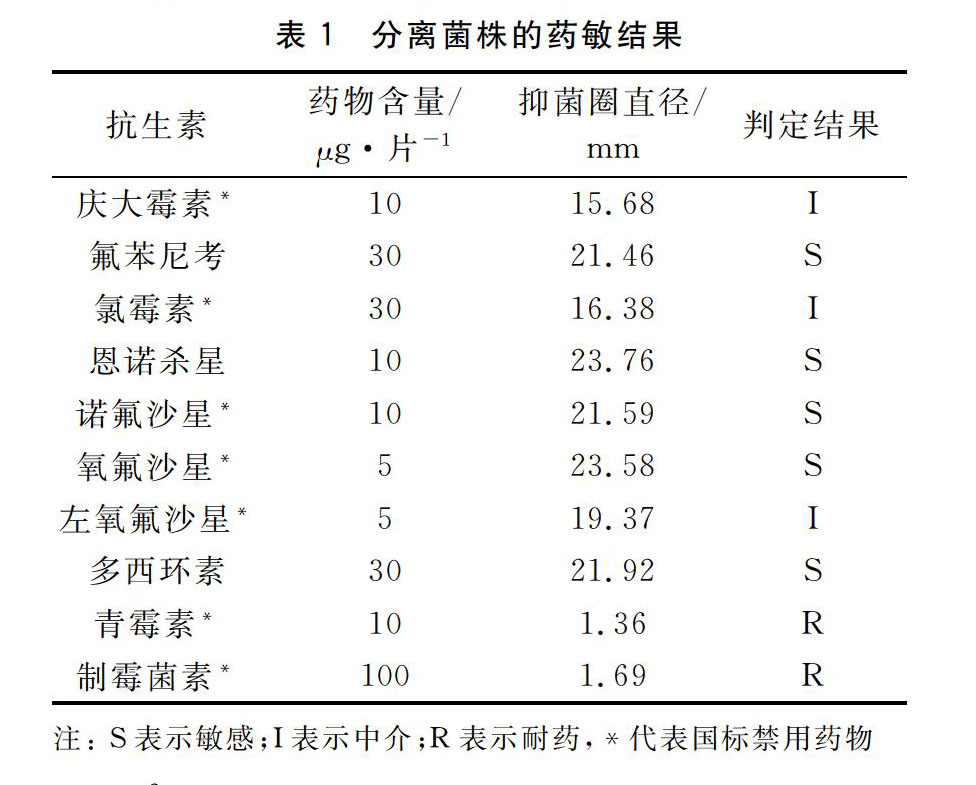
药敏试验结果显示,该菌株DS2020072903对氟苯尼考、多西环素、恩诺杀星、诺氟沙星、氧氟沙星、环丙沙星等抗生素敏感,对青霉素、制霉菌素耐药(表1)。不同菌株间耐药差异不明显。
3 讨论
本文首次报道引起海蜇头部溃烂病的病原菌为轮虫弧菌。轮虫弧菌是引起鱼类溃烂病的主要病原[6-8]。药敏试验表明该致病菌对氟苯尼考、沙星类抗生素等敏感,对其他抗生素敏感度低。本试验采用16s rDNA鉴定分离的基因序列,在系统进化树中与轮虫弧菌[10-11]聚为一支,相似度>99%。海蜇疾病相关报道较少,而微生态制剂对于弧菌的抑制作用是较为显著的[12-15]。芽孢杆菌、蛭弧菌等益生菌作为抗生素的替代品,能有效抑制病原菌,具有提高养殖动物的免疫力,改善水质及生态环境的作用。
参考文献:
[1]
郑斌,邹绍林,姚洪,等.池塘养殖海蜇疾病的病因分析[J].中国水产,2016(4):82-87.
[2] 王會芳,刘开黎,盖永强.海蜇养殖存在的问题及发展建议[J].中国水产,2013(11):73-74.
[3] 于天飞,张刚.海蜇养殖池塘中弧菌病的防治[J].科学养鱼,2020(7):45-45.
[4] 杨辉,任福海,李志刚.海蜇养殖的病害防治技术[J].河北渔业,2010(9):24-25.
[5] 陈京,于永翔,张正,等.基于toxR基因的轮虫弧菌荧光定量微流控快速检测技术的建立[J].水产学报,2020,44(12):2066-2075.
[6] 陈政强,姚志贤,林茂,等.半滑舌鳎病原菌轮虫弧茵(Vibrio rotiferianus)的分离与鉴定[J].生物技术通报,2012(6):147-153.
[7] 王凯,王印庚,姜勇,等.一株感染深水网箱养殖许氏平鲉的病原菌分离与鉴定[J].渔业科学进展,2019,40(1):119-126.
[8] 杨求华,郑乐云,黄种持,等.线纹海马尾部溃烂症病原轮虫弧菌的分离鉴定及特性分析[J].中国水产科学,2017,24(5):1131-1140.
[9] 金春英.南美白对虾弧菌病病原的分离和鉴定[J].海洋环境科学,2013,32(5):647-651.
[10] 简纪常,吴灶和,陈刚,等.海水网箱养殖军曹鱼弧菌病病原的分离及其特性[J].中国兽医学报,2003,23(4):329-330.
[11] 李军,徐怀恕.中国对虾幼体病菌哈维氏弧菌的分离及其生物学特性研究[J].海洋与湖沼,1998,29(4):353-361.
[12] 肖国华,高晓田,赵振良,等.一种复合微生态制剂对养殖水体中生物因子的影响[J].微生物学通报,2013,40(7):1154-1162.
[13] 王亚维.微生态制剂对中国对虾养殖池塘底质改良效果的探讨[J].河北渔业,2015(6):12-13.
[14] 黄冬菊,林红华,白泉阳.噬菌蛭弧菌微生态制剂对海水中弧菌的净化作用[J].福建畜牧兽医,2002,24(5):4-4.
[15] 刘晓燕,王玲玲,栾会妮,等.一株枯草芽孢杆菌的分离鉴定、生物学特性及其对水质净化的作用[J].微生物学通报,2021,48(2):449-461.
(收稿日期:2021-04-23)

