镉胁迫对凡纳滨对虾血细胞基因表达的影响
张秀霞 汪蕾 张泽龙 李军涛 王冬梅 冼健安
摘要:为探讨镉(Cd)胁迫下凡纳滨对虾(Litopenaeus vannamei)血细胞的分子响应,以不同浓度的Cd2+(0,0.5 mg/L和5 mg/L)进行胁迫,于不同胁迫时间取血淋巴,测定血细胞中Trx 2、Grx 2、Grx 3和MGST 3的基因表达量变化。结果显示,Trx 2、Grx 3和MGST 3表达量在胁迫的中后期显著上调,Grx 2表达量在5 mg/L Cd2+胁迫6 h开始即有显著的升高,并持续至48 h。结果表明在Cd胁迫作用下,对虾血细胞中上调这四个氧化还原与抗氧化相关基因的表达水平,以进行胁迫防御;Grx 2对Cd胁迫较为敏感,在整个胁迫过程发挥作用,Trx 2、Grx 3和MGST 3主要在胁迫的中后期发挥作用;基因的表达响应具有一定浓度效应。
关键词:凡纳滨对虾(Litopenaeus vannamei);镉;血细胞;基因表达
中图分类号:X503.225
重金属是造成自然水体环境破坏的一类主要污染物。镉(Cd)是其中主要的重金属元素,对水生动物的毒性极大,且能够富集在水生动物体内,通过食物链而毒害人类自身[1]。近年的调查结果显示,海南岛近岸海域沉积物中Cd含量较高,存在较高的潜在生态风险。海南岛东部陆架表层沉积物中Cd在个别站位达到了中等潜在生态危害水平[2]。花场湾表层沉积物中Cd含量范围为0.12~0.76 mg/kg,在七种重金属中潜在生态风险最高[3]。清澜港红树林湿地沉积物中,包括Cd在内的四种重金属的生物有效态含量较高,具有较高的释放风险[4]。陵水新村港近海区域海水中Cd范围分别为0~0.58 μg/L,表层沉积物Cd含量为0.175 mg/kg,潜在生态风险属于中等水平,危害大小仅次于Hg[5]。
凡纳滨对虾(Litopenaeus vannamei)是海南乃至全国主养的虾类,水体环境中的Cd污染对虾类养殖及人体健康存在较大的风险。前期的研究结果显示Cd胁迫会造成虾类血细胞产生氧化脅迫从而诱导血细胞凋亡[6],本研究选取四种重要的氧化还原与抗氧化相关基因,分析这些基因在Cd胁迫过程中的分子响应,初步探讨这些基因在应对Cd胁迫的防御机制中的作用,以期为虾类的健康养殖提供一定的理论依据。
1材料和方法
1.1试验材料
试验用凡纳滨对虾体重7~10 g,在实验室环境条件下(盐度20‰,pH值7.8~8.0,温度22~24 ℃,一直保持曝气并进行循环过滤)进行驯养,驯养一周后,选取无病患且处于蜕皮间期的对虾进行胁迫试验。
1.2镉胁迫试验
以CdCl2·2.5H2O作为Cd2+来源,按照《中华人民共和国渔业水质标准》中镉标准浓度(Cd2+<0.005 mg/L),设置2个Cd2+胁迫浓度组(0.5 mg/L和5 mg/L),不添加Cd2+作为对照组。试验在塑料箱中进行,每箱放水40 L,放养对虾20尾,每组3个平行。试验期间不投喂,保持曝气,水体盐度20‰,pH值 7.8~8.0,水温22~24 ℃。
1.3总RNA提取
于胁迫的0,6,12,24和48 h进行取样,每个时间点每组取9尾。用2.5 mL一次性注射器吸取300 μL预冷的抗凝剂(葡萄糖20.5 g/L,柠檬酸钠8 g/L,氯化钠4.2 g/L,pH值7.5),从对虾的腹血窦抽取血淋巴,在800×g、4 ℃条件下离心10 min,弃上清后沉淀即为血细胞,用于总RNA的提取。应用Trizol 法提取血细胞总RNA,取2 μL利用NanoDrop 2000分光光度计(Thermo Scientific,USA)测定RNA浓度和纯度,并以1%的琼脂糖凝胶电泳检测完整性。
1.4cDNA合成
应用PrimeScriptTM RT reagent Kit With gDNA Eraser试剂盒(TaKaRa)进行反转录合成cDNA,根据RNA浓度用DEPC水进行稀释,在10 μL的反转录体系中加入500 ng RNA作为反转录模板,按照说明书步骤进行操作。cDNA样本-20 ℃保存备用。
1.5表达定量分析
根据本研究组克隆的cDNA序列,分别设计荧光定量PCR引物(表1)。荧光定量PCR实验使用SYBR Premix Ex TaqTM试剂盒(TaKaRa),试验步骤按照说明书进行,每个样品做3个重复。以β-actin作为内参,根据目的基因和β-actin的Ct值用2-ΔΔCt法计算目的基因mRNA的相对表达量。
1.6统计分析
结果显示为平均值 ± 标准差(Mean ± SD),试验数据利用SPSS 19.0进行单因素方差分析(One-Way ANVOA),P<0.05表示差异显著。
2结果
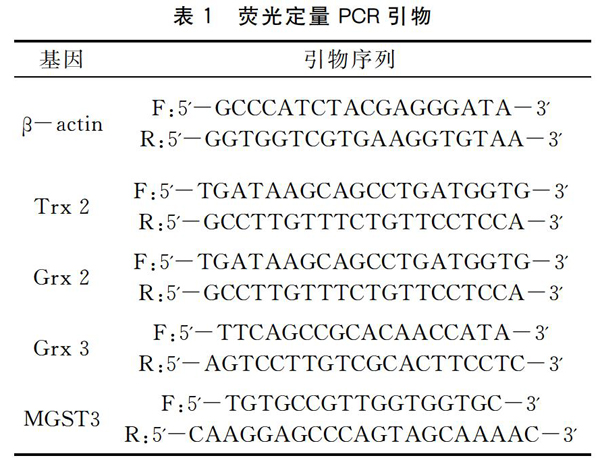
2.1Cd胁迫对Trx 2基因表达量的影响
Cd胁迫下对虾血细胞Trx 2表达量变化如图1所示。当Cd胁迫浓度为0.5 mg/L时,Trx 2表达量在胁迫的24 h和48 h显著上调(P<0.05);在24 h时达到峰值,约为对照组6.0倍。当Cd胁迫浓度为5 mg/L时,Trx 2表达量在胁迫的6 h开始显著提高(P<0.05);在24 h时达到峰值,约为对照组9.4倍,显著高于对照组和0.5 mg/L胁迫组(P<0.05);在48 h时下降,但仍显著高于对照组和0.5 mg/L胁迫组(P<0.05)。
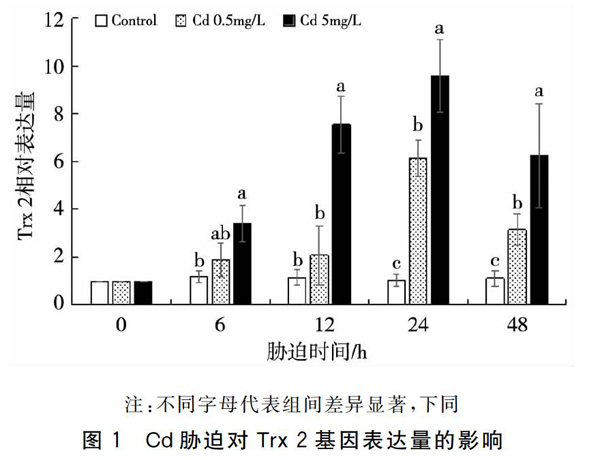
2.2Cd胁迫对Grx 2基因表达量的影响
Cd胁迫下对虾血细胞Grx 2表达量变化如图2所示。当Cd胁迫浓度为0.5 mg/L时,Grx 2表达量在胁迫的12 h开始显著上调(P<0.05);在24 h时达到峰值,约为对照组3.1倍。当Cd胁迫浓度为5 mg/L时,Grx 2表达量在胁迫的6 h开始显著提高(P<0.05);在12 h时达到峰值,约为对照组4.9倍,显著高于对照组和0.5 mg/L胁迫组(P<0.05);在24 h和48 h时,0.5 mg/L胁迫组和5 mg/L胁迫组之间没有显著差异(P>0.05)。
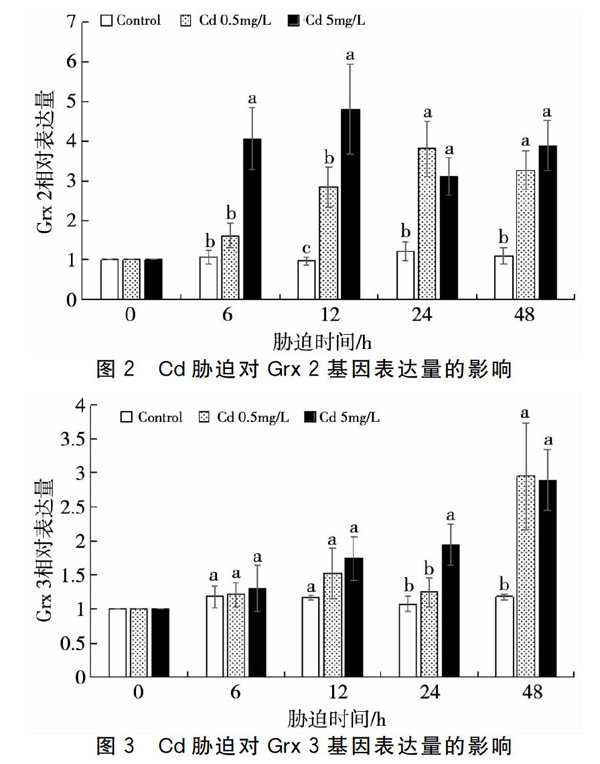
2.3Cd胁迫对Grx 3基因表达量的影响
Cd胁迫下对虾血细胞Grx 3表达量变化如图3所示。当Cd胁迫浓度为0.5 mg/L时,Grx 3表达量在胁迫的48 h显著上调(P<0.05),约为对照組的2.5倍。当Cd胁迫浓度为5 mg/L时,Grx 3表达量在胁迫的24 h和48 h有显著提高(P<0.05),在48 h时达到峰值,约为对照组2.4倍,与0.5 mg/L胁迫组没有显著差异(P>0.05)。
2.4Cd胁迫对MGST 3基因表达量的影响
Cd胁迫下对虾血细胞MGST 3表达量变化如图4所示。当Cd胁迫浓度为0.5 mg/L时,MGST 3表达量在胁迫的12 h显著上调(P<0.05),在24 h有所下降(P>0.05),在48 h再次上升(P<0.05)。当Cd胁迫浓度为5 mg/L时,MGST 3表达量在胁迫的12 h开始有显著上调(P<0.05),在24 h时达到峰值,约为对照组4.4倍,并且显著高于0.5 mg/L胁迫组(P<0.05)。
3讨论
以往的研究显示Cd胁迫对虾类血细胞产生细胞毒性影响,当Cd达到一定浓度时,可诱导虾类血细胞ROS的大量产生,造成血细胞的氧化损伤,从而诱导血细胞的凋亡和数量下降[6-8]。在甲壳动物的鳃、肝胰腺等其它组织中,Cd胁迫也有产生氧化胁迫继而造成损伤和凋亡的毒性机制。Cd胁迫作用会造成凡纳滨对虾肝胰腺的DNA损伤[7]。河南华溪蟹(Sinopotamon henanense)在Cd胁迫作用下,鳃组织产生大量H2O2,继而激发了鳃组织的凋亡过程[9]。在生理生化水平发现,在Cd胁迫作用下,一些抗氧化酶的活力产生了显著的响应。Cd胁迫对河南华溪蟹鳃和肝胰腺的超氧化物歧化酶(SOD)同工酶活力具有激活作用,但对过氧化物酶(POD)具有抑制作用[10]。长江华溪蟹(Sinopotamon yangtsekiense)在Cd胁迫下,肝胰腺的SOD、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)均呈现先升高后下降的趋势[11]。Cd(10 mg/L)胁迫状态下克氏原螯虾(Procambarus clarkii)肝胰腺和触角腺中的SOD和CAT活力先被激活后被抑制[12]。这些研究结果表明在Cd胁迫作用下甲壳动物机体通过调节抗氧化系统进行抗氧化防御。
本研究针对四个氧化还原与抗氧化相关基因,研究它们在Cd胁迫作用下的分子响应。Trx和Grx是机体内重要氧化还原系统(Trx系统和Grx系统)的核心组成部分,是蛋白质的二硫键还原酶,在机体蛋白质的氧化还原保护过程中起着重要作用[13]。结果显示,Trx 2、Grx 2和Grx 3三个基因对Cd胁迫呈现了不同的表达响应模式。Trx 2的表达量随着胁迫时间的延长,呈现逐渐升高的趋势,表明其主要在胁迫后期发挥作用;Grx 2的表达量在胁迫的6 h即有显著上调,后期的表达量基本保持在这一水平,表明Grx 2对Cd胁迫较为敏感,并可能在整个Cd胁迫过程中均发挥重要保护作用;Grx 3的表达响应较迟缓,在胁迫后期才有显著上调,表明Grx 3可能在胁迫后期参与针对Cd胁迫保护作用。从相对表达量峰值来看,Trx 2的最高值可达到对照组的9.4倍,Grx 2和Grx 3分别为对照组的4.9倍和2.4倍,也表明了Trx 2和Grx 2在应对Cd胁迫的防御中发挥更为重要的作用。Grx 2最为敏感,且响应整个胁迫过程,Trx 2则在胁迫后期有较高的表达响应,Trx 2和Grx 2在应对Cd胁迫的防御中可能存在一定的协同作用。
谷胱甘肽硫转移酶(GST)在细胞解毒、内外源性脂类新陈代谢、抗氧化等过程中发挥着极其重要的生物学作用。根据分布位置不同,GST可分为三类,包括胞质GST、线粒体GST和微粒体GST(Microsomal GST,MGST)[14]。本研究分析了MGST 3对Cd胁迫的分子响应,结果显示MGST 3的表达响应模式与Trx 2相似,随着胁迫时间的延长,呈现逐渐升高的趋势,表明MGST 3主要在Cd胁迫的后期发挥作用。此外,四个基因对Cd胁迫的表达响应也存在一定的浓度效应,Cd浓度较高时,基因表达响应更为敏感,且变化程度更为剧烈。
本研究结果显示,在Cd胁迫作用下,四个氧化还原与抗氧化相关基因均呈现了不同程度的表达量上调,表明凡纳滨对虾血细胞通过上调这些功能基因的表达水平作出应对Cd胁迫的防御响应。四个基因对Cd胁迫表现出不同的表达响应模式,在应对Cd胁迫的防御过程中可能存在一定的协同作用。
参考文献:
[1] 李玲,吴方舟,梁金荣,等.镉在虾蟹中的生物富集和毒性效应的研究进展[J].水产学杂志,2020,33(6):74-79.
[2] 徐方建,闫慧梅,田旭,等.海南岛东部陆架表层沉积物重金属污染评价[J].中国环境科学,2016,36(5):1530-1539.
[3] 陈石泉,蔡泽富,吴钟解,等.海南花场湾表层沉积物重金属分布特征及污染评价[J].应用海洋学报,2018(1):84-93.
[4] 王军广,王鹏,伏箫诺,等.海南清澜港红树林湿地沉积物中重金属形态及生物有效性[J].西南农业学报,2019,32(10):2425-2431.
[5] 巩慧敏,刘永,肖雅元,等.近海海水和表层沉积物重金属污染与生态风险评价——以海南新村港为例[J].农业现代化研究,2018,39(4):700-708.
[6] XIAN J A,LI B,GUO H,et al.Haemocyte apoptosis of the tiger shrimp Penaeus monodon exposed to cadmium[J].Bull Environ Contam Toxicol,2014(92):525-528.
[7] CHANG M,WANG W N,WANG A L,et al.Effects of cadmium on respiratory burst,intracellular Ca2+ and DNA damage in the white shrimp Litopenaeus vannamei[J].Comp Biochem Physiol C,2009,149(4):581-586.
[8] 冼健安,王安利,苗玉涛,等.镉对凡纳滨对虾离体血细胞的毒性影响[J].水生态学杂志,2012,33(1):112-115.
[9] WANG J X,WANG Q,LI J R,et al.Cadmium induces hydrogen peroxide production and initiates hydrogen peroxide-dependent apoptosis in the gill of freshwater crab,Sinopotamon henanense[J].Comp Biochem Physiol C,2012,156(3-4):195-201.
[10] 王兰,李涌泉,闫博,等.Cd对河南华溪蟹(Sinopotamon henanense)主要组织器官SOD和POD同工酶的影响[J].应用与环境生物学报,2007,13(6):823-829.
[11] 闫博,王兰,李涌泉,等.镉对长江华溪蟹肝胰腺抗氧化酶活力的影响[J].动物学报,2007,53(6):1121-1128.
[12] 呼光富,李忠,梁宏伟,等.镉对克氏原螯虾肝胰腺触角腺及鳃中SOD和CAT活性的影响[J].农业环境科学学报,2009,28(9):1806-1811.
[13] 黄金昌,郭荣富.谷氧还蛋白和硫氧还蛋白对动物抗氧化应激生物学效应的研究进展[J].动物营养学报,2010,22(4):845-850.
[14] 郑佩华,张秀霞,汪蕾,等.凡纳滨对虾微粒体谷胱甘肽硫转移酶3(MGST3)的基因克隆与功能分析[J].南方农业学报,2020,51(10):2311-2320.
Effects of cadmium stress on gene expression in hemocytes of the white shrimp Litopenaeus vannamei
ZHANG Xiuxia1,3,WANG Lei2,ZHANG Zelong1,3,
LI Juntao1,3,WANG Dongmei1,3,XIAN Jianan1,3
(1.Hainan Provincial Key Laboratory for Functional Components Research and Utilization of Marine Bio-resources,Institute of Tropical?Biosciences and Biotechnology,CATAS,Haikou 571101,China;2.Institute of Modern Aquaculture Science and Engineering(IMASE),Guangdong?Provincial Key Laboratory for Healthy and Safe Aquaculture,Guangzhou Key Laboratory of Subtropical Biodiversity and Biomonitoring,Key?Laboratory of Ecology and Environmental Science in Guangdong Higher Education,School of Life Sciences,South China Normal University,Guangzhou,510631,China;3.Hainan Institute of Tropical Agricultural Resources,CATAS,Haikou 571101,China)
Abstract:To investigate the molecular response of haemocytes of the shrimp Litopenaeus vannamei to Cd stress,gene expression levels of Trx 2,Grx 2,Grx 3 and MGST 3 were measured in haemocytes from shrimp exposed to Cd2+ (0,0.5 mg/L and 5 mg/L) for different times.Results showed that the expression levels of Trx 2,Grx 3 and MGST 3 were significantly up-regulated in the middle and late stages of the stress,and the expression level of Grx 2 was significantly increased after 6 h exposure to 5 mg/L Cd2+,and this level continued to 48 h.These results indicate that expression of these four redox and antioxidant related genes in haemocytes of L.vannamei are up-regulated to protect against Cd stress.Grx 2 is sensitive to Cd stress and plays a role in the whole stress process.Trx 2,Grx 3 and MGST 3 mainly play a role in the middle and late stages of the stress.The gene expression response has a certain concentration effect.
Key words:Litopenaeus vannamei; cadmium; hemocyte; antioxidant enzyme; gene expression
(收稿日期:2021-02-24)
基金項目:海南省自然科学基金(319QN306);中国热带农业科学院基本科研业务费专项资金(1630052019013)。
作者简介:张秀霞(1982.7-),女,助理研究员,研究方向:水产动物健康养殖。E-mail:zhangxiuxia@itbb.org.cn。
通信作者:冼健安(1983.2-),男,博士,副研究员,研究方向:水产养殖生态及毒理学、水产动物营养与饲料学。E-mail: xian-ja@163.com。DOI:10.3969/j.issn.1004-6755.2021.03.001

