不同氮磷浓度梯度对礁膜配子体生长的影响
徐日升 崔建军 王晓梁 徐聪 黄博文 翁曼欣 谢恩义
摘 要:为探索礁膜(Monostroma nitidium)配子体生长的适宜氮、磷浓度需求,以NaNO3为氮源、KH2PO4为磷源,在不同氮(0、10、20、40、60、80 μmol/L)、磷(0.5、1、2 μmol/L)浓度梯度下,室内培养礁膜配子体7 d,测定各处理组藻体的生长率、光合色素(叶绿素a、b和类胡萝卜素)和可溶性糖。结果表明,藻体生长最适氮、磷浓度比值为20∶1;且氮浓度为20 μmol/L、磷浓度为1 μmol/L时,礁膜配子体生长率取得最大值(13.80 %/d);氮浓度为20 μmol/L 、磷浓度为2 μmol/L时,藻体光合色素含量最高(分别为0.320 7 mg/g、0.170 8 mg/g和0.103 6 mg/g);氮浓度为0 μmol/L 、磷浓度为2 μmol/L时,藻体可溶性糖含量最高(19.03 mg/mL)。
关键词:礁膜(Monostroma nitidium);氮磷浓度;生长率;光合色素;可溶性糖
中图分类号:S954.4
礁膜(Monostroma nitidium)又称绿紫菜,属绿藻门、石莼目、礁膜科、礁膜属,配子体是单层细胞组成的膜状体[1]。礁膜属海藻食用价值高,营养丰富且口感极佳,同时具有药用价值,其硫酸多糖有降血脂、抗氧化以及抗炎等生物活性[25],礁膜具有产业化的栽培前景[6]。国内有关报道礁膜栽培和生长生态因子的文献较少,陈昌生[78]侧重于盐度与营养盐对配子体快速成熟形成配子囊的影响;以及光照强度对合子生长发育的研究;而礁膜配子体生长适宜的氮、磷营养盐需求未见报道,本文以NaNO3和 KH2PO4作为氮、磷来源, 设计不同添加氮、磷浓度梯度下的礁膜配子体培养实验, 观察其生长情况,旨在探明其礁膜配子体生长的最适氮、磷浓度及比例,为礁膜人工产业化养殖的营养盐调控提供理论依据。
1 材料与方法
1.1 礁膜藻种
礁膜配子体2019年4月份采自广东湛江硇洲岛附近海域的高潮带(E110°36.0923'N20°56.8266'),藻体加冰低温运回实验室,先用消毒海水(经高压灭菌30 min,冷却至常温)清洗去除藻体表面的泥沙和杂藻,然后在消毒海水中暂养7 d,条件为:温度15 ℃;光照2 000 lx;盐度26‰;pH 8.2;光暗比为12 h∶12 h。
1.2 试验设计
挑选预培养后形态完好、颜色鲜绿的礁膜藻体0.2 g(鲜重)培养于250 mL锥形瓶中,置于智能型光照培养箱(GXZ-300D)中培养。试验条件[9]:温度15 ℃;光照4 000 lx;盐度30‰;pH 8.2;光暗比12 h∶12 h。以NaNO3为氮源(N)、KH2PO4为磷源(P),设置不同氮(0、10、20、40、60、80 μmol/L)、磷(0.5、1、2 μmol/L)浓度梯度进行试验,试验过程中每隔2 d更换一次相同氮、磷浓度的灭菌消毒人工海水(AW)[10],每处理组均设3个重复,培养7 d后开始进行相关测定分析(表1)。
1.3 指标测定与方法
1.3.1 生长率 培养结束后,用吸水纸把藻体表面的水分吸干后称取藻体鲜重,计算生长率[11];藻体重量的生长率的计算公式如下:
GR(%/d)=[(Wt/W0)1/t -1]×100%
其中W0为初始藻的鲜重,g;Wt为培养结束后藻体的鲜重,g;t为培养周期,d。
1.3.2 光合色素含量 色素的测定按照李合生[12]《植物生理生化实验原理和技术》中的浸提法测定。先用95%乙醇提取色素,再用分光光度法测定吸光度值。以95%乙醇为空白对照,分别于波长665 nm、649 nm和470 nm处测定吸光度(A),计算公式为:
叶绿素a含量=(13.95A665-6.88A649) V/M/1 000
叶绿素b含量=(24.96A649-7.32A665) V/M/1 000
类胡萝卜素含量=(4.08A470-11.56A649+3.29A665)V/M/1 000
式中: A为吸光度值;V为待取液体积mL;M为样品质量,g;各色素含量以mg/g 为单位。
1.3.3 可溶性糖 以葡萄糖作为标准品制作标准曲线,采用苯酚硫酸法进行测定[13]。
1.3.4 统计分析 用SPSS19.0分析实验数据,结果以平均值±标准误差表示,并作方差分析和Duncan多重比较,P<0.05时差异有统计学意义。
2 结果与分析
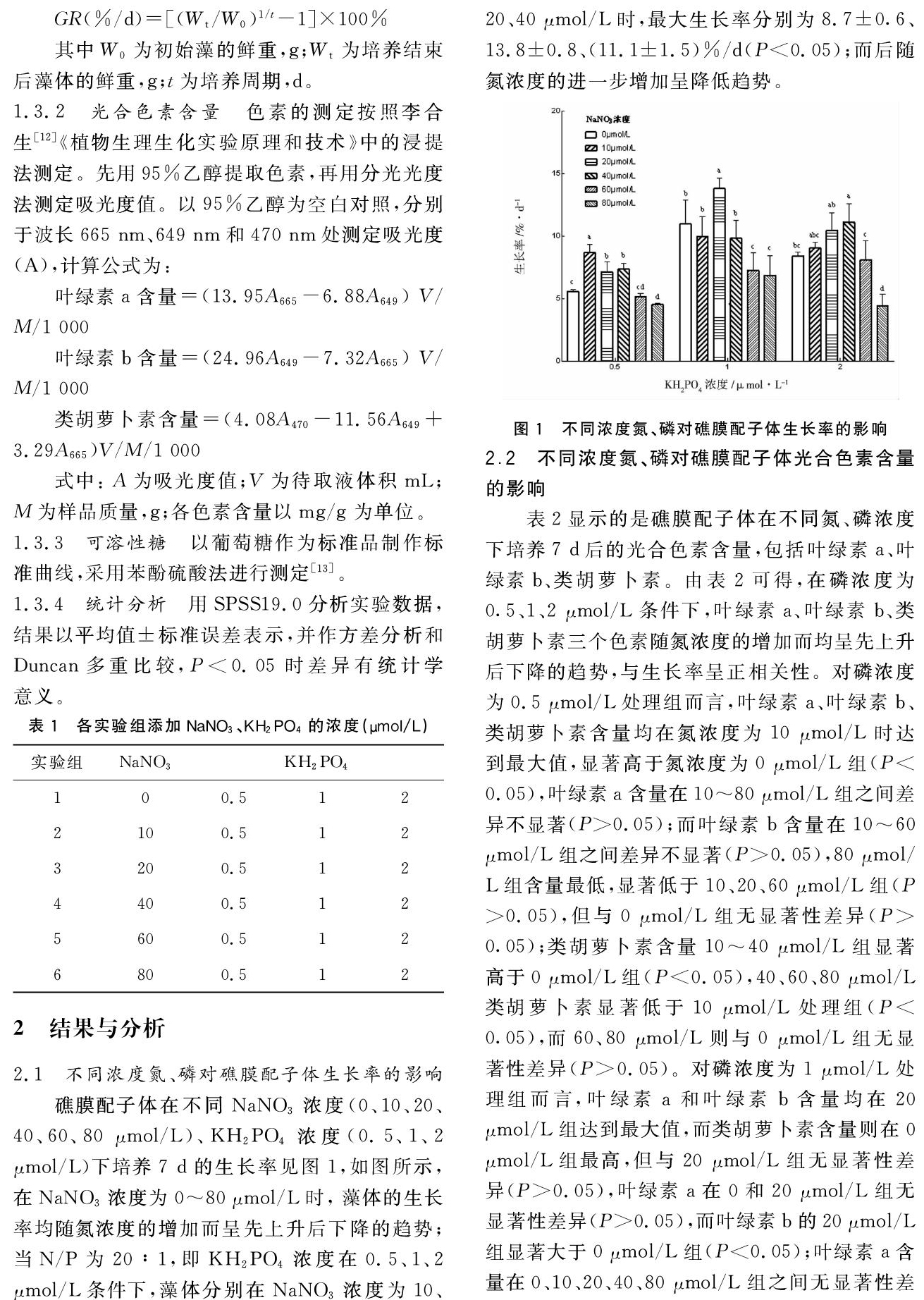
2.1 不同浓度氮、磷对礁膜配子体生长率的影响
礁膜配子体在不同NaNO3浓度(0、10、20、40、60、80 μmol/L)、KH2PO4浓度(0.5、1、2 μmol/L)下培养7 d的生长率见图1,如图所示,在NaNO3浓度为 0~80 μmol/L时, 藻体的生长率均随氮浓度的增加而呈先上升后下降的趋势;当N/P为20∶1,即KH2PO4浓度在0.5、1、2 μmol/L条件下,藻体分别在NaNO3浓度为10、20、40 μmol/L时,最大生长率分别为8.7±0.6、13.8±0.8、(11.1±1.5)%/d(P<0.05);而后随氮浓度的进一步增加呈降低趋势。
2.2 不同浓度氮、磷对礁膜配子体光合色素含量的影响
表2显示的是礁膜配子体在不同氮、磷浓度下培养7 d后的光合色素含量,包括叶绿素a、叶绿素b、类胡萝卜素。由表2可得,在磷浓度为0.5、1、2 μmol/L条件下,叶绿素a、叶绿素b、类胡萝卜素三个色素随氮浓度的增加而均呈先上升后下降的趋势,与生长率呈正相关性。对磷浓度为0.5 μmol/L处理组而言,叶绿素a、叶绿素b、类胡萝卜素含量均在氮浓度为10 μmol/L时达到最大值,显著高于氮浓度为0 μmol/L组(P<0.05),叶绿素a含量在10~80 μmol/L组之间差异不显著(P>0.05);而叶绿素b含量在10~60 μmol/L组之间差异不显著(P>0.05),80 μmol/L组含量最低,显著低于10、20、60 μmol/L组(P>0.05),但与0 μmol/L组无显著性差异(P>0.05);類胡萝卜素含量10~40 μmol/L组显著高于0 μmol/L组(P<0.05),40、60、80 μmol/L类胡萝卜素显著低于10 μmol/L处理组(P<0.05),而60、80 μmol/L则与0 μmol/L组无显著性差异(P>0.05)。对磷浓度为1 μmol/L处理组而言,叶绿素a和叶绿素b含量均在20 μmol/L组达到最大值,而类胡萝卜素含量则在0 μmol/L组最高,但与20 μmol/L组无显著性差异(P>0.05),叶绿素a在0和20 μmol/L组无显著性差异(P>0.05),而叶绿素b的20 μmol/L组显著大于0 μmol/L组(P<0.05);叶绿素a含量在0、10、20、40、80 μmol/L组之间无显著性差异(P>0.05),60 μmol/L组含量最低,显著低于20 μmol/L组(P<0.05),但与0 μmol/L组无显著性差异(P>0.05);叶绿素b含量各处理组均显著低于20 μmol/L组(P<0.05),各组之间无显著性差异(P>0.05);类胡萝卜素含量在60 μmol/L组最低,显著低于0、10、20 μmol/L组(P<0.05),而除60 μmol/L组外,其余各组之间无显著性差异(P>0.05)。对磷浓度为2 μmol/L处理组而言,叶绿素a、叶绿素b、类胡萝卜素含量均在氮浓度为20~40 μmol/L时达到最大值,显著高于氮浓度为0 μmol/L组(P<0.05),随后呈现下降趋势,80 μmol/L组含量最低,显著低于10~60 μmol/L组(P<0.05),与0 μmol/L组无显著性差异(P>0.05)。
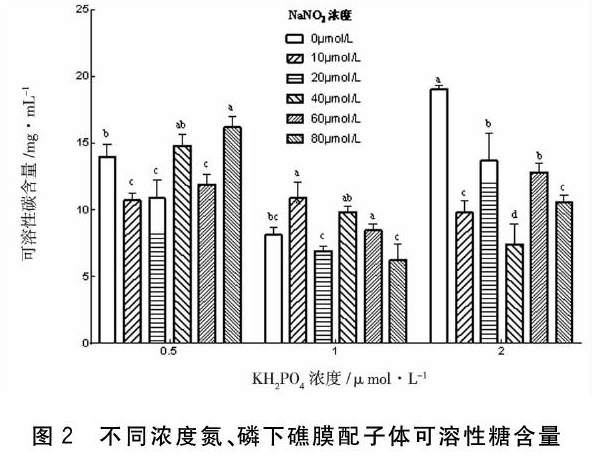
2.3 不同浓度氮、磷对礁膜配子体可溶性糖含量的影响
礁膜配子体在不同NaNO3浓度(0、10、20、40、60、80 μmol/L)、KH2PO4浓度(0.5、1、2 μmol/L)下培养7 d的可溶性糖含量见图2,如图所示,在磷浓度为0.5、1、2 μmol/L条件下,总体上看,藻体可溶性糖含量随氮浓度的增加而均呈先下降后上升的趋势,与生长率呈负相关性。对磷浓度为0.5 μmol/L而言,氮浓度为80 μmol/L时,藻体的可溶性糖含量最高,达到(16.19±0.82)mg/mL,显著高于0 μmol/L处理组(P<0.05);氮浓度为10 μmol/L时,藻体的可溶性糖含量最低,只有(10.69±0.57)mg/mL,显著低于0 μmol/L处理组(P<0.05)。对磷浓度为1 μmol/L而言,氮浓度为10 μmol/L时,藻体的可溶性糖含量最高,达到(10.90±1.19)mg/mL,显著高于0 μmol/L處理组(P<0.05);氮浓度为20 μmol/L时,藻体的可溶性糖含量最低,只有(6.93±0.34)mg/mL,但与0 μmol/L处理组无显著性差异(P>0.05)。对磷浓度为2 μmol/L而言,氮浓度为0 μmol/L时,藻体的可溶性糖含量最高,达到(19.03±0.29)mg/mL,显著高于其余处理组(P<0.05);氮浓度为40 μmol/L时,藻体的可溶性糖含量最低,只有(7.44±1.50)mg/mL,显著低于其余各处理组。
3 讨论
3.1 不同浓度氮、磷对礁膜配子体生长率与光合色素的影响
氮和磷是藻类生长所必需的主要元素, N、P等营养元素的添加,对植物的生长有较大促进作用[14-15]。
本研究结果表明, 在三种不同KH2PO4(0.5、1、2 μmol/L)水平下,不同摩尔质量浓度的NaNO3对礁膜的生长有显著影响 (P<0.05),总体呈现出藻体的生长率随氮浓度的增加而都呈先上升后下降的趋势,这与众多有关研究结果相符[16-18]。藻体生长率呈现先升后降的原因可能是对氮、磷比例存在一个饱和点,达到饱和点时生长速率大,此处为拐点,随后氮、磷比例增加,藻体生长会受到抑制而呈现生长速率下降的趋势。同时,许多研究表明, 不同N/P对藻类的生长有显著影响,丁刚[18]等人指出N/P为20∶1,鼠尾藻幼苗特定生长率最高,而李慧等[19]人发现铜藻幼苗的特定生长率在N/P为10∶1时达到最大,还有杨彬[20]等人表明莫氏马尾藻幼苗的适宜N/P为15∶1,蔡煜[21]等人则发现氮、磷比为8∶1 和 10∶1 时,长茎葡萄蕨藻的特定生长率升高,本研究中礁膜配子体则在N/P为20∶1时达到最大生长率,说明礁膜配子体的生长也有特定的最优氮、磷比浓度需求。
光合色素是反映藻类生长和光合作用的重要指标。关于氮、磷浓度对光合色素的研究中,李文慧[22]等人发现缘管浒苔的叶绿素和类胡萝卜素的含量是随着实验中氮的浓度升高而升高的,徐智广[23]指出氮的加富可以提高龙须菜的色素含量。而徐永健[24]则认为叶绿素a与实验的氮的浓度关系不密切。本实验中,在三种固定的磷浓度(0.5、1、2 μmol/L),礁膜配子体的光合色素,包括叶绿素a,叶绿素b和类胡萝卜素总体上都是随着氮浓度的升高而呈现先上升后下降的趋势,与其生长率正相关,而且色素之间也有一定的正相关性。在磷浓度为0.5和1 μmol/L时,藻体的叶绿素a,叶绿素b和类胡萝卜素都是在N/P为20∶1时达到最大值;而磷浓度为2 μmol/L则是在氮浓度为20 μmol/L光合色素达到最大值,与氮浓度为40 μmol/L时的光合色素没有显著性差异(P>0.05),此时N/P为20∶1。也就是说磷浓度为0.5 μmol/L,藻体的光合色素在氮浓度为0~10 μmol/L呈现上升趋势;磷浓度为1 μmol/L,藻体的光合色素在氮浓度为0~20 μmol/L呈现上升趋势;磷浓度为2 μmol/L,藻体的光合色素在氮浓度为0~40 μmol/L呈现上升趋势。在一定的氮浓度范围内,藻体的光合色素会随浓度的升高而升高,这也与李文慧、徐智广[22-23]的研究结果相符合,但是光合色素含量达到最高点之后,开始呈现下降趋势。对磷浓度为0.5 μmol/L的实验组而言,藻体的叶绿素a含量在氮浓度为10~80 μmol/L并无显著性差异(P>0.05);叶绿素b含量在氮浓度为10~60 μmol/L并无显著性差异(P>0.05),原因可能是氮作为合成叶绿素的原料之一必须跟磷一起吸收才能发挥作用,而在氮浓度的不断上升的时候,磷已经缺乏,磷就成了限制因子,所以不能促进叶绿素的合成与积累。而在10~40 μmol/L时,类胡萝卜素含量都显著高于0 μmol/L组(P<0.05),说明此时氮浓度范围适宜类胡萝卜素的积累;60~80 μmol/L类胡萝卜素显著低于10~20 μmol/L处理组(P<0.05),说明氮浓度过高也开始对类胡萝卜素的积累产生不利影响,但并没有抑制作用,因为60、80 μmol/L组与0 μmol/L组没有显著性差异(P>0.05)。对磷浓度为1 μmol/L的实验组而言,叶绿素a含量虽然是氮浓度为20 μmol/L组达到最大值,但是总体来说变化不大,只有氮浓度为60 μmol/L组显著低于20 μmol/L组(P<0.05),说明此氮浓度开始对叶绿素a的合成产生不利影响,而0、10、20、40和80 μmol/L组均无显著性差异(P>0.05),这与徐永健[24]的结果相似,认为叶绿素a与氮的浓度关系不密切。该组的类胡萝卜素含量与叶绿素a含量正相关性,除了60 μmol/L组显著低于0~20 μmol/L组(P<0.05),其余各组无显著性差异(P>0.05)。而叶绿素b含量20 μmol/L组显著高于其余各组(P<0.05),而其余各组均无显著性差异(P>0.05)。说明在该磷浓度下,叶绿素b对氮浓度变化并不敏感,且在20 μmol/L时含量最高,且显著高于其他组,且该浓度下藻体的相对生长率也是最好的。对于磷浓度为2 μmol/L组而言,叶绿素a、叶绿素b与类胡萝卜素呈正相关性,且三种色素含量也与藻体的相对生长率有正相关性关系,与生长率一样都是呈现先上升后下降的趋势。20、40 μmol/L组,藻体的三种色素含量显著大于其余各组(P<0.05),而其生长率则是在40 μmol/L时最大,这有很大的相关性体现。这与李信书[25]等人对条斑紫菜的研究发现各种光合色素含量存在一定的相关关系,与本文研究相似。
总体来说,在三种不同KH2PO4水平下光合色素随氮浓度的变化规律跟生长率的趋势相符,且三种色素之间也存在一定的正相关性。
3.3 不同摩尔质量浓度NaNO3对礁膜配子体可溶性糖含量的影响
有研究表明[26],可溶性糖是植物适应环境的信号物质,对植物的生长与发育有调控作用。
有学者认为[27],藻体过量的糖会对藻类的生长造成不利的影响。本实验中,总体上礁膜体内的可溶性糖含量变化趋势与生长呈负相关。本研究中发现,在KH2PO4浓度为0.5 μmol/L下,NaNO3浓度为80 μmol/L时, 藻体的可溶性糖含量最高,显著高于0 μmol/L处理组(P<0.05),而此时的生长率反而是最小的;10 μmol/L处理组,可溶性糖含量最低,显著低于0 μmol/L处理(P<0.05),而此时的生长率最大。KH2PO4濃度为1 μmol/L下, 在NaNO3浓度为20 μmol/L时, 藻体的可溶性糖含量最低,而此时的生长率也为最高,在KH2PO4浓度为2 μmol/L下,NaNO3浓度为40 μmol/L时, 藻体的可溶性糖含量最低,而此时的生长率也是最高的。
而刘婷[28]等人则认为可溶性糖的含量会随着氮浓度的升高而降低。本实验中,在三种固定的磷浓度下,在氮浓度不断上升的过程中,可溶性糖会呈现先下降后上升的趋势,会出现一个最低点。可溶性糖不断下降到最低点的过程与刘婷的研究结果相符,原因可能是,在这个阶段藻体需要吸收氮用于合成叶绿素和蛋白质,而可溶性糖的合成就较少,而当生长达到饱和之后,培养液的氮过剩,叶绿素和蛋白质的合成就减缓,而可溶性糖的含量就开始上升不断积累胞内物质,以抵抗以后氮缺乏的阶段。
4 小结
藻体的生长率随氮浓度的增加而都呈先上升后下降的趋势,本研究中,当N/P为20∶1即KH2PO4浓度在0.5、1、2 μmol/L条件下,藻体分别在NaNO3浓度为10、20、40 μmol/L时具有最大生长率,分别为8.68±0.62、13.80±0.84、(11.10±1.50)%/d(P<0.05),光合色素含量与生长趋势相符,也呈现出先上升后下降的趋势,在N/P为20∶1色素含量最高,而此时可溶性糖含量最低。
参考文献:
[1] 丁兰平.中国海藻志:第4卷 绿藻门[M].2013:32-39.
[2] 谢恩义, 马家海, 陈扬.宽礁膜营养成分分析及营养学评价[J].上海海洋大学学报, 2002, 11(2):129-133.
[3] CHANG H C, WU L C.Texture and quality properties of Chinese fresh egg noodles formulated with green seaweed (Monostroma nitidum) powder[J].Journal of Food Science, 2010, 73(8): 398-404.
[4] 中国人民解放军海军后勤部卫生部.中国药用海洋生物[M].上海:上海人民出版社,1977:4.
[5] HOANG M H, KIM J Y, JI H L, et al.Antioxidative, hypolipidemic, and anti-inflammatory activities of sulfated polysaccharides from Monostroma nitidum[J].Food Science & Biotechnology, 2015, 24(1):199-205.
[6] 粟文, 谢恩义, 孙立伟等.礁膜室内规模化人工育苗的研究[J].水产科学, 2018, 37(06):112-116.
[7] 陈昌生,章景荣,张振皎.盐度和营养盐对礁膜配子体发育的影响[J].水产学报, 1992,16(4):388-391.
[8] 陈昌生.光照对礁膜合子生长发育的影响[J].水产学报, 1996,20(01):30-35.
[9] 谢恩义.宽礁膜的基础生物学及应用研究[D].上海:上海水产大学, 2003:102-106.
[10] 樊娟.氮、磷浓度及氮输入频度对两种海洋微藻生长的影响研究[D].天津:-南开大学, 2010:18-19.
[11] YOONG Y , WILSON Y , ANN A .Analysis of formulae for determination of seaweed growth rate[J].Journal of Applied Phycology, 2013, 25(6):1831-1834.
[12] 李合生.植物生理生化实验原理和技术[M].高等教育出版社, 2000:134-137.
[13] 马美萍.螺旋藻高产多糖种质与生产条件优化研究及分子机理初探[D].杭州:浙江大学, 2003:11-17.
[14] 曹春晖, 刘文岭, 施定基,等.不同氮磷浓度对米氏凯伦藻生长的影响[J].天津科技大学学报, 2010, 25(2):22-25.
[15] 肖利杰, 刘春梅, 李梅,等.施硒对水稻硒·氮·磷·钾含量及产量的影响[J].安徽农业科学, 2015, 503(34):59-61.
[16] 梁 英, 麦康森, 孙世春,等.不同的营养盐浓度对三角褐指藻生长的影响[J].海洋湖沼通报, 1999 (4): 43-47.
[17] 林 霞, 陆开宏, 盛岚岚.氮磷铁营养浓度对不同品系三角褐指藻生长影响的比较研究[J].浙江海洋学院学报(自然科学版), 2000,19(4): 384-387.
[18] 丁 剛, 于晓清, 詹冬梅,等.不同氮、磷浓度及配比对鼠尾藻幼苗生长的影响[J].水产科学, 2014,33(4): 219-222.
[19] 李慧,丁刚,辛美丽,等.不同氮、磷浓度及配比对铜藻(Sargassum horneri)幼苗生长的影响[J].海洋与湖沼,2017,48(02):368-372.
[20] 杨 彬, 谢恩义, 曲元凯.不同环境因子对莫氏马尾藻幼苗生长和光合色素的影响[J].南方水产科学, 2013,9(4): 39-44
[21] 蔡煜, 刘东超, 王晓梁,等.温度、照度和氮磷营养盐对长茎葡萄蕨藻富硒的影响[J].广东海洋大学学报, 2019, 39(03):49-56.
[22] 李文慧,朱明,刘冉,等.氮磷营养盐因子对缘管浒苔生长、叶绿素荧光特性和氮磷富集的影响[J].生态与农村环境学报, 2015,31(04):553-558.
[23] 徐智广.2种大型经济海藻对海水中营养盐供应的生理响应[D].汕头:汕头大学, 2007:42-45.
[24] 徐永健,钱鲁闽,王永胜.氮素营养对龙须菜生长及色素组成的影响[J].台湾海峡,2006(02):222-228.
[25] 李信书,伏光辉,陈百尧,等.氮、磷加富对条斑紫菜生长及生化组成的影响[J].水产科学,2012,31(09):544-548.
[26] 李玲, 余光辉, 曾富华.水分胁迫下植物脯氨酸累积的分子机理[J].华南师范大学学报:自然科学版, 2003(1):126-134.
[27] ROOK F, HADINGHAM S A, YUNHAI L I, et al.Sugar and ABA response pathways and the control of gene expression [J].Plant Cell and Environment, 2006, 29(3):426-434.
[28] 刘婷,马增岭,李慧,等.光强和硝态氮水平对铜藻(Sargassum horneri)生长和光合生理特性的影响[J].生态学杂志, 2019,38(03): 762-769.
Abstract:[Objective] To explore the appropriate nitrogen and phosphorus concentration requirements for the growth of Monostroma nitidium gametophyte.[Methods] With NaNO3 as the nitrogen source and KH2PO4 as the phosphorus source, the concentration gradients of different nitrogen (0, 10, 20, 40, 60, 80 μmol/L) and phosphorus (0.5, 1, 2 μmol/L) were set, and the M.nitidium gametophytes were cultured for 7 days in nutrient solution mentioned above, in order to determine their growth rate, photosynthetic pigments(Chla, Chlb, Carotenoides) and soluble sugar.[Results] The optimum ratio of nitrogen and phosphorus concentration for algals growth is 20∶1, and when nitrogen concentration is 20 μmol/L and phosphorus concentration is 1 μmol/L, the growth rate of the M.nitidium gametophyte reaches the maximum value (13.80 %/d), when nitrogen concentration is 20 μmol/L and phosphorus concentration is 2 μmol/L, the photosynthetic pigments content of algal is the highest (0.320 7 mg/g, 0.170 8 mg/g and 0.103 6 mg/g, respectively), when nitrogen concentration is 0 μmol/L and phosphorus concentration is 2 μmol/L, the content of soluble sugar was the highest (19.03 mg/mL).[Conclusion] when N/P is 20∶1, the growth rate of M.nitidium reach the maximum value.This study provides supporting data and theoretical basis for the regulation of nutrients in cultivation of M.nitidium.
Key words:Monostroma nitidium; nitrogen and phosphorus concentration; growth rate; photosynthetic pigment; soluble sugar

