变温对仿刺参(Apostichopus japonicus)免疫力及抗病力的影响
高杨
摘 要:水温一直以来被认为是影响仿刺参(Apostichopus japonicus)各项免疫指标的重要环境因素。为了探讨其对于仿刺参免疫力及抗病力的影响,首先对仿刺参进行了两组温度突变试验,分别为A组(11 ℃→4 ℃→11 ℃→4 ℃→11 ℃→4 ℃)和B组(18 ℃→11 ℃→4 ℃),取体壁、触手、体腔液、内脏四个不同组织,测定抗菌活力、超氧化物歧化酶(SOD) 、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)四个免疫指标。随后取B组温度突变的条件,进行攻毒感染试验,计算发病率和死亡率。结果表明:(1)在A组温度突变试验中,各项免疫酶指标一般在前两轮的温度突变中,差异不显著(P<0.05),而到了第三轮的温度突变时,体壁和触手中免疫相关酶活性显著上升(P<0.05)。(2)在B组温度突变试验中,刺参机体的免疫及其相关酶在最适生长温度18 ℃下的活性较高,温度突降至11 ℃其活性下降,再降至4 ℃后有所回升,但仍低于18 ℃下的免疫活性;触手和体壁中免疫酶活性变化显著(P<0.05),而体腔液和内脏中免疫酶的活性变化不显著(P<0.05)。(3)攻毒试验结果显示,温度突变各组刺参发病(吐肠及化皮率)及死亡率明显高于正常组。由此表明,温度突变作为一种环境胁迫,对于仿刺参的免疫力和抗病力产生重要的影响。体壁和触手作为刺参免疫屏障的第一道防线,对于环境变化最为敏感。
关键词:仿刺参(Apostichopus japonicus);变温;免疫力;抗病力
仿刺参(Apostichopus japonicus)属于变温动物,自身免疫力受环境影响大。温度波动对刺参的生理活动及免疫反应均具有重要影响[1]。目前有关温度对仿刺参免疫力影响的研究,主要集中在降温对仿刺参生长及生理现象的研究等方面[2-4]。如低温使仿刺参耗氧量下降,出现负增长。不同群体仿刺参还出现排脏、皮肤溃烂(化皮)和死亡等现象。变温对刺参免疫力及抗病力的影响还未见报道。
在本研究中,作者设计了两组温度突变实验,并取体壁、触手、体腔液、内脏四个不同组织,进行了抗菌活力、超氧化物歧化酶(SOD) 、酸性磷酸酶(ACP)和碱性磷酸酶(AKP)四个免疫指标的测定。随后进行攻毒试验,统计发病率和死亡率。为深入并系统地研究环境因子对刺参免疫力及抗病力的影响提供了参考。目前认为,机体抗病力的下降是导致发病死亡的主要原因之一。本研究有助于深入了解刺参免疫防御特性,为刺参苗种的健康养殖提供了理论参考。
1 材料与方法
1.1 试验材料和条件
实验所用幼参于2016年 3月6日取于大连黑石礁海域某海参养殖场,体长3~5 cm,平均体重2.60 g。取回后在60 cm×25 cm×40 cm玻璃水族箱内暂养,养殖用水为盐度29‰~32‰、pH 7.9~8.3、温度17~19 ℃的大连黑石礁海域过滤海水。暂养期间进行不间断充气、每日投饲、换水等日常管理,经暂养一周无异常现象,作为试验材料。
1.2 试验方法
1.2.1 试验分组
设计了两组温度突变组,每24 h温度突变一次,每组6头幼参,设置3个平行组。
A组: 11 ℃→4 ℃→11 ℃→4 ℃→11 ℃→4 ℃,由起始温度11 ℃经24 h后,将幼参直接转到4 ℃下,共反复3次。
B组:18 ℃→11 ℃→4 ℃,由起始温度18 ℃经24 h后,将幼参直接转到11 ℃,再经24 h转到4 ℃下。
控温:将盛有2 L过滤海水的聚乙烯烧杯放入已调好温度的可控温生化培养箱中,24 h后,小心地把幼参移到下一个调节好温度的烧杯中。
取样:分别在每次温度突变后的第1 h、12 h、24 h时每组随机取幼参1头,最后取3个样品平均值。
1.2.2 样品的制备
在冰盘上解剖取触手、体壁、内脏、体腔液,装入样品袋中,-80 ℃深冷冰箱中保存,备用。
触手、体壁、内脏分别称重后,按1∶10(w/v)加入冷PBS缓冲液进行匀浆,匀浆液移入1.5 mL离心管,离心。触手、体壁在4 ℃、6 500 r/min 離心20 min,取上清,-80 ℃冷冻保存,备用;肠、体腔液在4 ℃、7 500 r/min 离心20 min,取上清,-80 ℃冷冻保存,备用。
1.2.3 免疫酶的测定
抗菌活力:采用Hultmaik等[5]方法在96孔酶标仪中进行。
超氧化物歧化酶(SOD)活力:采用南京建成生物医药公司的试剂盒测定。
碱性磷酸酶(AKP):采用磷酸苯二钠法[6-7]。以每100 μL样品上清液在37 ℃与底物作用15 min,产生1 mg酚定义为一个酶活力单位。
酸性磷酸酶(ACP):采用磷酸苯二钠法[6-7]。以每100 μL样品上清液在37 ℃与底物作用60 min,产生1 mg酚定义为一个酶活力单位。
蛋白质含量:采用考马斯亮兰试剂盒测定。
1.2.4 攻毒感染试验
感染用实验室分离获得的3株对刺参有致病性的细菌(鉴定为弧菌属细菌),分别编号为06021802(2#),050124201(8#),05040702(27#)。将三株菌在2216E斜面25 ℃培养18~24 h,然后用无菌海水洗脱培养物并稀释,制成菌悬液(浓度为7.5×107个/mL)。另取刺参分成4个试验组,每组10头,设置3个平行组。其中2组经过B组温度突变后,体腔注射0.1 mL菌悬液;取正常条件下暂养的幼参同时注射等量无菌海水。实验水温12~15 ℃。观察并统计发病率和死亡率。
1.3 统计分析
所得试验数据均用平均值±标准差(X±SE) 表示,以酶的比活力即每毫克蛋白中的酶活力进行数据统计。采用SPSS17.0进行方差分析和Duncan多重检验。P<0.05为差异显著,P>0.05为差异不显著。
2 结果
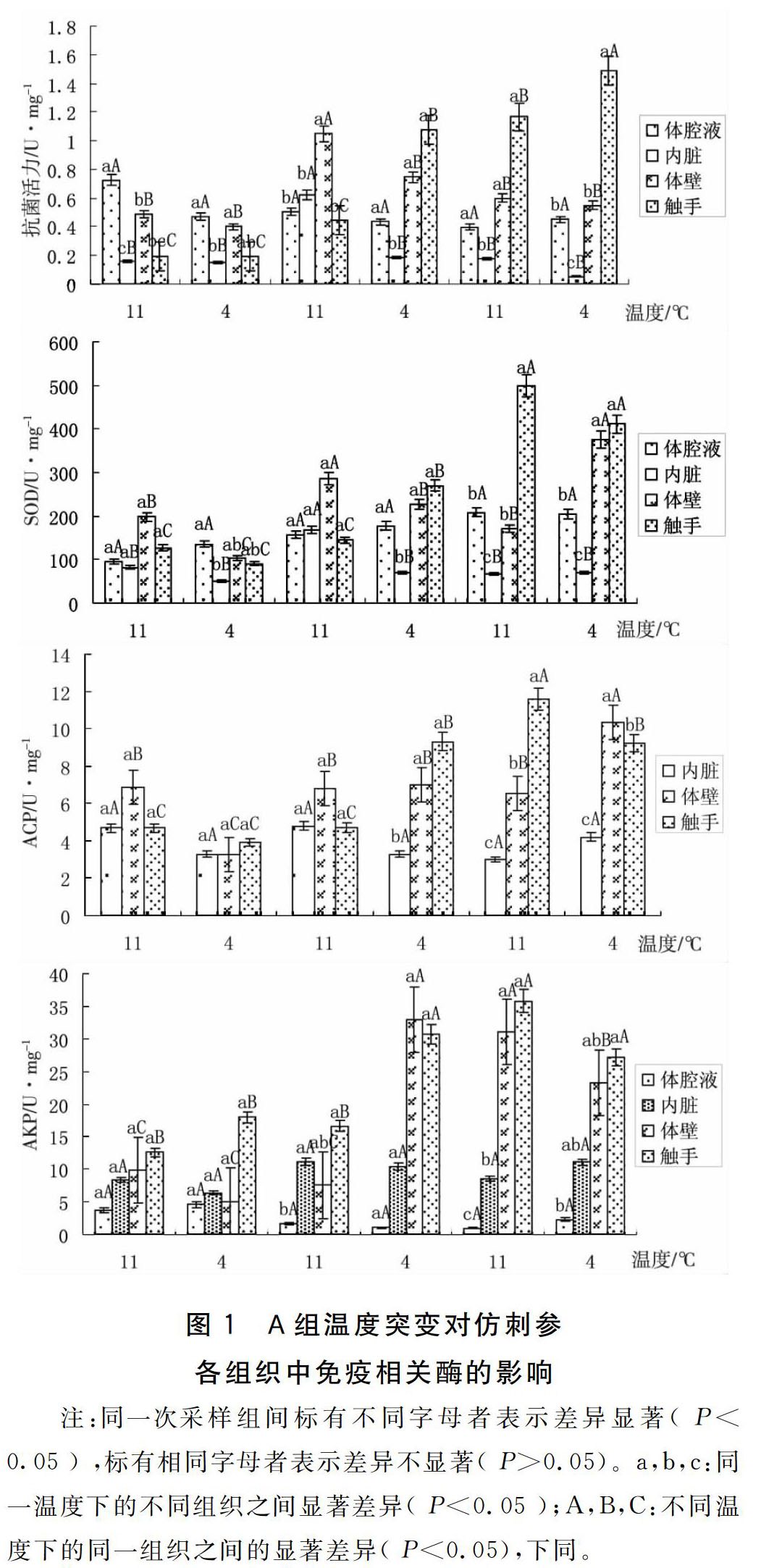
2.1 A组温度突变对仿刺参免疫相关酶的影响
A组温度突变对仿刺参免疫相关酶的影响如图1所示。
注:同一次采样组间标有不同字母者表示差异显著( P<0.05 ) ,标有相同字母者表示差异不显著( P>0.05)。a,b,c:同一温度下的不同组织之间显著差异( P<0.05 );A,B,C:不同温度下的同一组织之间的显著差异( P<0.05),下同。
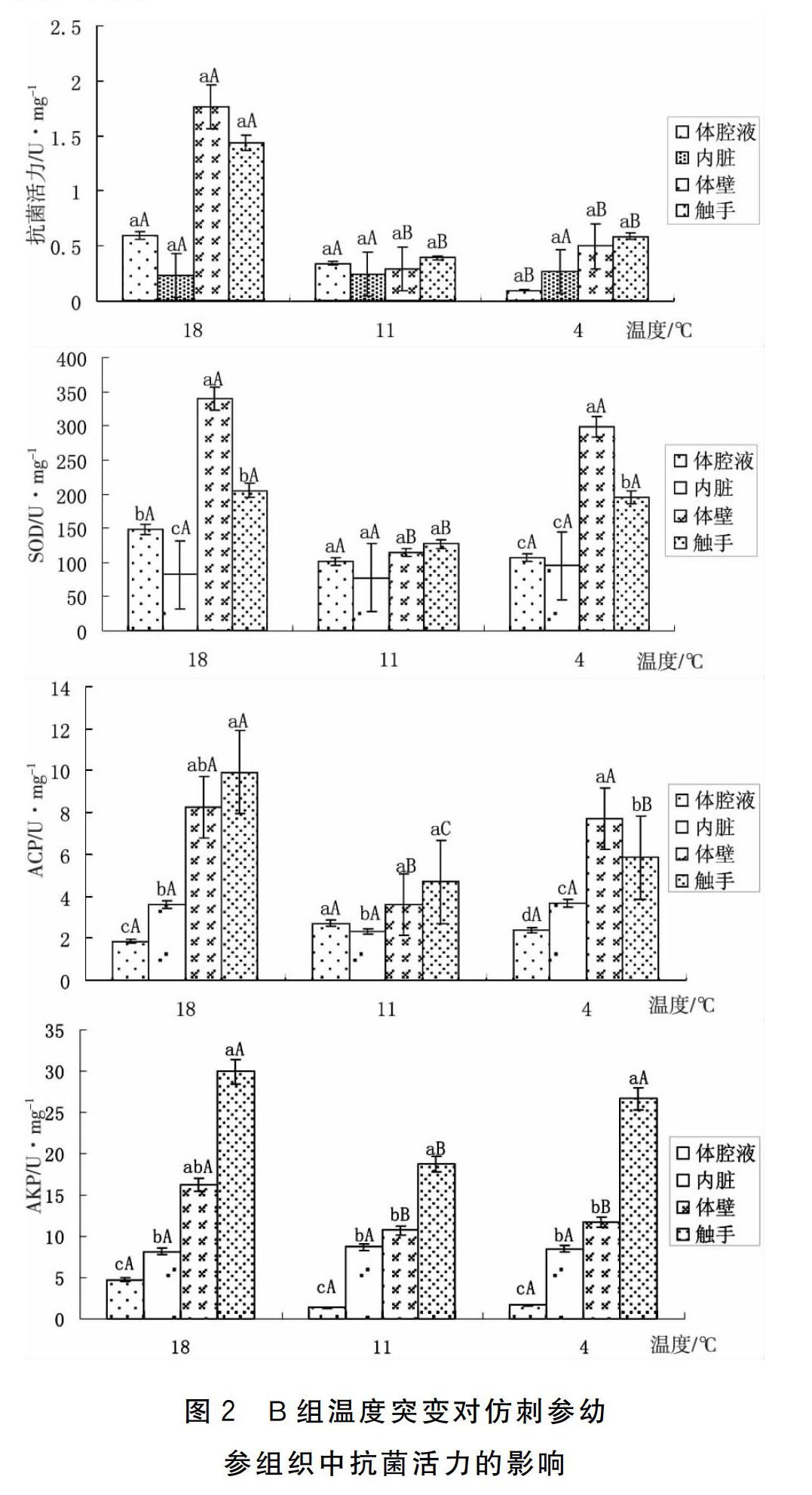
2.2 B组温度突变对仿刺参幼参免疫相关酶的影响
B组温度突变对仿刺参免疫相关酶的影响如图2所示。
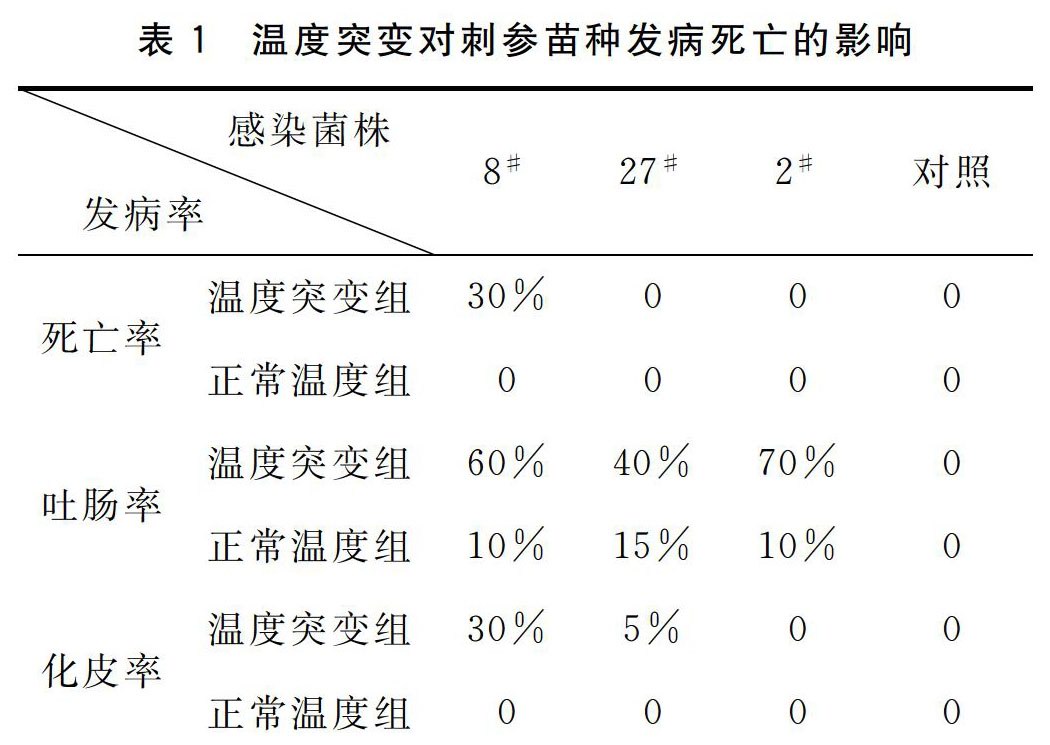
2.3 温度突变对仿刺参发病和死亡的影响
由表1可以看出,经过温度突变后的各组刺参发病率(吐肠及化皮率)及死亡率明显高于正常组。其中,8#菌株的发病率和死亡率最高,死亡率为30%,可能与该菌株的毒力有关。27#和2#菌株感染组在感染15天后均无死亡,但从吐肠率和化皮率中的比较中发现,2#发病率大于27#菌株感染组。
3 讨论
刺参作为外温动物,温度的变化会导致其内环境温度的改变,影响其机体代谢、细胞活动变化,免疫学上表现为抗菌活力、SOD、ACP、AKP活力的变化。抗菌活力广泛存在于甲壳动物的血淋巴中,在免疫反应中起重要作用。SOD是一种重要的抗氧化酶[8],作为活性氧清除剂可清除体内自由基,在防止衰老及防生物分子损伤等方面具有极为重要的作用。ACP是高等动物体内巨噬细胞溶酶体的标志酶,在体内直接参与磷酸基团的转移和代谢[9]。AKP是生物体内的一种重要的代谢调控酶,直接参与磷酸基团的转移,参与钙磷代谢,在脊椎动物的骨化作用中起重要作用。
环境因子变化是引起养殖生物应激反应使其免疫抗病能力下降的主要诱因[10]。其中温度是重要的外界因素之一。本研究用抗菌活力、SOD、ACP和AKP的活性作为衡量刺参免疫力的指标,分别做了三组实验。
A组实验结果显示:在连续的水温突变下,刺参幼参各组织的免疫指标(除了抗菌活力外),在前两轮11 ℃→4 ℃的温度突变均显示出较小幅度的波动变化,而到了第三轮11 ℃→4 ℃温度突变时幼参机体中的免疫活性开始出现明显波动。体壁、触手中各项免疫酶指标出现大幅度的升高并达到峰值,而内脏和体腔液中各项免疫酶指标变化不显著。抗菌活力则在第二轮的温度突变时就出现大幅度的波动。由此分析,11 ℃与4 ℃之间持续突变对刺参幼参是一种环境胁迫,机体的免疫水平对此产生了相应的应激反应--上下波动,且在连续刺激一定时间以后波动幅度也有所上升。刘伟[11]等在研究温度缓降和骤降对刺参非特异性免疫影响时,提出温度刺激会对刺参机体产生损害,为了保护机体免受外界的损害,机体会产生较强的应激反应来对抗逆境。因此各项免疫酶指标会产生变化。由此可以推测,若这种变温刺激长时间持续下去,机体的免疫水平可能会受影响。
B组实验结果显示:幼参机体在最适生长温度18 ℃下的免疫及其相关酶活性(抗菌活力、SOD、AKP、ACP)较高,随温度突降至11 ℃其活性下降,再降至4 ℃后有所回升,但仍低于18 ℃下的免疫活性。且触手和体壁酶活力较高,波动较为明显,内脏和体腔液中免疫酶活力变化不大。分析其原因,可能是由于18 ℃是幼参最佳生理状态和免疫活性的合适温度,这一结果与董云伟等[12]的研究结果相一致,因此各项免疫酶活力较高。当温度突降至11 ℃,导致机体的生理功能和免疫防御能力下降,自由基代谢紊乱。再降至4 ℃,各项免疫酶活力略微上升,可能是免疫适应的结果。Yang[13]等在研究水温对刺参生长和摄食的影响时,发现低温会导致刺参体重下降和摄食缓慢。Vondracek[14]等研究发现变温会影响水生生物的代谢。因此降温作为一种环境刺激,会引起刺参机体免疫力的下降。而且两组试验结果显示,刺参在对温度胁迫的响应中,触手和体壁的免疫酶活性较高且变幅大,这与李华[15]等在研究仿刺参不同组织中免疫相关酶的活性及其周年变化时,对于正常刺参成体的研究结果一致,而体腔液和内脏样品中的免疫相关酶的活性变幅小。究其原因,可能是由于体壁和触手是抵御外来刺激的第一道防御屏障,对外界环境的变化比较敏感;但内脏中免疫酶的變化,需要一定时间的响应,因此变化不显著。
弧菌是刺参腐皮综合症的致病菌,对刺参养殖危害严重[16]。本研究的攻毒实验结果显示,经过3天的温度突变(18 ℃→11 ℃→4 ℃)后,再进行菌株感染。发现温度突变组,发病死亡率明显升高;而正常温度组,发病死亡率变化不大。说明温度突变作为一种环境胁迫,对刺参幼体抗病力造成了一定的影响。抗病力是反映机体免疫功能状态的综合性评价指标。这样的胁迫虽从刺参外表看不出异常,但对刺参幼体抗病力造成了一定的影响。
低温会使仿刺参幼参出现活动减弱,停止摄食等现象。而且长时间的低温变化会引起仿刺参幼体的皮肤溃烂、排脏或死亡[17],但低温对仿刺参生理影响还没有相关报道。Winton Cheng[18]等在研究温度变化对罗氏沼虾抗病力的影响时,发现高温会引起抗病力的下降。陈家长[19]等在研究温度胁迫对罗非鱼抗病力影响时,也得出高温引起抗病力下降的结论。因此,变温作为一种环境刺激,会导致抗病力的变化。
4 结论
综上所述,在A组试验中,免疫酶活力上升,体壁触手变化较显著;由此说明,快速而连续的温度波动,作为一种环境刺激,会引起仿刺参机体的免疫反应,增强仿刺参的非特异性免疫力。B组的试验,免疫酶出现急剧下降后略微上升的趋势,体壁触手波动显著;持续的降温,会使仿刺参非特异性免疫力下降,攻毒试验进一步证明,与对照组相比,经过温度突变处理后,抗病力明显下降。由此说明,温度的刺激,作为一种环境胁迫,能够引起仿刺参的非特异性免疫力下降,而且抗病力也下降。
因此在养殖和运输过程中,应尽量避免温度大幅度变化和持续波动,室外养参池应注意在变温季节及时调节水深以控制水温,防止因温度变化幅度过大或波动,影响刺参的正常生理功能,进而影响机体免疫力。
参考文献:
[1]
Dong Y,Dong S,Ji T.Effect of different thermal regimes on growth and physiological performance of the sea cucumber Apostichopus japonicus Selenka[J].Aquaculture,2008,275(1):329-334.
[2] 王晓燕,常亚青,丁君,等.降温对刺参免疫酶,可溶性蛋白及可溶性糖影响的初步研究[J].农学学报,2012,2(4):44-49.
[3] 董云伟,董双林.刺参对温度适应的生理生态学研究进展[J].中国海洋大学学报(自然科学版),2009 (5):908-912.
[4] 赵斌,李成林,胡炜,等.低温对不同规格刺参幼参生长与耗氧率的影响[J].海洋科学,2011(12):88-91.
[5] Hultmark D,Steiner H,Rasmuson T,et al.Insect immunity.Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia[J].European Journal of Biochemistry,1980,106(1):7-16.
[6] Coffaro K A,Hinegardner R T.Immune response in the sea urchin Lytechinus pictus[J].Science (New York,NY),1977,197(4311):1389.
[7] Coffaro K A.Transplantation immunity in the sea urchin[D].University of California,Santa Cruz.,1979.
[8] 劉衡,李光友.免疫多糖对养殖南美白对虾作用的研究[J].海洋与湖沼.1998,29(2):113-118
[9] 王淑红,王艺磊,张朝霞,等.弧菌和大肠杆菌感染对杂色鲍无细胞血淋巴中几种酶活力的影响[J].中国水产科学,2004(1):37-40.
[10] Le Moullac G,Haffner P.Environmental factors affecting immune responses in Crustacea[J].Aquaculture,2000(191):121-131.
[11] 刘伟,常亚青,丁君,等.温度缓降和骤降对刺参“水院 1 号”和大连养殖群体非特异性免疫影响的初步研究[J].水产学报,2013,37(9):1343-1348.
[12] 董云伟,董双林,张美昭,等.变温对刺参幼参生长、呼吸代谢及生化组成的影响[J].水产学报,2005,29(5):659 -665.
[13] Yang H,Yuan X,Zhou Y,et al.Effects of body size and water temperature on food consumption and growth in the sea cucumber Apostichopus japonicus (Selenka) with special reference to aestivation[J].Aquaculture Research,2005,36(11):1085-1092.
[14] Vondracek B,Cech Jr J J,Buddington R K.Growth,growth efficiency,and assimilation efficiency of the Tahoe sucker in cyclic and constant temperature[J].Environmental Biology of Fishes,1989,24(2):151-156.
[15] 李华, 陈静, 陆佳, 等. 仿刺参体腔细胞和血细胞类型及体腔细胞数量研究[J]. 水生生物学报, 2009, 33(2): 205-213.
[16] 张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1) :118-123.
[17] 李宝泉,杨红生,张涛,等.温度和体重对刺参呼吸和排泄的影响[J].海洋与湖沼,2002,33(2):182-187.
[18] Cheng W,Chen S M,Wang F I,et al.Effects of temperature,pH,salinity and ammonia on the phagocytic activity and clearance efficiency of giant freshwater prawn Macrobrachium rosenbergii to Lactococcus garvieae[J].Aquaculture,2003,219(1):111-121.
[19] 陈家长,臧学磊,瞿建宏,等.温度胁迫下罗非鱼 (GIFT Oreochromis niloticus) 机体免疫力的变化及其对海豚链球菌易感性的影响[J].农业环境科学学报,2011,30(9):1896-1901.

