薰衣草及其次生代谢产物的分子生物学研究概述
董世晨 侯一航 孙悦 任杏 苑泽宁
【摘 ? 要】 深入了解薰衣草分子生物学特性及其次生代谢产物分子生物学作用机理,有助于为培育薰衣草新品种和发挥薰衣草的功效提供理论参考。本文综述了薰衣草功能基因、遗传多样性及遗传转化等研究进展,介绍了薰衣草次生代谢产物分子组成及其影响因素,次生代谢产物发挥主要功效的分子机制,为深入开展薰衣草理论和实践研究提供参考和基础。
【关键词】 薰衣草;遗传多样性;遗传转化;次生代谢产物;分子生物学
中图分类号:Q949.99 ? ? ? ? ? ? ?文献识别码:A ? ? ? ? ? ? ? 文章编号:2096-1073(2020)05-0056-60
[Abstract] ?An in-depth understanding of the molecular biological characteristics of lavender and the molecular biological mechanism of its secondary metabolites would be helpful to provide theoretical reference for the cultivation of new lavender species and the exertion of lavender's efficacy. This paper summarizes the research progress of the functional genes, genetic diversity and genetic transformation of lavender and introduces the molecular composition and influencing factors of secondary metabolites of lavender, and the molecular mechanism by which secondary metabolites exert their main effects. These results provide reference and basis for further theoretical and practical research of lavender.
[Key words] lavender; genetic diversity; genetic transformation; secondary metabolite; molecular biology
薰衣草享有芳香之王的美譽,为唇形科薰衣草属(Lavandula)植物。自上世纪60年代引种以来,薰衣草在我国芳香产业发展中发挥着重要作用。但历经几十年的种植,薰衣草种群出现了品种混杂甚至退化的现象。薰衣草遗传多样性及遗传转化的研究有利于品种优化和培育,是薰衣草产业发展的重要基础。同时,其次生代谢产物功效的研究是加深和拓宽应用的重要前提。本文对薰衣草分子遗传学及其有效成分药理机制等进行了概述,以期为薰衣草在理论和实践上的深入研究提供参考。
1薰衣草分子遗传学研究
1.1薰衣草功能基因的研究
1.1.1薰衣草细胞核细胞质功能基因的研究作为芳香植物,薰衣草细胞内与芳香物质合成相关的功能基因较受研究者的青睐,如赵钟鑫等通过RT-PCR技术从阔叶薰衣草(Lavandula latifolia)叶片中克隆出芳樟醇合酶基因的cDNA序列,该序列全长为1809bp,编码602个氨基酸。通过比较该基因与Lllis的蛋白质二级结构,发现二者在整体上基本一致,但Lllis多一个α螺旋,故将薰衣草的其命名为Lslis,其具有芳樟醇合成酶活性必需的DDXXD功能基因。通过分析芳樟醇合酶序列、预测蛋白质二级结构和构建植物表达载体,为转基因表达的研究奠定了基础[1]。张雪荣在狭叶薰衣草(L. officinalis)中也发现了芳樟醇合成酶基因家族的cDNA 序列,将其命名为 Llis,并构建了 Llis 的植物转基因表达正义载体、植物转基因表达反义载体、原核表达载体,有望通过转基因技术,将克隆的香味植物关键酶基因转入到其他植物里[2],为充分利用薰衣草特有的香味基因改良其它物种提供了新的思路。
采用重新构建叶绿体基因组技术,合成了狭叶薰衣草(L. angustifolia)叶绿体全基因组,其基因组共有132个基因,其中有88个蛋白编码基因,8个核糖体RNA基因,37个转运RNA基因。环状叶绿体DNA大小为153,448bp,包含一对大小为25,632bp的反向重复序列(IR),一个较大的84,588bp大小的单拷贝序列(LSC)和一个较小的17,596bp大小的单拷贝序列(SSC)。根据叶绿体基因组成,经系统发育分析表明其与唇形科的Salvia miltiorrhiza具有较近的亲缘关系。为深入研究L. angustifolia叶绿体基因组的进化奠定了基础[3]。
1.1.2薰衣草DNA提取薰衣草DNA的获得是进行基因结构研究的重要前提,任艳利等对CTAB法进行了改良,通过在提取液中分别适量添加β-巯基乙醇和聚乙烯基吡咯烷酮,获得了L. pedunculata紫花薰衣草、蓝花薰衣草和白花薰衣草3个品种的高质量DNA[4]。随后,权俊萍等证明改良3×CTAB法是获得少量的高质量薰衣草DNA的理想途径[5]。郝俊蓉则采用RAPD技术提取薰衣草DNA,对其最佳反应体系进行分析,结合薰衣草DNA分子的多态性、植物学分类和化学成分分类,将薰衣草分为精油类和观赏类。并采用RAPD技术分析了精油类和观赏类薰衣草的遗传差异性,总结出精油类薰衣草花期短、花序长,精油成分主要是芳樟醇、乙酸芳樟酯、1,8-桉叶油素。观赏类花期长、花序短,精油成分以葑酮、樟脑、柠檬烯等为主,为薰衣草品种的选育、优化提供基础和依据[6]。
1.2薰衣草遗传多样性及遗传转化
自二十世纪六十年代薰衣草引种到我国,在种植过程中,天然杂交、基因突变等导致新性状的出现使薰衣草的遗传背景复杂化。同时,种植区薰衣草品种(系)命名不规范,影响了薰衣草优良新品种的创制和选育。摸清薰衣草种质资源的遗传多样性,是有效开发利用薰衣草的重要基础[7]。
1.2.1薰衣草遗传多样性RAPD和ISSR技术作为常用的DNA分子标记技术,可在DNA分子水平上反映出品种间的差异,能区分相近物种,检测外型极为相似的不同变种、变型、品系、化学型乃至个体之间的细微差异,准确判断品种间亲缘关系。张艳玲利用RAPD分析孟士德薰衣草 (L. angustifolia‘Munstead)、英国薰衣草( L. angustifolia)等10个薰衣草品种DNA分子多态性,结果表明各品种间遗传相似系数变化较大,多态性比率99.38%,说明薰衣草品种间具有较高的遗传多样性[8]。简铭锦通过ISSR构建指纹图谱,将薰衣草品种分为两类群,一类群属于齿叶薰衣草(Dentata)与狭叶薰衣草(Lavandula)组,另一类群属于羽叶薰衣草(Pterostoechas)与法国薰衣草(Stoechas)组,这种分类方式与叶型分类相一致[9]。苏秀娟等采用ISSR分析来自伊犁的19个品种(系)的薰衣草遗传多样性,结果表明新疆薰衣草种质资源具有较高的遗传多样性[10]。但是,郭丽丹等同样采用ISSR分析来自新疆建设兵团第四师的45个薰衣草品种,发现遗传多样性较低,亲缘关系较近[11]。上述结果表明,不同地区生长的薰衣草,遗传基础存在一定的差异,导致这种差异的因素有待深入研究。
此外,Garcia和Cervera 等报道薰衣草的遗传多样性还体现在染色体数目上,不同品种薰衣草的染色体数目变化较大,分别包含6、12、18、24、30、36、42、48、54条染色体[12,13]。狭叶薰衣草染色体数目的多态性表现为,细胞内的染色体可能包含36、48、50、54条[14]。对我国自主培育的新薰1号和新薰2号分析表明,新薰1号含有50条染色体,新薰2号则有48条,核型为4A型,进化程度较高[15]。黄珊珊对狭叶薰衣草(L. angustifolia)和羽叶薰衣草(L. pinnata)体细胞染色体分析表明,前者含有50条染色体,染色体组型为“2A”型,耐寒性较强,后者含有22条染色体,染色体组型为“2B”型,耐热性较强,从染色体组型上分析羽叶薰衣草比狭叶薰衣草较为进化[16]。
1.2.2薰衣草遗传转化遗传转化是充分利用和改良種质资源的重要途径。关于薰衣草遗传转化的研究,Dronne等在1999年用根癌农杆菌转化薰衣草叶片,筛选出EHA105菌株转化的植株达到最高转化率9%,首次证明薰衣草遗传转化的可行性[17]。Nebauer等用含ntpII(新霉素磷酸转移酶基因)和gusA基因的农杆菌菌株EHA105转化宽叶薰衣草(L. latifolia)的子叶盘和下胚轴,获得了抗β-葡萄糖醛酸酶活性和抗卡那霉素的抗性植株,证实gusA和nptII基因在转化两年后仍稳定表达[18]。国内外学者分别以薰衣草叶片和下胚轴为外植体,实现了较稳定的根癌农杆菌介导外源基因的薰衣草遗传转化[19,20]。
在获得稳定高效的薰衣草遗传转化体系基础上,我国学者为改良薰衣草性状进行深入研究,以孟士德薰衣草(L. angustifolia, cv. Munstead)的下胚轴和叶片为外植体,将scp (雪莲冷诱导蛋白)基因整合到薰衣草基因组中,阳性率分别为40%和35.3%,这为培育有抗寒基因的薰衣草品种,使薰衣草具有较强的耐寒性成为可能[21,22]。为提高薰衣草耐涝性,苏秀娟等利用根癌农杆菌介导的薰衣草(L. angustifolia)叶盘转化遗传转化,将vgb基因 (透明颤菌血红蛋白)成功导入到薰衣草体内,这为利用转基因技术改良薰衣草品种的实践提供了范例[23]。
除采用遗传转化技术改良薰衣草外,太空诱变育种也是薰衣草种质资源创新的快捷有效途径之一。如胡莲花等在2004年播种了搭载太空船进行太空育种的法国真薰衣草品系的种子,自2007~2013年,经反复扦插、扩繁、选育,发现19 种变异体,表明薰衣草的基因型对太空环境诱变比较敏感,并发现薰衣草诱变体之间精油化学组分差异明显,对精油主要化学组分进行了优化,使这种变异能够稳定遗传[24]。
2薰衣草次生代谢产物研究
2.1薰衣草次生代谢产物主要成分
2.1.1薰衣草次生代谢产物主要分子组成薰衣草次生代谢产物成分种类差异较大,通过GC-MS(气相色谱—质谱联用)分析云南薰衣草(Lavender)挥发油含有芳樟醇、乙酸芳樟酯、乙酸薰衣草酯、樟脑等近40种化合物,其典型性在于挥发油中的氧化芳樟醇含量很高,约占66.83%,这是与其他薰衣草的主要区别[25]。陈行烈等用GC-MS法从新疆伊犁薰衣草油中检测出了27 种化学成分,并用同样的方法测定出维吾尔医用印度薰衣草精油中检测出了36种化学成分[26]。刘勇民在《维吾尔药志》中明确列出了薰衣草油的21种化学成分[27]。
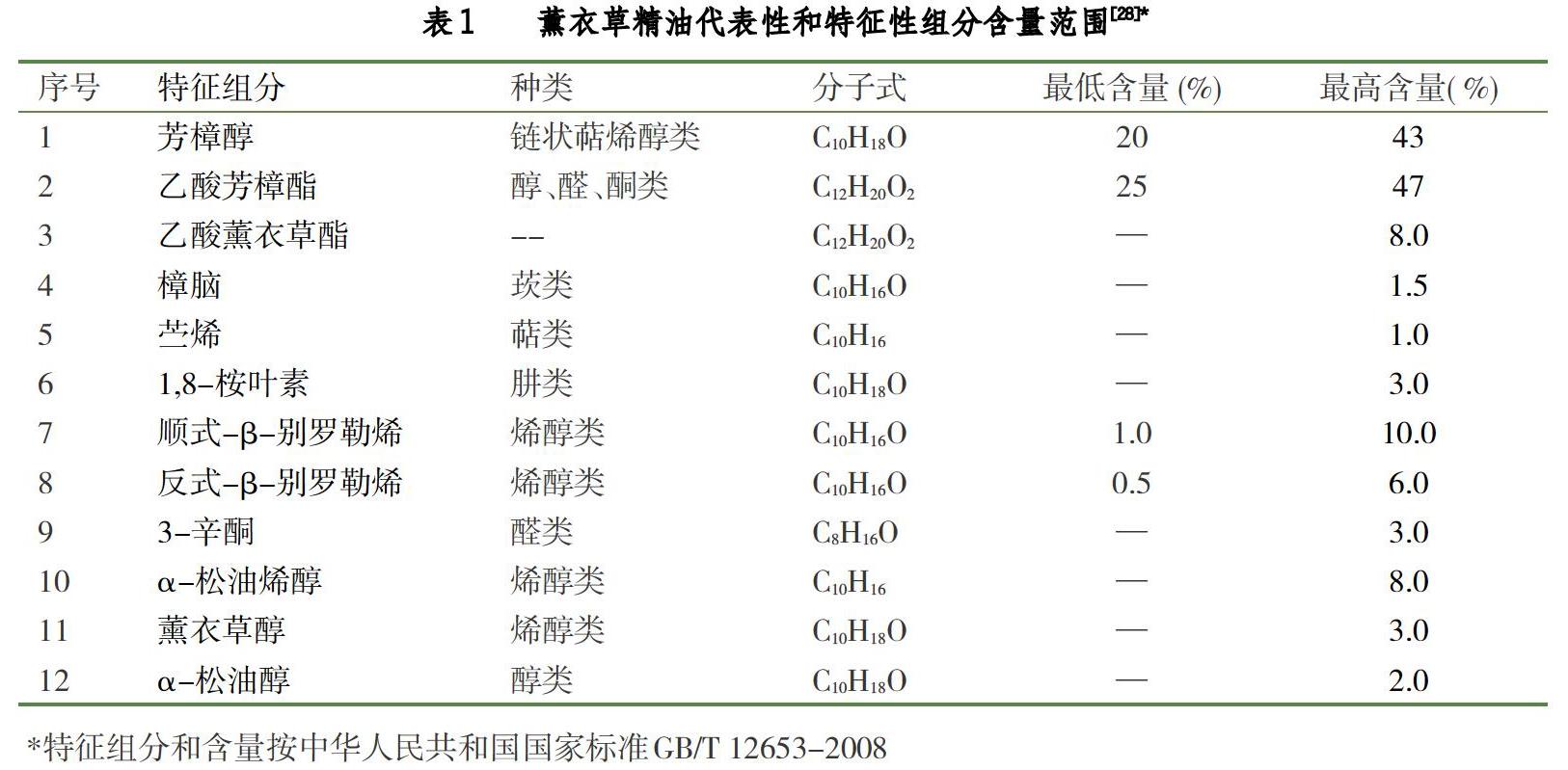
根据中国国家标准[28],从薰衣草(L. angustifolia Mill.)开花部分提取的精油,采用气相色谱—归一化法分析,代表性和特征性组分含量范围如表1所示。
2.1.2影响薰衣草次生代谢产物的主要因素生长不同的地区同一品种薰衣草次生代谢产物成分存在很大差异,如佳木斯地区薰衣草(L. angustifolia Mill.)精油中乙酸薰衣草酯、薰衣草醇、香叶醇、橙花醇、龙脑、反式石竹烯、反式金合欢烯的含量高于伊犁薰衣草(L.ottleinalis Chax)精油含量,这可能与东北特有的肥沃黑土土质有关[29,30]。此外,薰衣草次生代谢产物成分还与外源施用氮肥和磷肥等有关,当氮的浓度介于150mg~250mg/L、磷的浓度介于30 mg~70 mg/L时,薰衣草(L. angustifolia Mill.)精油产量表现差异不显著,但随着氮和磷浓度的变化,精油化学成分的含量有所变化,如α-萜品醇、α-没药醇、β-蒎烯、1-8桉树脑的含量随着氮、磷浓度的升高而升高,樟脑的含量却随着氮、磷浓度的升高而降低[31,32]。
利用体外微型繁殖得到的薰衣草,精油主要成分为芳樟醇(22.1%)、乙酸薰衣草酯(15.3 % )和乙酸芳樟酯(14.7 %),这三种物质是薰衣草的主要有效成分(表1)。而田间生长的薰衣草精油主要成分是T - cadnol (16.9~9.3 % )、冰片( 8.7~4.0 % )和3 -蒈烯( 8.7-8.6 % )。产生这些差异的主要原因是田间生长的植物受到环境、气候等因子的影响,同时也说明通过植物微繁技术可以大大提高薰衣草有效成分的收得率,为工业化开发提供了新思路和途径[33]。此外,薰衣草花瓣的含水量对含油率产生很大影响,薰衣草新鲜花瓣含油率约0.8%左右,干燥花瓣含油率约1.5%[34]。薰衣草的品种与花期对精油品质的影响较大,采收时段对油品质影响较小,为确定不同薰衣草品种采收期和薰衣草选育新品种工作提供了科学依据[35]。
2.2薰衣草次生代谢产物功效
薰衣草次生代谢产物药理作用主要体现在抗肿瘤、益智、抑菌驱虫、抗氧化、安神、抗焦虑等方面。
2.2.1抗肿瘤作用研究表明薰衣草提取物对人的肝癌细胞、肺癌细胞和鼻咽癌细胞均有遏制作用。其中,对人的鼻咽癌细胞生长的抑制率最高可达到98%以上。对比环磷酰胺和薰衣草提取物对实体瘤生长的影响,发现薰衣草的最大抑瘤率可达42.6 %,无明显副作用。薰衣草有效成分可诱导产生TNF-α、IL-6等细胞因子,进而诱导肿瘤细胞的坏死或凋亡,也可抑制或减少肿瘤组织新生血管的生成[36]。薰衣草可通过提高机体免疫功能而发挥其抗肿瘤作用[37],但薰衣草抑制肿瘤细胞生长的分子机制有待探究[38,39]。
2.2.2益智功效在薰衣草益智方面的作用,通过薰衣草活性成分对阿尔茨海默病认知障碍改善作用得以证实。薰衣草有效成分具有明显的神经保护及益智作用,其中芳樟醇能明显改善小鼠认知障碍,且精油中除芳樟醇外的其他益智活性成分也发挥作用。薰衣草中益智活性物质对神经保护作用与其抗氧化、抗细胞凋亡、增强神经可塑性、改善胆碱能神经系统活性相关。如芳樟醇通过激活PI3K/Akt-Nrf2-HO-l通路(磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)/核因子E2相关因子2(Nrf2)信号通路)来发挥抗氧化保护细胞的作用。进一步研究表明,薰衣草精油益智药效浓度不会使小鼠产生剂量依赖性,表明用药的安全性。基于薰衣草对改善阿尔茨海默病认知障碍表现出的潜力,有望将薰衣草开发为有效、安全的阿尔茨海默病防治药物[40]。
2.2.3抑菌作用薰衣草叶精油成分体外抗血吸虫作用和细胞毒性的研究表明,200 μg/ml薰衣草精油处理24h后,杀死全部供试成年曼氏血吸虫,其中,LC50(半致死)的浓度和时间分别为117.7μg/ml处理24 h,103.9 μg/ml处理120h。对曼氏血吸虫生殖产生影响的浓度和时间分别为浓度为25μg/ml处理120h,50 μg/ml 处理24h,可将成对的曼氏血吸虫分离,进而影响其繁殖。50 μg/ml的精油浓度对虫卵的发育产生抑制作用,使血吸虫运动活性显著降低。试验表明,薰衣草精油对血吸虫成虫和虫卵均具有一定的细胞毒性[41]。薰衣草的抑菌作用体现在芳樟醇类物质,芳樟醇具有抗大肠杆菌、葡萄球菌、黄曲霉菌、除臭等功效。薰衣草精油还可以抑制白念珠菌的活性,最佳抑制浓度有待深究,且其他抑菌实验也有待研究[42]。薰衣草茎、叶提取物对植物病原真菌有明显的抑制作用,其有效成分最小抑菌浓度低于百菌清和丁香酚的抑菌浓度。因此,薰衣草抗菌活性成分能高效抑制植物病原菌,为开发替代高毒、易残留农药的植物型抗菌剂奠定了科学基礎[43]。
2.2.4抗氧化作用经DPPH法和FRAP法测定,薰衣草的提取物具有高抗氧化活性,与提取物中多酚和黄酮含量高于其他香料植物密切相关[44]。薰衣草抗氧化活性可能会介导抗损伤作用,如薰衣草精油对缺血再灌注所致脑组织损伤具有保护作用[45-47]。薰衣草中的抗氧化物质还能增强人脐带系膜干细胞再生能力,可用于治疗脊髓损伤后的神经再生[48]。
2.2.5抗焦虑及降压作用薰衣草气味可降低牙科焦虑患者的焦虑情况,对非焦虑患者无影响[49]。薰衣草香气味能够改善急性胰腺炎患者焦虑、抑郁等负面情绪,提高护理满意度,建议在临床上推广应用[50]。薰衣草气味还可使原发性失眠患者的失眠情况得到改善[51]。
薰衣草精油可以使高血压患者MAP(平均动脉压)降低,其原理是通过嗅觉通路使血浆中 ALD、AngⅡ、PRA和NE的浓度下降,当薰衣草精油的浓度为1%时效果较明显,对心率没有影响,且作用时间久[52]。
3展望
作为名贵天然香料植物,薰衣草被引种到我国有近七十年的历史,随着薰衣草抗氧化、抗自由基理论的深入研究,天然、高效、低毒的薰衣草提取物的理化作用备受关注,开发芳香植物的特有价值成为研究的热点[53]。但由于国内某些品种的薰衣草精油的特征性组分和有效成份含量存在的差异含量,与国家现行的标准有差异,限制了其种植推广,这种差异决定了它们产品价值和市场竞争 力。因此制定新的薰衣草精油行业标准和进行薰衣草行业的规范是全面发展的基础[54]。
薰衣草活性成分药理作用的研究为医药行业深入开发利用薰衣草提供了科学依据,同时提取物及其单体化合物在抗肿瘤、神经保护等方面的作用机制还有待于突破。国内对于食品安全和健康的关注,使得薰衣草提取物走进人们的视野,未来有望在食品行业,康养领域的广泛应用。
参考文献:
[1] 赵钟鑫,王健,李琴,等. 阔叶薰衣草芳樟醇合成酶基因的克隆与表达载体构建[J]. 植物研究,2013,33(3):308-316.
[2] 张雪荣. 薰衣草芳樟醇合成酶的基因克隆、功能鉴定及转基因技术的研究[D]. 内蒙古农业大学, 2007.
[3] Lan Ma. The complete chloroplast genome sequence of the fra-grant plant Lavandula angustifolia (Lamiaceae) [J]. Mitochondrial?DNA Part B Resources, 2017,3(1): 135-136
[4] 任艳利,腊萍,张相峰,等. 改良CTAB法提取薰衣草基因组DNA研究[J].安徽农业科学,2011,39(22):13292-13293.
[5] 权俊萍, 贾晓鹰, 戴丽娜,等. 薰衣草高质量DNA提取及ISSR-PCR多重化体系的建立[J]. 生物技术通报,2012,5:151-157.
[6] 郝俊蓉. 精油类和观赏类薰衣草的植物学性状和精油成分对比研究[D].新疆农业大学,2006.
[7] 张晓燕. 金昌薰衣草的提取工艺研究2017,40(2):80-81
[8] 张艳玲,郝俊蓉,姚雷. 薰衣草亲缘关系的RAPD分析[J].上海交通大学学报:农业科学版,2007,25(6):578-582.
[9] 简铭锦. 利用ISSR及细胞质DNA标志探讨薰衣草品种之遗传歧异性[D]. 台湾大学, 2004.
[10] 苏秀娟,代培红,汤秋香,等.新疆薰衣草种质资源遗传多样性的ISSR分析[J].分子植物育种,2015,13(05):1130-1134.
[11] 郭丹丽,李敏,王自健,等. 基于ISSR标记的新疆伊犁薰衣草品种资源的遗传多样性分析[J].新疆農业科学,2016,53(04):716-720.
[12] Garcia, J. Contribuyo para o estudo cário-siste, mático dogenero Lavandula L [J]. Bo.l Soc. Brot. 1942,13: 183-193.
[13] Suárez-Cervera, M. Aportación a la cariología del género?Lavandula L[J]. Anales del Jardín Botánico de Madrid, 1986,42(2):389-394.
[14] Uhrikova, A., Ferakova, V. and Schwhrzova, T. IOPB Chromo-some Number Reports LXXX [J]. Taxon,1983, 32:504-511.
[15] 苏秀娟,汤秋香,邱娟,等. 新薰1号和新薰2号薰衣草核型分析[J].新疆农业大学学报,2015,38(03):212-215.
[16] 黄珊珊,廖景平. 狭叶薰衣草与羽叶薰衣草核型分析[J].园艺学报,2007,03:735-738.
[17] Dronne Sandrine, Moja Sandrine, Jullien Frédéric, et al.?Agrobacterium-mediated transformation of lavandin (Lavandu-lax intermedia Emeric ex Loiseleur) [J]. Transgenic Research,1999, 8(5):335-347.
[18] Sergio G. Nebauer, Isabel Arrillaga, Lucas del Castillo Agudo,?et al. Agrobacterium tumefaciens-mediated transformation of??the aromatic shrub Lavandula latifolia [J]. Molecular Breeding,2000, 6(6): 539-552.
[19] Jesus Mu?oz-Bertomeu, Isabel Arrillaga, Roc Ros, et al. Up--Regulation of 1-Deoxy-d-Xylulose-5-Phosphate SynthaseEnhances Production of Essential Oils in Transgenic Spike Lav-ender [J]. Plant Physiology, 2006, 142(3): 890-900.
[20] 邢文超,贠强,赵民安,等.薰衣草基因转化直接分化受体系统的建立[J].干旱区研究,2007,01:23-27.
[21] 邢文超,贠强,赵民安,等. 根癌农杆菌介导的雪莲冷诱导蛋白基因对薰衣草遗传转化的初步研究[J]. 植物生理学报,2006,42(5):862-866.
[22] 程娜. 农杆菌介导薰衣草转化体系的建立与冷诱导基因的导入[D]. 安徽农业大学, 2007.
[23] 苏秀娟,王莉萍,代培红,等. 英国薰衣草叶盘遗传转化体系的创建[J].新疆农业科学,2015,52(03):517-522.
[24] 胡莲花,李敏,刘兵,等. 太空诱变薰衣草精油成分分析鉴定[J].安徽农业科学,2014,42(14):4211-4212.
[25] 张春玲, 赵继飚, 张朝英,等. 用GC/MS分析云南薰衣草(Lav-ender)挥发油的化学成分[J]. 河南科学,1999,4:388-391.
[26] 陈行烈,翟建军. 新疆薰衣草精油化学成分的研究[J]. 新疆大学学报自然科学版,1991,4:81-84.
[27] 刘勇民. 维吾尔药志 [M]. 新疆科技卫生出版社,1999.
[28] 中华人民共和国国家标准中国薰衣草(精)油,2008.
[29] 廖祯妮.不同地区薰衣草引种与耐湿热研究 [D]. 湖南农业大学,2014.
[30] 王仲,高宇,高洪福,等.不同产地薰衣草花中精油化学成分分析[J].北方园艺,2017,06:140-143.

