刺五加叶药物成分脑内代谢动力学及治疗脑缺血作用的在线微透析—质谱分析
王倩倩+张艳 孟璐璐+皮子凤+刘舒+宋凤瑞+刘志强

摘 要 考察了刺五加叶中金丝桃苷和1,5-二咖啡酰奎宁酸入脑及脑内代谢动力学过程,同时评价刺五加叶对脑缺血大鼠脑内神经递质的影响。结扎大鼠双侧颈总动脉构建急性不完全性脑缺血模型,利用在线微透析-液相色谱-串联质谱法,ACE 5 C18-AR液相色谱柱等度洗脱,MRM负离子模式下监测金丝桃苷和1,5-二咖啡酰奎宁酸在健康及缺血大鼠脑内代谢动力学差异,正离子模式检测不同组别大鼠脑内谷氨酸(Glu)、天冬氨酸(Asp)、γ-氨基丁酸(GABA)、乙酰胆碱(Ach)、5-羟色胺(5- )、多巴胺(DA)6种神经递质含量。实验结果表明,在线方法线性良好(R2>0.99),准确度、精密度满足分析要求;金丝桃苷和1,5-二咖啡酰奎宁酸均能透过血脑屏障到达脑部,代谢迅速,在缺血大鼠脑内吸收降低,消除加快;相比模型大鼠,预防性刺五加叶给药7天后,缺血大鼠脑内氨基酸类神经递质Glu、Asp、GABA和单胺类神经递质DA的水平显著降低(p<0.01),Ach水平显著升高(p<0.05)。
关键词 刺五加叶; 脑缺血; 神经递质; 在线微透析-质谱
1 引 言
脑血管病是威胁人类健康与生命的主要疾病之一,其中缺血性脑血管病占到了80%以上[1]。缺血发生时,脑组织能量衰竭,出现线粒体功能紊乱、酸中毒、水肿、钙泵失调等现象,继而引发Ca2+超载、毒性自由基生成增多、神经递质释放失衡和细胞凋亡[2]。各因素间相互联系,互为因果,形成瀑布样级联反应,严重损伤患者神经系统。胆碱能神经递质乙酰胆碱(Ach)、单胺类神经递质多巴胺(DA)和5-羟色胺(5- )、兴奋性氨基酸谷氨酸(Glu)、天门冬氨酸(Asp)和抑制性氨基酸γ-氨基丁酸(GABA)在多项神经生理活动中发挥作用广泛,表现活跃。这些神经递质的体内水平变化与多种神经元功能紊乱与神经系统疾病[3 ~ 5]相关。
刺五加系五加科植物刺五加[Acanthopanax senticosus (Rupr.et Maxim.)Harms]的干燥根和根茎或茎[6],其叶也可作药用。研究表明,刺五加叶中含丰富的黄酮、皂苷及有机酸类活性成分,具有保护心脑血管、抗肿瘤、降血压、抑制CYP450活性等药理作用[7]。文献报道,刺五加叶中以金丝桃苷为代表的黄酮提取物对DPPH和·OH具有良好的清除能力[8]。有机酚酸1,5-二咖啡酰奎宁酸(1,5-diCQA)可通过激活Erk激酶上调细胞内源性抗氧化系统,减轻1-甲基-4-苯基吡啶离子(MPP+)诱导的PC12细胞氧化应激损伤[9]。目前,关于刺五加叶治疗实验性脑缺血的研究已有报道。研究发现,刺五加叶皂苷能够显著改善脑缺血大鼠血液流变学及血小板功能异常[10],提高脑组织超氧化物歧化酶活性,降低丙二醛、Ca2+及乳酸水平[11];刺五加叶总黄酮联合电针治疗能提高B细胞淋巴瘤/白血病-2蛋白表达,减少脑缺血区域细胞凋亡的发生[12],但有关刺五加叶对缺血大鼠脑内神经递质影响的研究还未见明确报道。本研究采用结扎大鼠双侧颈总动脉构建急性不完全性脑缺血模型[13],利用所搭建的微透析-质谱在线分析平台[14]实现正、负不同离子模式下对缺血大鼠脑内内源性神经递质和外源性药物成分的同时、实时、连续监测,真实反映其在脑缺血病理状态下的脑内变化情况,简化了样品处理过程。
2 实验部分
2.1 仪器与试剂
ACQUITYTM UPLC系统,Xevo TQ 三级四极杆质谱仪(美国Waters公司),ACE 5 C18-AR液相色谱柱(150 mm × 4.6mm)。微透析系统:CMA 402灌注器推进泵、CMA120动物清醒活动装置、MAB6脑微透析探针(透析膜长4 mm,截留分子量15000 Da)、ASI脑定位仪、自组装在线进样器。
5-羟色胺(5- )、多巴胺(DA)、谷氨酸(Glu)、天门冬氨酸(Asp)、γ-氨基丁酸(GABA)和乙酰胆碱(Ach)均购于Sigma-Aldrich公司;金丝桃苷(Hyperoside,中国药品生物制品检定所);1,5-二咖啡酰奎宁酸(1,5-diCQA,成都普瑞法科技开发有限公司,批号:D090617);刺五加叶提取物(实验室制注射用冻干粉)。乙腈(HPLC级,Fisher公司);乙酸(HPLC级,Tedia公司);超纯水(Milli-Q系统,Millipore公司)。人工脑脊液(aCSF,pH 7.4)由1.2 mmol/L CaCl2, 2.0 mmol/L Na2HPO4·12H2O, 1.0 mmol/L MgCl2, 2.7 mmol/L KCl和145 mmol/L NaCl 配制而成。
2.2 实验过程
2.2.1 动物实验
雄性Wistar大鼠(240~280 g)40只,随机分为4组,分别为对照组、脑缺血模型组、刺五加叶给药组(140 mg/kg),对照药曲克芦丁组(50 mg/kg),尾静脉给药,每日一次,以上剂量均按照人体临床用药剂量折算。给药7天后于海马区埋入探针套管,次日进行脑缺血手术。为同时进行药代动力学研究,缺血手术后按剂量给药,并立即在线微透析采样、检测。
微透析采样:在大鼠海马区(A: 5.6 mm,L: 4.6 mm,V: 4.6 mm)[15]埋入探针套管,次日插入脑探针,1.0 μL/min灌流aCSF平衡90 min,待脑缺血手术后立即采样并在线检测,采样间隔20 min,连续采集180 min。
急性不完全性脑缺血模型:大鼠以戊巴比妥钠(40 mg/kg, ip)麻醉,分离双侧颈总动脉,双线分别结扎,对照组只分离双侧颈总动脉不结扎。
2.2.2 标准溶液配制
精密称取8种待测物对照品,金丝桃苷和1,5-咖啡酰奎宁酸以甲醇溶解,神经递质以超纯水溶解,分别制成1.0 mg/mL的单标储备液。用aCSF-乙腈(4∶1, V/V)配制浓度为50.0 μg/mL的混合标准溶液,稀释成不同浓度的标准工作液。
2.2.3 色谱及质谱条件
色谱条件:柱温为室温;流动相组成为20% A相(乙腈)和80% B相(0.5%乙酸溶液)等度洗脱,流速0.5 mL/min;进样量: 20 μL。
质谱条件:多反应监测(MRM)模式,刺五加叶中2种成分在负离子(-)模式下检测,6种神经递质在正离子(+)模式下检测,源温150℃,毛细管电压2.0 kV(-)/3.0 kV(+),脱溶剂气温度400 ℃(-)/350℃(+),脱溶剂气流速800L/h(-)/700L/h (+)。各待测物质谱参数见表1。表1 8种待测物的MRM质谱参数
3 结果与讨论
3. 1 方法学考察
3. 1. 1 线性范围及检出限、定量限
配制系列混合标准工作液,外标法定量,以待测物浓度为横坐标,定量离子对峰面积为纵坐标得到各待测物线性回归方程,所得相关系数(R2)均大于0.99,S/N≥3确定方法检出限(LOD),S/N≥10确定定量限(LOQ),所得结果见表2。
3.1.2 准确度、精密度和基质效应 选取各待测物线性范围内高、中、低浓度水平标样添加于人工脑脊液中,每个浓度重复5次,于3日内测得日内及日间准确度(RE,%)和精密度(RSD,%)。结果表明,8种待测物的日内准确度和精密度范围分别在1.11%~10.80%和0.01%~14.40%,日间准确度和精密度范围分别为0.08%~14.82%和
14.30%~0.26%,满足生物样品分析要求。
在流动相溶液A/B(1∶4, V/V)中添加高、中、低浓度对照品,制得溶剂标样;向空白大鼠脑透析液中同样添加以上浓度对照品制,得基质标样。空白大鼠脑透析液中含有一定浓度神经递质待测物,基质效应(ME)的计算公式:
ME(%)=(Amatrix-Asample)Astandard×100 (1)
式中,Amatrix为基质标样峰面积, Asample为脑透析液中待测物峰面积, Astandard为溶剂中标样峰面积。据此得到8种待测物的ME范围在88.4%~113.6%之间,表明透析液基质对待测物无明显干扰。
3.2 金丝桃苷和1,5-二咖啡酰奎宁酸脑内代谢动力学分析
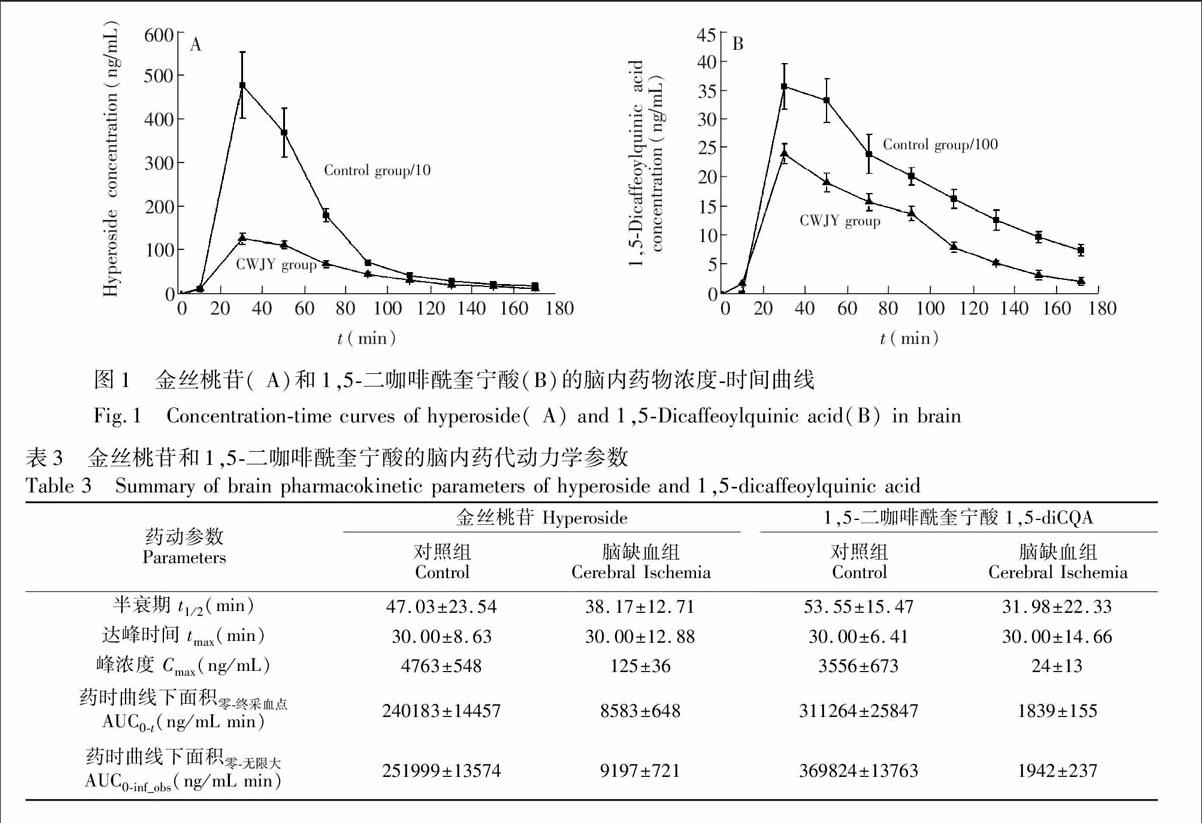
利用微透析-质谱在线分析平台监测了金丝桃苷和1,5-二咖啡酰奎宁酸,比较二者在对照组及缺血大鼠脑内的代谢动力学差异,并利用PKSolver软件进行了数据分析。图1为金丝桃苷和1,5-二咖啡酰奎宁酸的脑内药物浓度-时间曲线。
由图1可见,金丝桃苷和1,5-二咖啡酰奎宁酸能够顺利透过血脑屏障到达脑部,且代谢过程迅速,入脑后约0.5 h即达峰值,3 h内基本代谢完全。表3列出了二者在对照组及脑缺血大鼠脑内的药代动力学参数, t1/2代表半衰期,Cmax 和tmax分别代表最大血药浓度及达到此浓度的时间,AUC0-t代表零时间到最终采血点的浓度-时间曲线下面积,AUC0-inf_obs代表零时间到无限大时间的浓度-时间曲线下面积[16]。
金丝桃苷和1,5-二咖啡酰奎宁酸的药代动力学参数在对照组及缺血大鼠脑内呈现出了显著变化。t1/2在临床上多用于反映药物从体内消除速度的快慢,相比对照组,金丝桃苷和1,5-二咖啡酰奎宁酸在缺血大鼠脑内的t1/2有所降低,表明二者在缺血大鼠脑内消除速度加快;Cmax和tmax是反映药物体内吸收速率的两个指标,AUC是评价药物吸收程度的重要指标,给药后约0.5 h药物浓度即达峰值,说明二者能够迅速透过血脑屏障到达脑部;二者在缺血大鼠脑内的Cmax及AUC明显降低,表明脑缺血的发生影响了刺五加叶中药物成分的脑内代谢,推测可能是大鼠脑缺血后血液流动被阻断或缓流,在缺血缺氧病理状态下机体转运能力降低导致。
3.3 刺五加叶治疗脑缺血的作用评价
刺五加叶中有效成分能够顺利到达脑部,为进一步探究其治疗脑缺血的作用机制,利用所搭建的微透析-质谱在线分析平台同时检测了对照组、脑缺血模型组、刺五加叶给药组和曲克芦丁组大鼠末次给药后3 h内海马区6种神经递质水平,经前期测定的探针回收率[17]校正后,所得结果见图2。
由图2可见,缺血引发了大鼠脑内的神经递质紊乱,Glu,Asp,GABA,DA和5- 在缺血3 h内海马区水平显著高于对照组(p<0.01),Ach水平显著降低(p<0.01)。Glu与Asp是兴奋性氨基酸(EAAs),尤其Glu是中枢神经系统中主要的兴奋性神经递质。Glu储存于神经元末梢的突触囊泡中,以Ca2+依赖的方式释放到突触间隙中,正常状态下,大部分Glu会经再摄取重新回到细胞内,只有小部分发挥兴奋性神经递质作用,用于信号传递。但在脑缺血状态下,大量Ca2+内流,必然引发Glu的过度释放使谷氨酸受体处于持续兴奋状态,导致神经元死亡,引发神经毒性[18]。给药刺五加叶大鼠在缺血后Glu水平显著低于模型大鼠(p<0.01),推测可能是一定程度上缓解了Ca2+大量内流,发挥了钙通道阻滞剂的作用。GABA为主要的抑制性神经递质,可以对突触后神经元起抑制保护作用,同时也可抑制突触前神经元Glu的释放。本研究发现,缺血大鼠脑内GABA的水平显著升高(p<0.01),推测可能是由于缺血早期Glu水平显著升高,GABA发挥了代偿性拮抗作用。但GABA的过度释放也会导致细胞内GABA耗竭,使细胞内源性抑制降低,神经元兴奋-抑制失衡,继而引发迟发性神经元死亡[19]。Ach是促进学习记忆、维持觉醒的重要神经递质。通常在脑梗塞恢复期或多发性脑梗塞痴呆的治疗方案中会增加Ach量以改善认知能力[20]。DA和5- 是主要的单胺类神经递质,二者在缺血大鼠脑内含量显著增高,一方面,由于缺血时大量Ca2+内流,导致其释放量增加;另一方面,缺血引发脑内能量耗竭递质重摄取受阻,且降解单胺类神经递质的单胺氧化酶(MAO)活性降低。文献[21]报道,单胺类神经递质能够对缺血神经元造成直接损伤,并能促进兴奋性神经递质的释放,增加N-甲基-D-天门冬氨酸(NMDA)的敏感性,进一步促进Ca2+的大量内流。预防性给药刺五加叶提取物及阳性对照药曲克芦丁,缺血大鼠脑内6种神经递质的水平紊乱得到不同程度改善。刺五加叶中有效药物成分迅速透过血脑屏障到达大鼠脑部发挥作用,显著降低了缺血大鼠脑内Glu、Asp、GABA和DA的水平(p<0.01),升高了Ach的水平(p<0.05)。相比对照药曲克芦丁,刺五加叶对氨基酸类神经递质具有更好的调节作用。
以所测得的神经递质含量作为统计变量,采用偏最小二乘判别分析法(PLS-DA)通过得分图对样本进行整体评价。在图3中,椭圆区域代表95%置信区间内,每点代表一个生物样本,对照组和脑缺血模型组间能够明显区分,表明缺血后大鼠海马区的神经递质水平发生了显著改变;刺五加叶及曲克芦丁组能与缺血模型组良好区分,说明预防性给药刺五加叶提取物及曲克芦丁后能有效调节缺血引发的神经递质紊乱,对缺血导致的神经损伤起到了保护作用。
4 结 论
刺五加叶中药物成分金丝桃苷和1,5-二咖啡酰奎宁酸能够成功透过血脑屏障到达脑部发挥作用,并能够有效缓解由缺血引发的神经递质水平紊乱,尤其对氨基酸类神经递质,其调节作用优于阳性对照药曲克芦丁,表明刺五加叶具有较好的神经保护作用。本研究实现了对内源性及外源性物质在不同离子监测模式下的同时、实时、连续检测,从调节神经递质角度研究了刺五加叶对脑缺血的治疗作用,对开展药效学及药物代谢过程的体内研究具有借鉴意义。
References
1 LIU Qing-Qing, GUO Hong, WANG Shao-Xia, LI Mei-Jiao, LIU Yang. Chinese Archives of Traditional Chinese Medicine, 2012, 30(6): 1228-1230
刘青青, 郭 虹, 王少峡, 李美娇, 刘 洋. 中华中医药学刊, 2012, 30(6): 1228-1230
2 Siesjo B K. J. Neurosurg., 1992, 77(3): 337-354
3 Lanari A, Amenta F, Silvestrelli G, Tomassoni D, Parnetti L. Mech. Ageing. Dev., 2006, 127(2): 158-165
4 SONG Cai-Yong, YU Li, LI Xue-Yan, FANG Liang-Lian, CHEN Yao-Ru, GAO Hong-Chang, LIN Li. Chinese Journal of Analysis Laboratory, 2011, 30(8): 80-83
宋才勇, 余 莉, 李雪艳, 方亮莲, 陈瑶如, 高红昌, 林 丽. 分析试验室, 2011, 30(8): 80-83
5 Krzysciak W. Acta Biochim. Polon., 2011, 58(4): 461-466
6 Chinese Pharmacopoeia Commission, Chinese Pharmacopoeia, 2010, China Medical Science Press, Beijing, 2010: 192
中国药典委员会, 中华人民共和国药典 (2010版), 北京:中国医药科技出版社, 2010: 192
7 BI Yun-Feng, ZHU Hong-Bin, PI Zi-Feng, LIU Zhi-Qiang, SONG Feng-Rui.Chem. J. Chinese Universities, 2013, 34(5): 1067-1071
毕云枫, 朱洪彬, 皮子凤, 刘志强, 宋凤瑞. 高等学校化学学报, 2013, 34(5): 1067-1071
8 LIU Wen-Chuang, LIU Chun-Ming, LU Juan, WANG Duo. Liaoning Journal of Traditional Chinese Medicine, 2011, 38(8): 1622-1625
刘文闯, 刘春明, 陆 娟, 王 铎. 辽宁中医杂志, 2011, 38(8): 1622-1625
9 CAO Xu, XIAO Hai-Bin, LI Hui, SUN Sheng-Gang, CHU Xiao-Fan. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2010, 39(4): 435-438
曹 旭, 肖海兵, 李 慧, 孙圣刚, 褚晓凡. 华中科技大学学报: 医学版, 2010, 39(4): 435-438
10 JIANG Hong-Yu, SUI Da-Yuan, YU Xiao-Feng, QU Shao-Chun, XU Hua-Li, WANG Zhi-Cai, CHEN Yan-Ping. Journal of Jilin University(Medicine Edition), 2004, 30(3): 384-386
姜红玉, 睢大员, 于晓风, 曲绍春, 徐华丽, 王志才, 陈燕萍. 吉林大学学报: 医学版, 2004, 30(3): 384-386
11 SUI Da-Yuan, YU Xiao-Feng, QU Shao-Chun, XU Hua-Li, WANG Zhi-Cai, CHEN Yan-Ping. Chinese Traditonal Drug, 2005, 36(4): 561-563
睢大员, 于晓风, 曲绍春, 徐华丽, 王志才, 陈燕萍. 中草药, 2005, 36(4): 561-563
12 ZHANG Xiao-Li, SHI Xue-Kui, CAI Wen-Hui, WANG Ya-Xian. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(5): 177-180
张晓莉, 石学魁, 蔡文辉, 王亚贤. 中国实验方剂学杂志, 2011, 17(5): 177-180
13 XIN Qin, LI Xiu-Fang, SI Duan-Yun, LIU Shan-Ting, DAI Wei-Juan. Traditional Chinese Medicine Patent Prescription, 2004, 26(3): 222-224
辛 勤, 李秀芳, 司端运, 刘善庭, 戴伟娟. 中成药, 2004, 26(3): 222-224
14 WANG Qian-Qian, ZHANG Jing, PI Zi-Feng, LIU Shu, SONG Feng-Rui, LIU Zhi-Qiang. Chinese J. Anal Chem., 2014, 42(7): 997-1001
王倩倩, 张 静, 皮子凤, 刘 舒, 宋凤瑞, 刘志强. 分析化学, 2014, 42(7): 997-1001
15 CHEN Wen-Zhen, WANG Kai-Yan, HONG Zhen, L Chuan-Zhen. Chinese Journal of Neuroanatomy, 2008, 24(4): 425-428
陈文珍, 王开颜, 洪 震, 吕传真. 神经解剖学杂志, 2008, 24(4): 425-428
16 WANG Guang-Ji. Pharmacokinetics, Beijing: Chemical Industry Press, Beijing, 2005: 95-97
王广基. 药物代谢动力学, 北京:化学工业出版社, 2005: 95-97
17 Wang Q Q, Zhang J, Pi Z F, Zheng Z, Xing J P, Song F R, Liu S, Liu Z Q. Anal. Methods, 2015, 7(1): 45-52
18 MEI He-Shan, WANG Yong-Li. Chinese Pharmacological Bulletin, 2005, 21(4): 393-396
梅和珊, 王永利. 中国药理学通报, 2005, 21(4): 393-396
19 ZHAN Yong, HAN Zhong-Yan. Stroke and Nervous Diseases, 1999, 6(6): 30-32
张 勇, 韩仲岩. 卒中与神经疾病, 1999, 6(6): 30-32
20 XING Hong-Yi, WANG Cai-Yuan, GUAN Xin-Min. Acta Universitatis Medicinae TongJi, 1999, 28(4): 322-325
邢宏义, 王才源, 关新民. 同济医科大学学报, 1999, 28(4): 322-325
21 MENG Qiang. Foreign Medical Sciences Cerebrovascular Diseases, 1998, 6(2): 7-10
孟 强. 单胺类神经递质与缺血性脑损伤. 国外医学(脑血管疾病分册), 1998, 6(2): 7-10



摘 要 考察了刺五加叶中金丝桃苷和1,5-二咖啡酰奎宁酸入脑及脑内代谢动力学过程,同时评价刺五加叶对脑缺血大鼠脑内神经递质的影响。结扎大鼠双侧颈总动脉构建急性不完全性脑缺血模型,利用在线微透析-液相色谱-串联质谱法,ACE 5 C18-AR液相色谱柱等度洗脱,MRM负离子模式下监测金丝桃苷和1,5-二咖啡酰奎宁酸在健康及缺血大鼠脑内代谢动力学差异,正离子模式检测不同组别大鼠脑内谷氨酸(Glu)、天冬氨酸(Asp)、γ-氨基丁酸(GABA)、乙酰胆碱(Ach)、5-羟色胺(5- )、多巴胺(DA)6种神经递质含量。实验结果表明,在线方法线性良好(R2>0.99),准确度、精密度满足分析要求;金丝桃苷和1,5-二咖啡酰奎宁酸均能透过血脑屏障到达脑部,代谢迅速,在缺血大鼠脑内吸收降低,消除加快;相比模型大鼠,预防性刺五加叶给药7天后,缺血大鼠脑内氨基酸类神经递质Glu、Asp、GABA和单胺类神经递质DA的水平显著降低(p<0.01),Ach水平显著升高(p<0.05)。
关键词 刺五加叶; 脑缺血; 神经递质; 在线微透析-质谱
1 引 言
脑血管病是威胁人类健康与生命的主要疾病之一,其中缺血性脑血管病占到了80%以上[1]。缺血发生时,脑组织能量衰竭,出现线粒体功能紊乱、酸中毒、水肿、钙泵失调等现象,继而引发Ca2+超载、毒性自由基生成增多、神经递质释放失衡和细胞凋亡[2]。各因素间相互联系,互为因果,形成瀑布样级联反应,严重损伤患者神经系统。胆碱能神经递质乙酰胆碱(Ach)、单胺类神经递质多巴胺(DA)和5-羟色胺(5- )、兴奋性氨基酸谷氨酸(Glu)、天门冬氨酸(Asp)和抑制性氨基酸γ-氨基丁酸(GABA)在多项神经生理活动中发挥作用广泛,表现活跃。这些神经递质的体内水平变化与多种神经元功能紊乱与神经系统疾病[3 ~ 5]相关。
刺五加系五加科植物刺五加[Acanthopanax senticosus (Rupr.et Maxim.)Harms]的干燥根和根茎或茎[6],其叶也可作药用。研究表明,刺五加叶中含丰富的黄酮、皂苷及有机酸类活性成分,具有保护心脑血管、抗肿瘤、降血压、抑制CYP450活性等药理作用[7]。文献报道,刺五加叶中以金丝桃苷为代表的黄酮提取物对DPPH和·OH具有良好的清除能力[8]。有机酚酸1,5-二咖啡酰奎宁酸(1,5-diCQA)可通过激活Erk激酶上调细胞内源性抗氧化系统,减轻1-甲基-4-苯基吡啶离子(MPP+)诱导的PC12细胞氧化应激损伤[9]。目前,关于刺五加叶治疗实验性脑缺血的研究已有报道。研究发现,刺五加叶皂苷能够显著改善脑缺血大鼠血液流变学及血小板功能异常[10],提高脑组织超氧化物歧化酶活性,降低丙二醛、Ca2+及乳酸水平[11];刺五加叶总黄酮联合电针治疗能提高B细胞淋巴瘤/白血病-2蛋白表达,减少脑缺血区域细胞凋亡的发生[12],但有关刺五加叶对缺血大鼠脑内神经递质影响的研究还未见明确报道。本研究采用结扎大鼠双侧颈总动脉构建急性不完全性脑缺血模型[13],利用所搭建的微透析-质谱在线分析平台[14]实现正、负不同离子模式下对缺血大鼠脑内内源性神经递质和外源性药物成分的同时、实时、连续监测,真实反映其在脑缺血病理状态下的脑内变化情况,简化了样品处理过程。
2 实验部分
2.1 仪器与试剂
ACQUITYTM UPLC系统,Xevo TQ 三级四极杆质谱仪(美国Waters公司),ACE 5 C18-AR液相色谱柱(150 mm × 4.6mm)。微透析系统:CMA 402灌注器推进泵、CMA120动物清醒活动装置、MAB6脑微透析探针(透析膜长4 mm,截留分子量15000 Da)、ASI脑定位仪、自组装在线进样器。
5-羟色胺(5- )、多巴胺(DA)、谷氨酸(Glu)、天门冬氨酸(Asp)、γ-氨基丁酸(GABA)和乙酰胆碱(Ach)均购于Sigma-Aldrich公司;金丝桃苷(Hyperoside,中国药品生物制品检定所);1,5-二咖啡酰奎宁酸(1,5-diCQA,成都普瑞法科技开发有限公司,批号:D090617);刺五加叶提取物(实验室制注射用冻干粉)。乙腈(HPLC级,Fisher公司);乙酸(HPLC级,Tedia公司);超纯水(Milli-Q系统,Millipore公司)。人工脑脊液(aCSF,pH 7.4)由1.2 mmol/L CaCl2, 2.0 mmol/L Na2HPO4·12H2O, 1.0 mmol/L MgCl2, 2.7 mmol/L KCl和145 mmol/L NaCl 配制而成。
2.2 实验过程
2.2.1 动物实验
雄性Wistar大鼠(240~280 g)40只,随机分为4组,分别为对照组、脑缺血模型组、刺五加叶给药组(140 mg/kg),对照药曲克芦丁组(50 mg/kg),尾静脉给药,每日一次,以上剂量均按照人体临床用药剂量折算。给药7天后于海马区埋入探针套管,次日进行脑缺血手术。为同时进行药代动力学研究,缺血手术后按剂量给药,并立即在线微透析采样、检测。
微透析采样:在大鼠海马区(A: 5.6 mm,L: 4.6 mm,V: 4.6 mm)[15]埋入探针套管,次日插入脑探针,1.0 μL/min灌流aCSF平衡90 min,待脑缺血手术后立即采样并在线检测,采样间隔20 min,连续采集180 min。
急性不完全性脑缺血模型:大鼠以戊巴比妥钠(40 mg/kg, ip)麻醉,分离双侧颈总动脉,双线分别结扎,对照组只分离双侧颈总动脉不结扎。
2.2.2 标准溶液配制
精密称取8种待测物对照品,金丝桃苷和1,5-咖啡酰奎宁酸以甲醇溶解,神经递质以超纯水溶解,分别制成1.0 mg/mL的单标储备液。用aCSF-乙腈(4∶1, V/V)配制浓度为50.0 μg/mL的混合标准溶液,稀释成不同浓度的标准工作液。
2.2.3 色谱及质谱条件
色谱条件:柱温为室温;流动相组成为20% A相(乙腈)和80% B相(0.5%乙酸溶液)等度洗脱,流速0.5 mL/min;进样量: 20 μL。
质谱条件:多反应监测(MRM)模式,刺五加叶中2种成分在负离子(-)模式下检测,6种神经递质在正离子(+)模式下检测,源温150℃,毛细管电压2.0 kV(-)/3.0 kV(+),脱溶剂气温度400 ℃(-)/350℃(+),脱溶剂气流速800L/h(-)/700L/h (+)。各待测物质谱参数见表1。表1 8种待测物的MRM质谱参数
3 结果与讨论
3. 1 方法学考察
3. 1. 1 线性范围及检出限、定量限
配制系列混合标准工作液,外标法定量,以待测物浓度为横坐标,定量离子对峰面积为纵坐标得到各待测物线性回归方程,所得相关系数(R2)均大于0.99,S/N≥3确定方法检出限(LOD),S/N≥10确定定量限(LOQ),所得结果见表2。
3.1.2 准确度、精密度和基质效应 选取各待测物线性范围内高、中、低浓度水平标样添加于人工脑脊液中,每个浓度重复5次,于3日内测得日内及日间准确度(RE,%)和精密度(RSD,%)。结果表明,8种待测物的日内准确度和精密度范围分别在1.11%~10.80%和0.01%~14.40%,日间准确度和精密度范围分别为0.08%~14.82%和
14.30%~0.26%,满足生物样品分析要求。
在流动相溶液A/B(1∶4, V/V)中添加高、中、低浓度对照品,制得溶剂标样;向空白大鼠脑透析液中同样添加以上浓度对照品制,得基质标样。空白大鼠脑透析液中含有一定浓度神经递质待测物,基质效应(ME)的计算公式:
ME(%)=(Amatrix-Asample)Astandard×100 (1)
式中,Amatrix为基质标样峰面积, Asample为脑透析液中待测物峰面积, Astandard为溶剂中标样峰面积。据此得到8种待测物的ME范围在88.4%~113.6%之间,表明透析液基质对待测物无明显干扰。
3.2 金丝桃苷和1,5-二咖啡酰奎宁酸脑内代谢动力学分析
利用微透析-质谱在线分析平台监测了金丝桃苷和1,5-二咖啡酰奎宁酸,比较二者在对照组及缺血大鼠脑内的代谢动力学差异,并利用PKSolver软件进行了数据分析。图1为金丝桃苷和1,5-二咖啡酰奎宁酸的脑内药物浓度-时间曲线。
由图1可见,金丝桃苷和1,5-二咖啡酰奎宁酸能够顺利透过血脑屏障到达脑部,且代谢过程迅速,入脑后约0.5 h即达峰值,3 h内基本代谢完全。表3列出了二者在对照组及脑缺血大鼠脑内的药代动力学参数, t1/2代表半衰期,Cmax 和tmax分别代表最大血药浓度及达到此浓度的时间,AUC0-t代表零时间到最终采血点的浓度-时间曲线下面积,AUC0-inf_obs代表零时间到无限大时间的浓度-时间曲线下面积[16]。
金丝桃苷和1,5-二咖啡酰奎宁酸的药代动力学参数在对照组及缺血大鼠脑内呈现出了显著变化。t1/2在临床上多用于反映药物从体内消除速度的快慢,相比对照组,金丝桃苷和1,5-二咖啡酰奎宁酸在缺血大鼠脑内的t1/2有所降低,表明二者在缺血大鼠脑内消除速度加快;Cmax和tmax是反映药物体内吸收速率的两个指标,AUC是评价药物吸收程度的重要指标,给药后约0.5 h药物浓度即达峰值,说明二者能够迅速透过血脑屏障到达脑部;二者在缺血大鼠脑内的Cmax及AUC明显降低,表明脑缺血的发生影响了刺五加叶中药物成分的脑内代谢,推测可能是大鼠脑缺血后血液流动被阻断或缓流,在缺血缺氧病理状态下机体转运能力降低导致。
3.3 刺五加叶治疗脑缺血的作用评价
刺五加叶中有效成分能够顺利到达脑部,为进一步探究其治疗脑缺血的作用机制,利用所搭建的微透析-质谱在线分析平台同时检测了对照组、脑缺血模型组、刺五加叶给药组和曲克芦丁组大鼠末次给药后3 h内海马区6种神经递质水平,经前期测定的探针回收率[17]校正后,所得结果见图2。
由图2可见,缺血引发了大鼠脑内的神经递质紊乱,Glu,Asp,GABA,DA和5- 在缺血3 h内海马区水平显著高于对照组(p<0.01),Ach水平显著降低(p<0.01)。Glu与Asp是兴奋性氨基酸(EAAs),尤其Glu是中枢神经系统中主要的兴奋性神经递质。Glu储存于神经元末梢的突触囊泡中,以Ca2+依赖的方式释放到突触间隙中,正常状态下,大部分Glu会经再摄取重新回到细胞内,只有小部分发挥兴奋性神经递质作用,用于信号传递。但在脑缺血状态下,大量Ca2+内流,必然引发Glu的过度释放使谷氨酸受体处于持续兴奋状态,导致神经元死亡,引发神经毒性[18]。给药刺五加叶大鼠在缺血后Glu水平显著低于模型大鼠(p<0.01),推测可能是一定程度上缓解了Ca2+大量内流,发挥了钙通道阻滞剂的作用。GABA为主要的抑制性神经递质,可以对突触后神经元起抑制保护作用,同时也可抑制突触前神经元Glu的释放。本研究发现,缺血大鼠脑内GABA的水平显著升高(p<0.01),推测可能是由于缺血早期Glu水平显著升高,GABA发挥了代偿性拮抗作用。但GABA的过度释放也会导致细胞内GABA耗竭,使细胞内源性抑制降低,神经元兴奋-抑制失衡,继而引发迟发性神经元死亡[19]。Ach是促进学习记忆、维持觉醒的重要神经递质。通常在脑梗塞恢复期或多发性脑梗塞痴呆的治疗方案中会增加Ach量以改善认知能力[20]。DA和5- 是主要的单胺类神经递质,二者在缺血大鼠脑内含量显著增高,一方面,由于缺血时大量Ca2+内流,导致其释放量增加;另一方面,缺血引发脑内能量耗竭递质重摄取受阻,且降解单胺类神经递质的单胺氧化酶(MAO)活性降低。文献[21]报道,单胺类神经递质能够对缺血神经元造成直接损伤,并能促进兴奋性神经递质的释放,增加N-甲基-D-天门冬氨酸(NMDA)的敏感性,进一步促进Ca2+的大量内流。预防性给药刺五加叶提取物及阳性对照药曲克芦丁,缺血大鼠脑内6种神经递质的水平紊乱得到不同程度改善。刺五加叶中有效药物成分迅速透过血脑屏障到达大鼠脑部发挥作用,显著降低了缺血大鼠脑内Glu、Asp、GABA和DA的水平(p<0.01),升高了Ach的水平(p<0.05)。相比对照药曲克芦丁,刺五加叶对氨基酸类神经递质具有更好的调节作用。
以所测得的神经递质含量作为统计变量,采用偏最小二乘判别分析法(PLS-DA)通过得分图对样本进行整体评价。在图3中,椭圆区域代表95%置信区间内,每点代表一个生物样本,对照组和脑缺血模型组间能够明显区分,表明缺血后大鼠海马区的神经递质水平发生了显著改变;刺五加叶及曲克芦丁组能与缺血模型组良好区分,说明预防性给药刺五加叶提取物及曲克芦丁后能有效调节缺血引发的神经递质紊乱,对缺血导致的神经损伤起到了保护作用。
4 结 论
刺五加叶中药物成分金丝桃苷和1,5-二咖啡酰奎宁酸能够成功透过血脑屏障到达脑部发挥作用,并能够有效缓解由缺血引发的神经递质水平紊乱,尤其对氨基酸类神经递质,其调节作用优于阳性对照药曲克芦丁,表明刺五加叶具有较好的神经保护作用。本研究实现了对内源性及外源性物质在不同离子监测模式下的同时、实时、连续检测,从调节神经递质角度研究了刺五加叶对脑缺血的治疗作用,对开展药效学及药物代谢过程的体内研究具有借鉴意义。
References
1 LIU Qing-Qing, GUO Hong, WANG Shao-Xia, LI Mei-Jiao, LIU Yang. Chinese Archives of Traditional Chinese Medicine, 2012, 30(6): 1228-1230
刘青青, 郭 虹, 王少峡, 李美娇, 刘 洋. 中华中医药学刊, 2012, 30(6): 1228-1230
2 Siesjo B K. J. Neurosurg., 1992, 77(3): 337-354
3 Lanari A, Amenta F, Silvestrelli G, Tomassoni D, Parnetti L. Mech. Ageing. Dev., 2006, 127(2): 158-165
4 SONG Cai-Yong, YU Li, LI Xue-Yan, FANG Liang-Lian, CHEN Yao-Ru, GAO Hong-Chang, LIN Li. Chinese Journal of Analysis Laboratory, 2011, 30(8): 80-83
宋才勇, 余 莉, 李雪艳, 方亮莲, 陈瑶如, 高红昌, 林 丽. 分析试验室, 2011, 30(8): 80-83
5 Krzysciak W. Acta Biochim. Polon., 2011, 58(4): 461-466
6 Chinese Pharmacopoeia Commission, Chinese Pharmacopoeia, 2010, China Medical Science Press, Beijing, 2010: 192
中国药典委员会, 中华人民共和国药典 (2010版), 北京:中国医药科技出版社, 2010: 192
7 BI Yun-Feng, ZHU Hong-Bin, PI Zi-Feng, LIU Zhi-Qiang, SONG Feng-Rui.Chem. J. Chinese Universities, 2013, 34(5): 1067-1071
毕云枫, 朱洪彬, 皮子凤, 刘志强, 宋凤瑞. 高等学校化学学报, 2013, 34(5): 1067-1071
8 LIU Wen-Chuang, LIU Chun-Ming, LU Juan, WANG Duo. Liaoning Journal of Traditional Chinese Medicine, 2011, 38(8): 1622-1625
刘文闯, 刘春明, 陆 娟, 王 铎. 辽宁中医杂志, 2011, 38(8): 1622-1625
9 CAO Xu, XIAO Hai-Bin, LI Hui, SUN Sheng-Gang, CHU Xiao-Fan. Acta Medicinae Universitatis Scientiae et Technologiae Huazhong, 2010, 39(4): 435-438
曹 旭, 肖海兵, 李 慧, 孙圣刚, 褚晓凡. 华中科技大学学报: 医学版, 2010, 39(4): 435-438
10 JIANG Hong-Yu, SUI Da-Yuan, YU Xiao-Feng, QU Shao-Chun, XU Hua-Li, WANG Zhi-Cai, CHEN Yan-Ping. Journal of Jilin University(Medicine Edition), 2004, 30(3): 384-386
姜红玉, 睢大员, 于晓风, 曲绍春, 徐华丽, 王志才, 陈燕萍. 吉林大学学报: 医学版, 2004, 30(3): 384-386
11 SUI Da-Yuan, YU Xiao-Feng, QU Shao-Chun, XU Hua-Li, WANG Zhi-Cai, CHEN Yan-Ping. Chinese Traditonal Drug, 2005, 36(4): 561-563
睢大员, 于晓风, 曲绍春, 徐华丽, 王志才, 陈燕萍. 中草药, 2005, 36(4): 561-563
12 ZHANG Xiao-Li, SHI Xue-Kui, CAI Wen-Hui, WANG Ya-Xian. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(5): 177-180
张晓莉, 石学魁, 蔡文辉, 王亚贤. 中国实验方剂学杂志, 2011, 17(5): 177-180
13 XIN Qin, LI Xiu-Fang, SI Duan-Yun, LIU Shan-Ting, DAI Wei-Juan. Traditional Chinese Medicine Patent Prescription, 2004, 26(3): 222-224
辛 勤, 李秀芳, 司端运, 刘善庭, 戴伟娟. 中成药, 2004, 26(3): 222-224
14 WANG Qian-Qian, ZHANG Jing, PI Zi-Feng, LIU Shu, SONG Feng-Rui, LIU Zhi-Qiang. Chinese J. Anal Chem., 2014, 42(7): 997-1001
王倩倩, 张 静, 皮子凤, 刘 舒, 宋凤瑞, 刘志强. 分析化学, 2014, 42(7): 997-1001
15 CHEN Wen-Zhen, WANG Kai-Yan, HONG Zhen, L Chuan-Zhen. Chinese Journal of Neuroanatomy, 2008, 24(4): 425-428
陈文珍, 王开颜, 洪 震, 吕传真. 神经解剖学杂志, 2008, 24(4): 425-428
16 WANG Guang-Ji. Pharmacokinetics, Beijing: Chemical Industry Press, Beijing, 2005: 95-97
王广基. 药物代谢动力学, 北京:化学工业出版社, 2005: 95-97
17 Wang Q Q, Zhang J, Pi Z F, Zheng Z, Xing J P, Song F R, Liu S, Liu Z Q. Anal. Methods, 2015, 7(1): 45-52
18 MEI He-Shan, WANG Yong-Li. Chinese Pharmacological Bulletin, 2005, 21(4): 393-396
梅和珊, 王永利. 中国药理学通报, 2005, 21(4): 393-396
19 ZHAN Yong, HAN Zhong-Yan. Stroke and Nervous Diseases, 1999, 6(6): 30-32
张 勇, 韩仲岩. 卒中与神经疾病, 1999, 6(6): 30-32
20 XING Hong-Yi, WANG Cai-Yuan, GUAN Xin-Min. Acta Universitatis Medicinae TongJi, 1999, 28(4): 322-325
邢宏义, 王才源, 关新民. 同济医科大学学报, 1999, 28(4): 322-325
21 MENG Qiang. Foreign Medical Sciences Cerebrovascular Diseases, 1998, 6(2): 7-10
孟 强. 单胺类神经递质与缺血性脑损伤. 国外医学(脑血管疾病分册), 1998, 6(2): 7-10

