发酵豆粕和酶解鱼粉对刺参免疫力的影响
郝永丰 许迪亮 李明

摘要:研究在饲料中按一定比例添加发酵豆粕和酶解鱼粉对刺参幼苗(Apostichopus ja ponicus)酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LSZ)、超氧化物歧化酶(SOD)活性的影响。于投喂后第60d后检测ACP、AKP、LSZ与SOD活性。结果显示,总体上分析用发酵豆粕替代豆粕比用酶解鱼粉替代鱼粉对刺参幼苗ACP、AKP的影响要显著。单独分析单一因素,各添加组ACP、AKP活性较不添加组均有不同程度的升高,其中用发酵豆粕替代100%大豆粕组与用酶解鱼粉替代50%鱼粉组效果最佳。发酵豆粕组与酶解鱼粉组对LSZ活性的影响没有显著差异。其发酵豆粕各个替代组较不替代组LSZ的活力都有不同程度的升高,其中替代75%组最为明显(P<0.05)。酶解鱼粉各个替代组较不替代组也有不同程度的升高,但差异不显著。总体上分析发酵豆粕组与酶解鱼粉组对SOD活性的影响没有显著差异。两者不同替代组较不替代组SOD的活性都有不同程度的升高,但都不显著。研究表明发酵豆粕和酶解鱼粉替代饲料中的大豆粕和鱼粉对刺参幼参的免疫力都有不同程度增强作用。
关键词:刺参幼苗;发酵豆粕;酶解鱼粉;酸性磷酸酶(ACP);碱性磷酸酶(AKP);溶菌酶(LSZ);超氧化物歧化酶(SOD)
1 材料与方法
1.1 实验材料
实验所用的刺参平均体重为(3.4±0.26)~(4.5±0.26)g/头。投喂人工配合饲料,基础配方见表1。室内饲养期间用遮光板控制光照强度,水温人工控制,饲养期间平均水温变化在(13.0±0.5)~(15.0±0.5)℃之间。
酶解鱼粉的制备参考Buchmann等和Mohr的方法,采用双酶(胰蛋白酶和木瓜蛋白酶)降解法。以进口鳕鱼为原料酶解获得水解产物干燥而成。通过测定α-氨态氮含量(甲醛滴定法),最终计算得蛋白水解度在60%,粗蛋白含量为65.0%(占干物质),粗脂肪的含量为5.2%(占干物质)。
发酵豆粕制备参照HongKJ的方法。干燥的豆粕浸泡60min,在温度为60~70℃蒸汽罐里煮1h,然后在室温下冷却1h,接种枯草芽孢杆菌和嗜酸乳酸杆菌进行发酵,发酵产物在50~60℃干燥3d,粉碎使用,粗蛋白含量43%。
1.2 实验设计
1.2.1 实验条件 饲养实验将240头刺参分为16组,每组15头称重后随即装入带有编号的16个养殖水箱中(90L/箱),编号分别为1~16号。将编号水箱围养殖池(60m3)圆形排列,向池中加水至池中水面低于箱中水面3~5cm,打开水阀使池中形成定向水流。控制水位使各箱水温相差不超过0.3℃,且水箱中水温与池中水温差距在0.5℃以内,保证实验水箱中的水温相对恒定。养殖海水为经沉淀过滤的海水,由泵房每天监测调节水温,将养殖池水温控制在13~15℃。每天下午14:30开始吸底,换水1/3,换水后进行投喂饲料,饱食投喂,投喂量在5%~10%(吸底时有残余饵料)。视水质情况5~7d刷洗一次水箱。饲养期间DO≥4.0mg/L;NH4+-N≤0.1mg/L;pH=8.2~8.3,饲养期间不充气。
1.2.2 实验分组 用发酵豆粕以不同比例(0%,50%,75%,100%)替代刺参基础饲料中的豆粕,用酶解鱼粉以不同比例(0%,25%,50%,75%)代替饲料中的鱼粉。发酵豆粕各组分别记录为a1、a2、a3、a4组,酶解鱼粉各组分别记录为b1、b2、b3、b4组。基础饲料配方如表1。实验采用正交试验的方法以减少试验的单元数。实验设计为二因素四水平的正交实验,所以采用L16(45)正交表。实验饲料的分组方案和正交实验表,见表1、2和表3。
1.3 样品制备
饲养实验结束后,实验刺参幼参经3d停食处理后,收集刺参,对每个实验单元的幼参进行称重。然后取样后于冰浴中,用注射器从腹部插入海参体内,小心拉动注射器进行抽取,每个个体抽取海参体腔液2mL。离心(12000r/min,4℃,20min),取上清液备用,4℃保存。
1.4 测定方法
1.4.1 SOD活性测定 采用的连苯三酚自氧化法。向内径1cm比色杯中分别加入3mL磷酸钾盐缓冲液,20μL酶粗液,10μL邻苯三酚。在320nm处,每隔30s记录吸光值,连续读数90s。以10μL邻苯三酚混合3mL磷酸缓冲液测定连苯三酚自氧化速率,自氧化速率控制O.060~0.070A/min之间。
酶活单位定义:每毫克蛋白每min抑制邻苯三酚自氧化速率达50%的酶量定义为一个酶活单位,以U表示。
式中:U·mL-1:SOD酶活力单位;
AA320:连苯三酚自氧化速率;
△A320:样液抑制连苯三酚自氧化速率;
V:反应液总体积,mL;
V:所加样液体积,mL;
D:样液稀释倍数。
总活力(U·mg-1)一单位体积活性(U·mL-1)×原液体积(mL)/样品质量(mg)
1.4.2 酸性磷酸酶测定(用ACP测定试剂盒) 取三个洁净试管,分别作为测定管、标准管和空白管。按表4进行操作。
立即混匀,室温静置10min,于520nm,1cm光径,空白管调零,测各管吸光度值。
定义:100mL体腔液上清液在37℃与基质作用30min产生1mg的酚为1个活力单位(U)。
1.4.3 溶菌酶测定(比浊法)
操作步骤:(1)将配制好的应用菌液,标准应用液及体腔液上清液均放人37℃水浴箱中预热5min,使菌液、标准液和体腔液上清液的温度达到37℃。
(2)取20支试管放入水浴箱中,在试管中各加应用菌液2mL,继续水浴。
(3)取3只1cm光径的比色皿,在可见光分光光度计上530nm处,用蒸馏水调透光度100%,然后倒掉蒸馏水。
(4)将标准应用液及样本0.2mL分别加入洗干净的比色皿底部,然后快速将37℃水浴箱中预温试管里的2mL应用菌液迅速倒入装有0.2mL样本的比色皿中,(也可用5mL大加样器吸取以37℃预温的应用菌液加入比色皿中)。在将37℃预温的2mL应用菌液倒入比色皿的同时同步地按下秒表,于反应5秒时读出并记录下透光度T0值,比色皿不要取出,在2分零5秒时再读一次透光度值并记录下T2值。
计算公式:
溶菌酶含量(μg/mL)=(测定管透光度UT2[注2]-测定管透光度UT0[注1]/标准管透光度ST2[注4]-标准管透光度ST0[注3])×标准管浓度×样本测定前稀释浓度
[注1]UT0为测定管加应用菌液反应5秒钟时的透光度。
[注2]UT2为测定管加应用菌液反应2分零5秒钟时的透光度
[注3]ST0为标准管加应用菌液反应5秒钟时的透光度
[注4]ST2为标准管加应用菌液反应2分零5秒时的透光度
1.5 数据处理与方差分析
数据用SPSS16.0软件进行方差分析和协方差分析,结果以平均值表示,当P<0.05时认为差异显著,当P>0.05时认为差异不显著。
2 结果
2.1 两种蛋白质对刺参AOP活性的影响
以发酵豆粕和酶解鱼粉不同比例替代刺参基础饲料中的大豆粕和鱼粉饲养60d后,其各个单元的ACP测定结果如表5中的ACP的活力。用SPSS16.0软件对表5中ACP活力进行分析,发酵豆粕对刺参ACP酶活力的影响极显著(p<0.01),酶解鱼粉对其活力的影响不显著(p>0.05)。从分析结果可以看出用发酵豆粕来替代基础饲料中的植物蛋白大豆粕蛋白比用酶解鱼粉代替基础饲料中的动物蛋白鱼粉对刺参ACP的影响更显著,两者之间有显著差异。
2.1.1 发酵豆粕对ACP的影响 对发酵豆粕这个因素用SPSS16.0软件对表5中的ACP值进行方差分析,由图1可知发酵豆粕替代大豆粕各组在60d后ACP活性比不替代组都有所增强。其中100%替代豆粕组ACP活性的增强效果极显著(p<0.01),其它各组虽有增强但效果不显著(p>0.05)。
2.1.2 酶解鱼粉对ACP的影响 对酶解鱼粉这个因素用SPSS16.0软件对表5中的ACP值进行协方差分析,由图2可知酶解鱼粉替代鱼粉各组在60d后ACP活力都比不替代组有所增强。其中50%替代鱼粉组ACP活力的增强效果显著(p<0.05),其它各组虽有增强但效果不显著(p>0.05)。
2.2 两种蛋白质对刺参AKP活性的影响
以发酵豆粕和酶解鱼粉不同比例替代刺参幼苗基础饲料中的大豆粕和鱼粉饲养60d后,其各个单元的AKP测定结果如表5中的AKP的活力。用SPSS16.0软件对表5中AKP活力进行分析,发酵豆粕对刺参AKP酶活力的影响显著(p>0.05),酶解鱼粉对其AKP酶活力的影响不显著(p>0.05)。
2.2.1 发酵豆粕对AKP的影响 对发酵豆粕这个因素用SPSS16.0软件对对表5中的AKP值进行协方差分析,由图3可知发酵豆粕替代豆粕各组在60d后,除50%替代组外,AKP活性都比不替代组有所增强。其中100%替代豆粕组AKP活性的增强效果显著(p<0.05),其它各组虽有增强但效果不显著(p>0.05)。
2.2.2 酶解鱼粉对AKP的影响 对酶解鱼粉这个因素用SPSS16.0软件对对表5中的AKP值进行协方差分析,由图4可知酶解鱼粉替代鱼粉各组在60d后AKP活性都比不替代组有所增强。其中50%替代鱼粉组AKP活性的增强效果显著(p<0.05),其它各组虽有增强但效果不显著(p>0.05)
2.3 两种蛋白质对刺参LSZ活性的影响
以发酵豆粕和酶解鱼粉不同比例替代刺参基础饲料中的大豆粕和鱼粉饲养60d后,其各个单元的LSZ测定结果如表5。用SPSS16.0软件对表5中LSZ活力进行分析,发酵豆粕和酶解鱼粉对刺参LSZ活力的影响都不显著(p>0.05)
2.3.1 发酵豆粕对LSZ的影响 对发酵豆粕这个因素用SPSS16.0软件对对表5中的LSZ值进行协方差分析,由图5可知发酵豆粕替代大豆粕各组在60d后,LSZ活性都比不替代组有所增强,其中75%替代组效果显著(p<0.05)其它各组虽都有增强但效果不显著(p>0.05)。
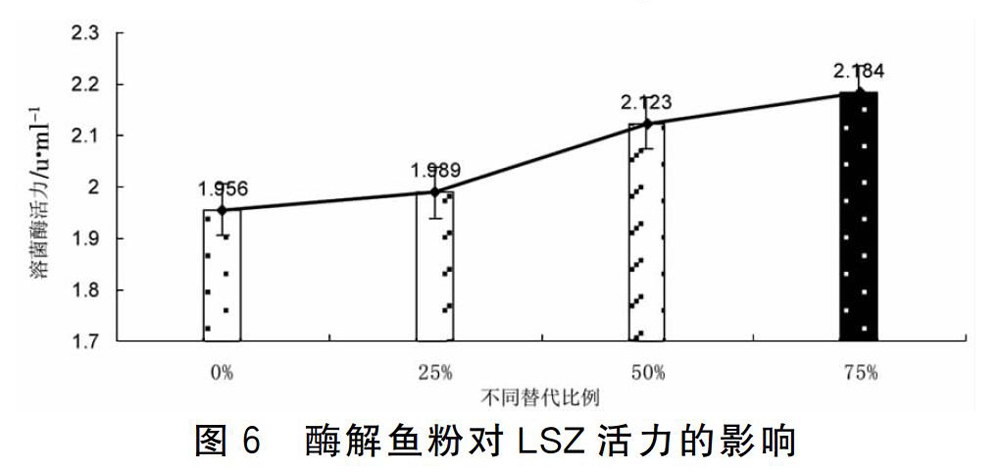
2.3.2 酶解鱼粉对LSZ的影响 对酶解鱼粉这个因素用SPSS16.0软件对表5中的LSZ值进行协方差分析,由图6可知酶解鱼粉代鱼粉各组在60d后,LSZ活性都比不替代组有所增强,各替代组虽都有增强但效果不显著(p>0.05)
2.4 两种蛋白质对刺参SOD活性的影响
以发酵豆粕和酶解鱼粉不同比例替代刺参基础饲料中的大豆粕和鱼粉饲养60d后,其各个单元的SOD测定结果如表5中的SOD的活力。用SPSS16.0软件对表5中SOD活力进行分析,发酵豆粕对刺参SOD酶活力的影响不显著(p>0.05),酶解鱼粉对其SOD酶活力影响也不显著(p>0.05)
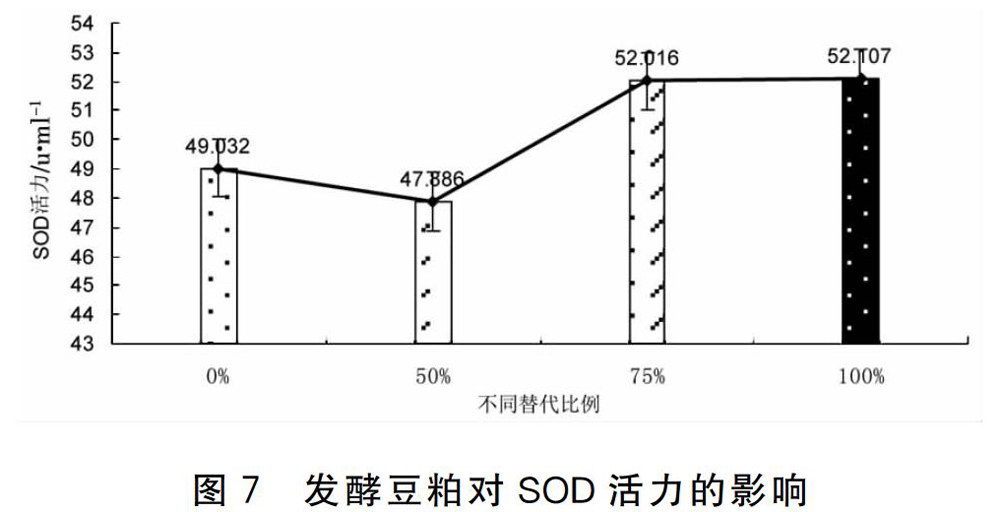
2.4.1 发酵豆粕对SOD的影响 对发酵豆粕这个因素用SPSS16.0软件对表5的SOD值进行协方差分析,由图7可知发酵豆粕替代豆粕各组在60d后,除50%替代组外,各替代组SOD活性都比不替代组有所增强,各组虽都有增强但效果不显著(p>0.05)。
2.4.2 酶解鱼粉对SOD的影响 对酶解鱼粉这个因素用SPSS16.0软件对表5中的SOD值进行协方差分析,由图8可知酶解鱼粉替代鱼粉各组在60d后,SOD活性都比不替代组有所增强,各组虽都有增强但效果不显著(p>0.05)。
3 讨论
3.1 关于免疫酶的作用
ACP是巨噬细胞溶酶体的标志酶,也是巨噬细胞内最有代表性的水解酶之一。吞噬是巨噬细胞的典型功能之一,巨噬细胞吞噬异物颗粒形成吞噬体,然后用包括ACP在内的溶解酶消化异物颗粒。用ACP的活性表示吞噬细胞清除异物的能力。结果表明,用发酵豆粕和酶解鱼粉分别替代刺参幼参饲料中的豆粕和鱼粉都能提高ACP的活性。两者从整体上比较用发酵豆粕代替豆粕的效果要比用酶解鱼粉代替鱼粉明显。单独分析各不同替代组,效果最好的为用发酵豆粕100%替代豆粕组和用酶解鱼粉替代75%鱼粉组。这与Meng等认为ACP可以被外源刺激物激活的结论相吻合。刘树青等用海藻多糖刺激中国对虾(Penaeus chinensis)也得到了相似的结论,即海藻多糖可显著提高ACP活性;牟海津等研究证实栉孔扇贝(Chlamys irregularis)经口服海藻多糖免疫增强剂后,血清中的ACP活性显著升高;这与本实验的结果相似,说明发酵豆粕和酶解鱼粉对ACP活性的增强与免疫多糖有类似的作用。
AKP普遍存在于动植物体内,是一种对底物专一性要求较低的磷酸单脂水解酶,是重要的解毒系统,在碱性条件下,可使磷酸单脂水解生成乙醇和磷酸,并与一些营养物质的消化吸收有关。本研究结果表明,用发酵豆粕和酶解鱼粉分别替代刺参幼参饲料中的豆粕和鱼粉都能提高AKP的活性。两者从总体上相比较用发酵豆粕代替豆粕的效果要比用酶解鱼粉代替鱼粉明显。不同替代组中效果最好的为用发酵豆粕100%替代豆粕组和用酶解鱼粉替代75%鱼粉组。
LSZ是吞噬细胞杀菌的物质基础,是一种碱性蛋白,可通过水解革兰氏阳性细菌细胞壁中的乙酰氨基多糖破坏和消除侵入体内的异物,从而担负起机体防御的功能。本研究结果表明,用发酵豆粕和酶解鱼粉分别替代刺参幼参饲料中的豆粕和鱼粉都能提高LSZ的活性。两者从整体上比较用发酵豆粕代替豆粕的效果与用酶解鱼粉代替鱼粉对LSZ的影响没有明显差异。发酵豆粕不同替代组中效果最好的为用发酵豆粕75%替代豆粕组(p<0.05),效果显著。酶解鱼粉不同替代组较不替代组都有不同程度的提高,但是经SPSS16.0分析效果不显著(p>0.05)。
SOD是一种重要的抗氧化酶,作为活性氧清除剂参与清除体内自由基,可以加速从O2-转变成H2O2和O2的反应,在防机体衰老及防生物分子损伤等方面具有极为重要的作用。有研究报道,SOD活性与生物的免疫水平密切相关,对于增强吞噬细胞的防御能力和整个机体的免疫功能有重要的作用。本研究结果表明,两者从整体上比较用发酵豆粕代替豆粕的效果与用酶解鱼粉代替鱼粉对SOD的影响没有明显差异。除50%替代组外,发酵豆粕各个替代组较不替代组SOD活性有所提高,但效果不显著(p>0.05)。酶解鱼粉各个替代组较不替代组SOD活性也都有所提高,但效果也不显著(p>0.05)。
3.2 发酵豆粕对免疫力的影响
以上结果显示发酵豆粕和酶解鱼粉对刺参免疫酶都有一定的促进作用,其作用效果与其它免疫增强剂有相近的效果。很多学者研究表明发酵豆粕对养殖动物的免疫力有增强作用,如陈萱等在商品配合饲料中额外添加发酵豆粕,饲养异育银鲫成鱼30d,发现随着发酵豆粕比例的增加,鱼体增重率呈上升趋势,血清溶菌酶活性、白细胞吞噬百分比和血清总蛋白上升,而谷丙转氨酶活性则下降,与未经过发酵的豆粕相比,发酵豆粕具有一定的促进生长、增强非特异性免疫功能和改善肝功能的作用。Juana Frias也在研究发酵豆粕的氨基酸和免疫增强物质时认为,发酵豆粕对动物的免疫力有一定的增强作用,有免疫增强剂的作用。嵇美华,吴定,姚明兰在研究中都认为发酵豆粕中的异黄酮有抑制有害细菌和抗氧化的作用。杨耐德等认为营养因子被有效降解,而具有生物活性的小肽能显著提高动物血液中的胰岛素水平,促进淋巴细胞增生,进而提高动物免疫水平。
以上这些学者的实验结果都说明发酵豆粕在发酵过程中产生的有益物质对动物的免疫力有增强作用,比较发酵豆粕与大豆粕之间的差别可以看到发酵豆粕与豆粕相比较不仅去除了豆粕中的各种抗营养因子,降低对水产动物肠道的刺激,而其经过发酵的过程蛋白质发生很大程度上的分解,小分子蛋白含量的上升产生了多种小肽。除此以外还含有一些抑制有害细菌的物质(如异黄酮)。这也说明了用发酵豆粕替代豆粕为什么能提高刺参幼参的免疫力。在另外的实验中,证明发酵豆粕能有效促进刺参的生长。这也应该是其对刺参免疫力增强的一个间接原因。
3.3 酶解鱼粉对免疫力的影响
Anthony L.Murray在研究酶解鱼粉对大西洋鲑非特异性免疫功能的影响时认为,在用添加酶解鱼粉的饲料饲养鲑鱼六周后,添加组与对照组之间非特异性免疫上差异不明显。这与本实验的结果相似。Cahu等在微颗粒饲料中使用鱼肉水解蛋白替代鱼粉蛋白,舌齿鲈稚鱼研究用鱼肉水解蛋白替代饲料中的鱼粉没有提高舌齿鲈稚鱼的存活率,50%替代组中舌齿鲈稚鱼的存活率反而下降。这说明适量的酶解鱼粉对水产动物的免疫力有增强作用而添加量过多对免疫能力有一定的抑制作用。Jairo Du-arte在研究酶解鱼粉作为添加剂的免疫调节作用时认为,酶解鱼粉中的小分子多肽对动物的免疫力有调节作用。以上学者的研究都说明酶解鱼粉对水产动物自身免疫力有一定的增强作用,本实验中酶解鱼粉对刺参幼参的免疫力也有一定的增强作用,但没有显著的效果。
笔者认为在添加发酵豆粕和酶解鱼粉后对刺参幼苗一些免疫酶活力提高没有明显效果的原因是,这两种蛋白主要是提高了高质量的蛋白源使其生长加快,而对免疫力的提高是因为刺参身体重量增加间接地使其抵抗力提高。这可能与其它因素有关,如动物品种、饲养环境、管理水平、应激程度以及取样部位有关。因此酶解鱼粉对刺参免疫力的影响还有待于进一步研究。
从以上分析可以看出发酵豆粕和酶解鱼粉与豆粕和鱼粉相比较更能增强刺参幼参自身的免疫能力,有着与多糖免疫增强剂类似的效果,可以更好地避免大规模养殖过程中疾病的发生。其作用机理还有待进一步研究。
(收稿日期:2016-03-09;修回日期:2016-03-14)

