东北寒区肉羊新品种群FecB基因鉴定与基因频率分析
刘学峰 张立春 李梦姝 王伟霞 佟桂芝 海龙 李信涛

摘要:本试验旨在对两个东北寒区肉羊新品种群体进行FecB基因鉴定和基因多态性分析。通过提取两个群体个体外周血基因组DNA样品,基因组PCR直接测序和HRM法检验,结果发现两个群体中均含有FecB基因,但无论从基因型频率还是等位基因频率均存在明显差异。首先肉毛兼用型群体只含有少量B+基因型个体,B等位基因频率只有3%左右,且处于Hardy-Weinberg平衡状态。多胎型群体中FecB基因含量则显著提高,BB和B+基因型频率依次上升至7%和25%左右,且处于Hardy-Weinberg不平衡状态,说明FecB基因在该群体中受到较为强烈的选择压力。如需利用两个群体进行兼具产肉性能和高繁殖性能肉羊新品种(系)培育,较为理想的策略是在进一步提升两个群体优良特性的前提下,开展两个群体间杂交。
关键词:绵羊;FecB基因;基因频率
中图分类号: S826 文献标识码:A文章编号:2095-9737(2020)03-0004-03
东北寒区肉羊新品种群是外来品种,主要是高繁殖率小尾寒羊和高产肉性能的德国肉用美利奴羊分别与当地东北细毛羊,半细毛羊杂交,自然选育形成的地方杂交品种群体,具有耐寒、耐粗饲等优点,按性能可细分为肉毛兼用型和多胎型两种类群[1]。两类自然杂交群体分布广泛,群体规模大,进一步可利用两种类型品种种群优势培育适应东北气候环境的兼具产肉与多胎性能的肉羊新品种(系)[2,3]。FecB基因是影响绵羊排卵率和繁殖力的主效基因,目前在国内外具有高繁殖特性的绵羊品种中均发现该基因的存在[4-6]。FecB基因作为成熟的高繁殖性状筛选标记已广泛应用于多胎绵羊品种选育,收到良好的效果[3]。本文以東北寒区肉羊新品种种群为研究对象,利用HRM技术对该群体中FecB基因鉴定及多态性分析,初步证实该群体中存在FecB基因且多胎型群体具有较高基因频率,为利用FecB标记筛选高产肉高繁殖特性地方肉羊新品种奠定基础。
1 材料与方法
1.1 实验样品采集及主要试剂和仪器
实验动物为东北寒区肉羊新品种种群,主要包括肉毛兼用型和多胎型两种类群,两者均来自国家肉羊核心育种场黑龙江农垦大山羊业有限公司。血液样品DNA采集参照试剂盒说明书进行。
血基因组DNA制备试剂盒购自Axygen公司;高保真Pfu DNA聚合酶购自Solarbio公司;基因分型试剂盒Light Cycler 480 High Resolution Melting Master购自罗氏公司;实时荧光定量PCR仪为罗氏公司Light Cycler 480 II。
1.2 引物设计与合成
绵羊FecB基因实际为骨骼形态发生蛋白受体1B(BMPR-1B)基因外显子6上发生的A746G突变。为检测该突变,采用Beacon Designer 7.9软件设计BMPR-1B基因外显子6部分序列克隆及HRM检测引物(BMPR-1B基因登录号:NC_040257),引物信息见表1。引物由苏州金唯智生物科技有限公司合成。
1.3 BMPR-1B片段扩增与FecB基因鉴定
PCR反应体系为25 μL:10×PCR Buffer 2.5 μL,dNTPs(2.5 mmol/μL)2.5 μL,FecB_C F和R引物(10 mmol/μL)各0.5 μL,DNA模板(50 ng/μL)1.0 μL,Pfu DNA聚合酶(5.0 U/μL)0.2 μL,ddH2O 17.8 μL。扩增条件:95℃预变性5 min,95℃变性30 s,60℃复性30 s,72℃延伸30 s,35个循环,72℃延伸5 min,12℃保存。扩增产物1.5%琼脂糖凝胶电泳检测。符合要求的PCR产物直接送生物公司测序。
1.4 东北寒区肉羊新品种群FecB基因型频率分析
以大山羊业所采集的肉毛兼用型和多胎型两种类群体为检测对象,以所构建的FecB基因HRM检测体系检测上述品种中FecB基因频率。HRM反应体系为10 μL:High Resolution Melting Master 5 μL,MgCl2(25 mmol/μL)1.2 μL,FecB_H正反引物各0.1 μL,模板DNA(20 ng/μL)0.5 μL,ddH2O为3.1 μL。反应程序如下:首先95℃预变性10 min;随后扩增45个循环,每个循环温度依次为94℃保持15 s,退火温度62℃保持30 s;扩增结束后进行HRM分型,分型条件为:95℃保持1 min,40℃保持1 min,65℃保持1 s;从65℃开始按25次/℃的频率收集荧光信号;最后降温至40℃保持40 s。检测结果用自带Gene Scanning软件进行数据分析。
基因频率分析采用GENEPOP 4.7软件,Hardy-weinberg平衡检验采用卡方检验进行。
2 实验结果
2.1 东北寒区肉羊新品种群FecB基因检测与验证
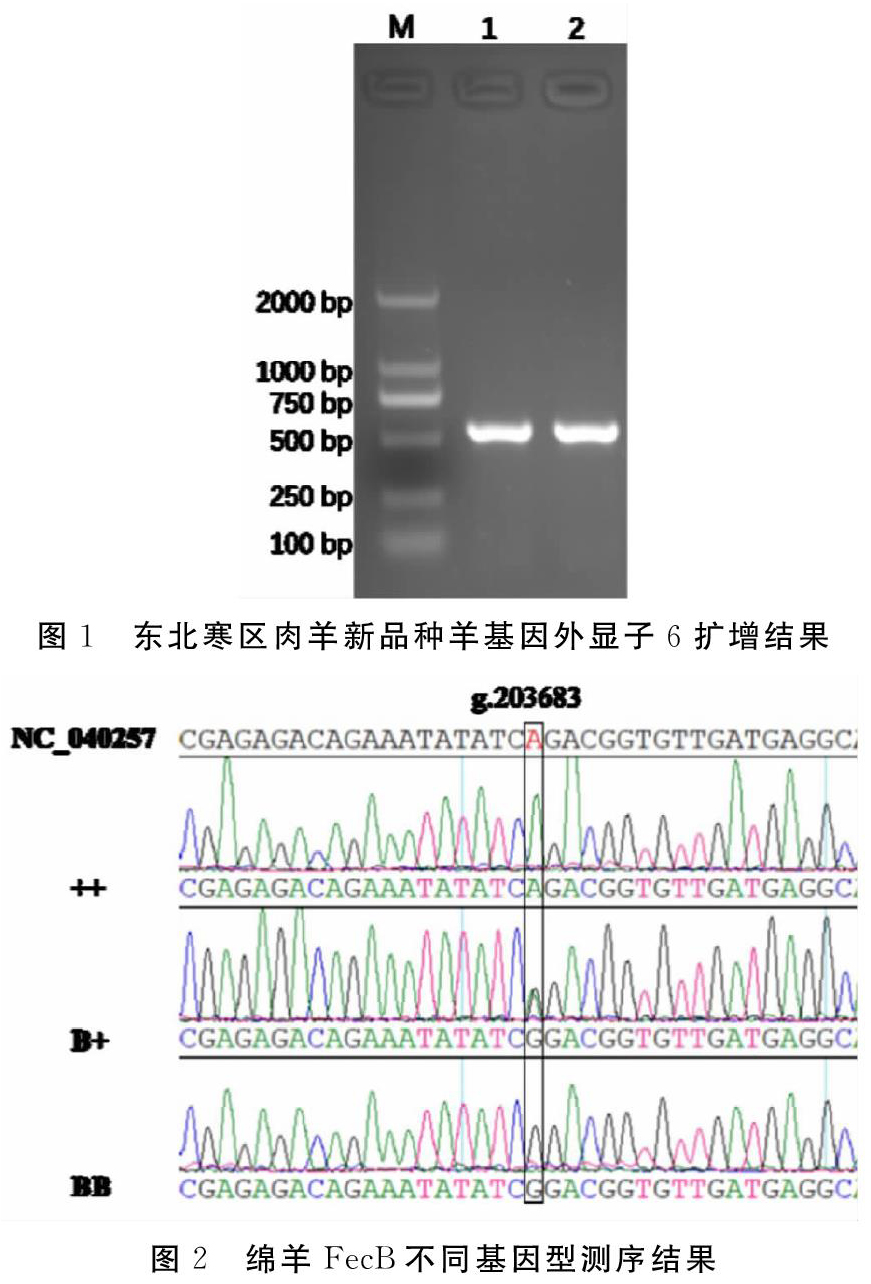
首先以肉毛兼用型和多胎型两种类群体典型个体基因组为模板,使用高保真酶基因组PCR产物扩增,直接测序法鉴定东北寒区肉羊新品种群中是否含有FecB基因,基因组PCR电泳结果显示,两个群体典型个体BMPR-1B基因外显子6扩增片段特异,大小符合预期(图1),将基因组PCR产物直接测序,结果发现多胎型个体中扩增片段存在A746G突变(图2),按惯例将等位基因为A的纯合个体命名为++,将等位基因G的纯合个体命名为BB,杂合个体命名为B+。
2.2 东北寒区肉羊新品种群FecB基因型频率分析
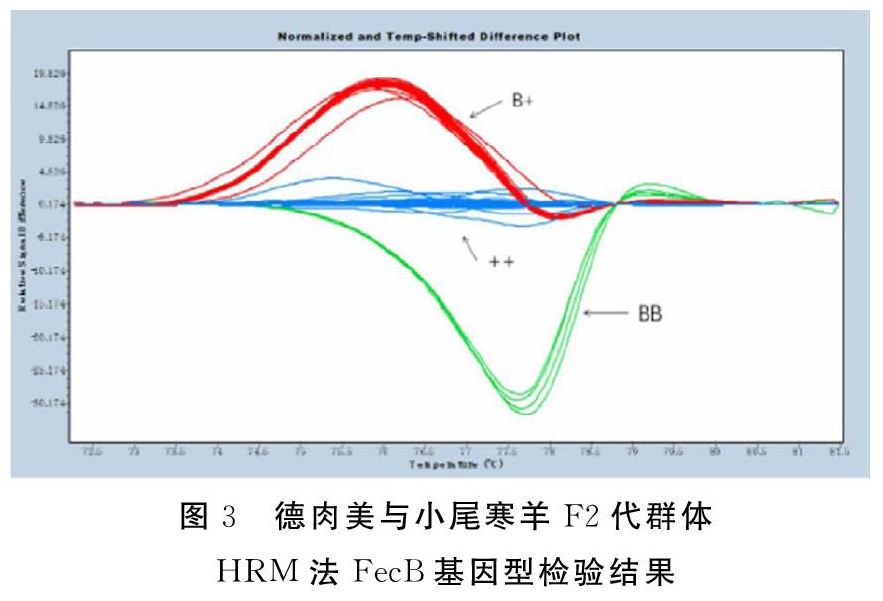
基因组PCR直接测序法证实多胎型东北寒区肉羊新品种群存在FecB基因,为进一步检验该群体中FecB基因的多态性,进一步以已建立的HRM检验方法,对两种类型核心群共计342头母羊进行了FecB基因检验。Gene Scanning分析发现FecB基因归一化温度转移差异图与HRM方法建立时的结果完全一致(图3),进一步证明HRM方法在检测FecB基因的可靠性。接下来使用Genepop软件对两个群体FecB基因型分析,结果发现两群体间FecB基因型频率存在明显差异(表2),表现为肉毛兼用型群体并不存在BB纯合性存在,B+基因型频率较为稀少(6.11%),绝大部分为++基因型,等位基因型频率也证实此结果,说明肉毛兼用型群体缺乏FecB基因,如在群体内部应用FecB基因进行多胎性状筛选较为困难。相较肉毛兼用型群体,多胎型群体中尽管++基因型仍然处于优势地位,但无论FecB基因型频率还是等位基因频率均显著提升,其中纯合BB基因型频率已上升至7.11%,B+基因型频率则上升至25.11%(表2)。卡方检验检测上述两个群体FecB基因型是否处于Hardy-weinberg平衡,结果发现肉毛兼用型处于Hardy-weinberg平衡状态,而多胎型群体则处于Hardy-weinberg不平衡状态。说明就FecB基因或繁殖性状来说,多胎型群体处于较强的人工选择状态。
3 讨论
目前我国绵羊品种培育进入新的发展时期,品种选育目标已不局限于单一性状的提高,可借助成熟分子标记实现多优良性状在同一群体内聚合。目前肉羊育种中较为流行的做法是利用国外肉羊品种改良我国地方绵羊产肉性能,同时希望导入高繁殖基因实现高产肉性能和高繁殖性能在培育品种(系)中实现聚合[7]。FecB基因作为繁殖性状主效基因已在绵羊品种选育中得到广泛应用且效果显著[8]。利用所建立的实验方法对来自国家肉羊核心育种场黑龙江农垦大山羊业有限公司的两种类型东北寒区肉羊新品种群(肉毛兼用型和多胎型)进行检验,为基于两种类型肉羊培育新型肉羊品种(系)奠定基础。
黑龙江农垦大山羊业有限公司原隶属于农科大山种羊场,所拥有的两种类型群体具有明显生产性能差异。肉毛兼用型产肉为主,兼具产毛性能。多胎型多胎性能突出,兼具一定的产肉性能。两者生产性能差异是由于杂交亲本的差异,肉毛兼用型是德肉美与本地东北细毛羊或半细毛羊杂交而成,而多态型群体亲本为德肉美和本地小尾寒羊杂交而成。其选育目标和育种方向存在一定差異,主要表现为肉毛兼用型主要选育目标为肉用性能,兼顾毛用性能,而多胎型则以多胎性状为主,产肉性能为辅。基因测序结果也证实,两群体中存在FecB基因(图1和2),提示可用FecB基因进行高繁殖性状的筛选。但两个群体FecB基因型频率存在较大差异,主要表现为多胎型BB基因型和B等位基因频率明显升高,基于前期研究结果证实纯种德肉美羊中不大可能存在FecB基因,因此有理由相信多胎型群体FecB基因是由其母本-小尾寒羊所提供的[6]。鉴于两个群体在选育目标和策略存在一定差异,肉毛兼用型更多关注产肉和毛用性状,多繁殖性状并未更多人为干预,相反多胎型群体则在产羔性状上施加较强的选择压力,FecB基因Hardy-weinberg检验也可证明此观点,从而也证实在多胎型群体中FecB基因对多胎表型的贡献率较大。但从本研究结果来看,从单一群体导入肉羊外血并不能在短时间内实现,其一为肉毛兼用型群体FecB基因型频率过低,不太可能在短时间内提升繁殖性能,而多胎型群体产肉性能又达不到育种目标,导入不含有FecB基因的肉羊外血将会稀释原本频率就不高的FecB基因。因此,较为合理的选育策略是首先增大选择压力,提升两个群体自身生产性能,最后在进行两个群体间杂交,最终实现产肉性能和繁殖性能的聚合。
4 结论
本试验采用直接测序和HRM技术对黑龙江农垦大山羊业有限公司具有鲜明生产特性的两个东北寒区肉羊新品种群进行FecB基因鉴定和多态性分析。结果证实两个群体均含有FecB基因,但基因型频率存在较大差异。如想利用两个群体进行兼具产肉性能和高繁殖性能肉羊新品种(系)培育,较为理想的策略是在进一步提升两个群体优良特性的前提下,开展两个群体间杂交。
参考文献:
[1] 门宇新. 对黑龙江省肉羊良种繁育体系建设的几点看法[J]. 黑龙江动物繁殖, 2017, 25(01): 60-62.
[2] 刘俊石, 段永霞. 杂交培育多胎性肉羊新品种的选育[J]. 中国畜牧业, 2018(24): 62-63.
[3] 曹阳, 金海国, 张立春, 等. FecB基因对多胎品系绵羊培育的影响[J]. 东北农业科学, 2016, 41(03): 77-80.
[4] Hua G-H, Yang L-G. A review of research progress of FecB gene in Chinese breeds of sheep[J]. Animal Reproduction Science, 2009, 116(1-2): 1-9.
[5] 于洋, 梁小军, 马吉锋, 等. 滩湖F2代FecB基因的多态性检测[J]. 上海畜牧兽医通讯, 2018(04): 44-45.
[6] 王根林, 毛鑫智, Davis G H, 等. DNA分析发现我国湖羊和小尾寒羊存在Booroola (FecB)多胎基因[J]. 南京农业大学学报, 2003(01): 104-106.
[7] 张云生, 靳勇. 新疆建立绵羊多胎经济性状分子改良体系的研究分析[J]. 草食家畜, 2017(03): 9-18.
[8] 郭立宏. 利用RFLP标记检测德肉美羊多胎(FecB)基因型的研究[J]. 黑龙江畜牧兽医, 2016(09): 115-117.

