TAT-Apoptin基因原核表达载体的构建及其表达鉴定
陈桂华 李翔辉 郁川
【摘? ?要】 为得到TAT-Apoptin融合蛋白,以pMD-19T-Apoptin为模板PCR扩增出TAT-Apoptin基因,构建重组载体pET-32a-TAT-Apoptin,并对TAT-Apoptin蛋白进行表达。PCR和测序表明,成功构建重组载体pET-32a-TAT-Apoptin,进一步对其进行蛋白表达,发现该蛋白能与Apoptin多抗发生特异性结合。以上结果证明,TAT-Apoptin基因原核表达载体构建成功,并能在Rosetta中进行分泌性表达。
【关键词】 TAT-Apoptin融合蛋白;重组载体pET-32a-TAT-Apoptin;分泌性表达
[Abstract]? In order to obtain TAT-Apoptin fusion protein, TAT-Apoptin gene was amplified by PCR with pMD-19T-Apoptin as template, the recombinant vector pET-32a-TAT-Apoptin, was constructed and the TAT-Apoptin protein was expressed. PCR and sequencing showed that the recombinant vector pET-32a-TAT-Apoptin, was successfully constructed to further express the protein, and it was found that the protein could specifically bind to Apoptin polyantibodies. The above results show that TAT- apoptin base The prokaryotic expression vector was successfully constructed and secreted in Rosetta.
[Keywords]? TAT-Apoptin fusion protein; secretory expression of recombinant vector pET-32a-TAT-Apoptin
凋亡素(Apoptin)是雞贫血病毒(chicken anemia virus, CAV)基因编码的一种小分子功能蛋白,导入哺乳动物细胞后可表达凋亡素并诱导肿瘤细胞凋亡,对正常二倍体细胞则无影响[1,2]。但天然状态下的Apoptin无法穿透细胞膜,人类免疫缺陷病毒(human immunodeficiency virus, HIV1)的反式激活蛋白(trans-activator transcription, TAT)可以在不损害细胞的情况下跨膜转运与之融合表达的蛋白[3]。我们利用TAT这一特性,将TAT的编码基因与外源蛋白基因Apoptin连接,表达TAT-Apoptin融合蛋白,该融合蛋白既有穿透性,又不影响外源蛋白的活性。鉴于此,我们构建了原核表达载体pET-32a-TAT-Apoptin,并对TAT-Apoptin蛋白进行表达,从而为TAT-Apoptin的抗肿瘤作用研究奠定了一定的基础。
1? 材料和方法
1.1? 细菌菌株和载体
pMD-19T-Apoptin质粒由河南科技大学动物疫病与公共安全实验室构建保存;E.coli-JM109、原核表达载体pET-32a、宿主表达菌菌株Rosetta均由本实验室保存。
1.2? 试剂
Taq DNA聚合酶、dNTP、DNA Marker、T4 DNA Ligase、限制性内切酶EcoR I和Sal I、蛋白Marker均购自Takara(大连)有限公司;质粒提取试剂盒、琼脂糖凝胶回收试剂盒均购自Axygen公司;LB培养基购自英国OXOID公司;兔抗Apoptin多抗购自武汉华美生物工程有限公司;硝酸纤维素膜、碱性磷酸酯酶标记山羊抗兔二抗、BCIP/NBT碱性磷酸酯酶显色试剂盒均购自上海碧云天生物技术有限公司;IPTG诱导剂购自Sigma公司;氨苄青霉素购自生工生物(上海)股份有限公司。
1.3? 方法
1.3.1 引物设计与合成? 根据GenBank中的CAV基因组序列(GenBank: AF199501)及相关文献中[4]报道的TAT序列,运用Primer Primer 5.0引物设计软件设计并合成如下特异性引物:TAT-Apoptin引物:
1.3.2 TAT-Apoptin基因的克隆与鉴定? 以构建好的pMD-19T-Apoptin为模板,利用1.3.1设计合成的引物扩增出TAT-Apoptin融合基因,并于pET-32a进行连接,转化大肠杆菌Rosetta中,挑取单菌落分别进行PCR鉴定和酶切鉴定,阳性重组质粒送上海生工测序。
1.3.3 TAT-Apoptin融合蛋白的表达鉴定? 挑取含有重组质粒的Rosetta单菌落,接种到4ml(LB+A)液体培养基中,于37℃、200rpm振摇过夜培养。取50ul过夜培养物转接到5ml(2×YT+A)培养基中,于37℃、200rpm振摇培养4h左右加入1mmol浓度的IPTG,28℃、180rpm诱导表达7h后离心菌体,PBS洗两遍,再用PBS重悬菌体,超声破碎后再次离心,用200ul的PBS重悬沉淀,并分别于上清和沉淀中加入适量5×蛋白上样液,100℃煮沸10min点样进行SDS-PAGE蛋白电泳,而后进行Western-blot鉴定。
2? ?结果
2.1? TAT-Apoptin基因的擴增
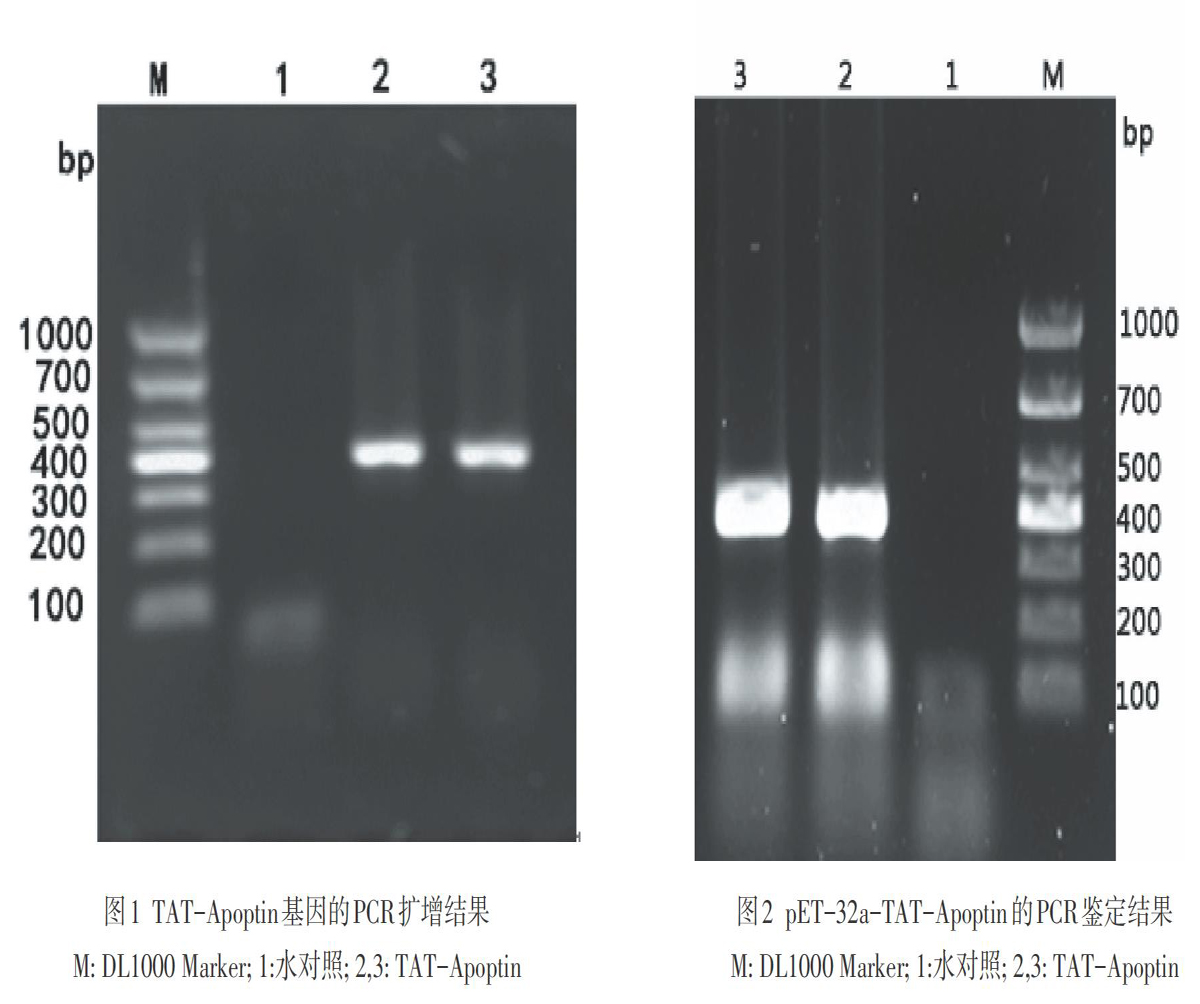
PCR产物经1%的琼脂糖凝胶电泳显示大小为411bp,与预期大小一致(见图1)。
2.2? ?pET-32a-TAT-Apoptin鉴定
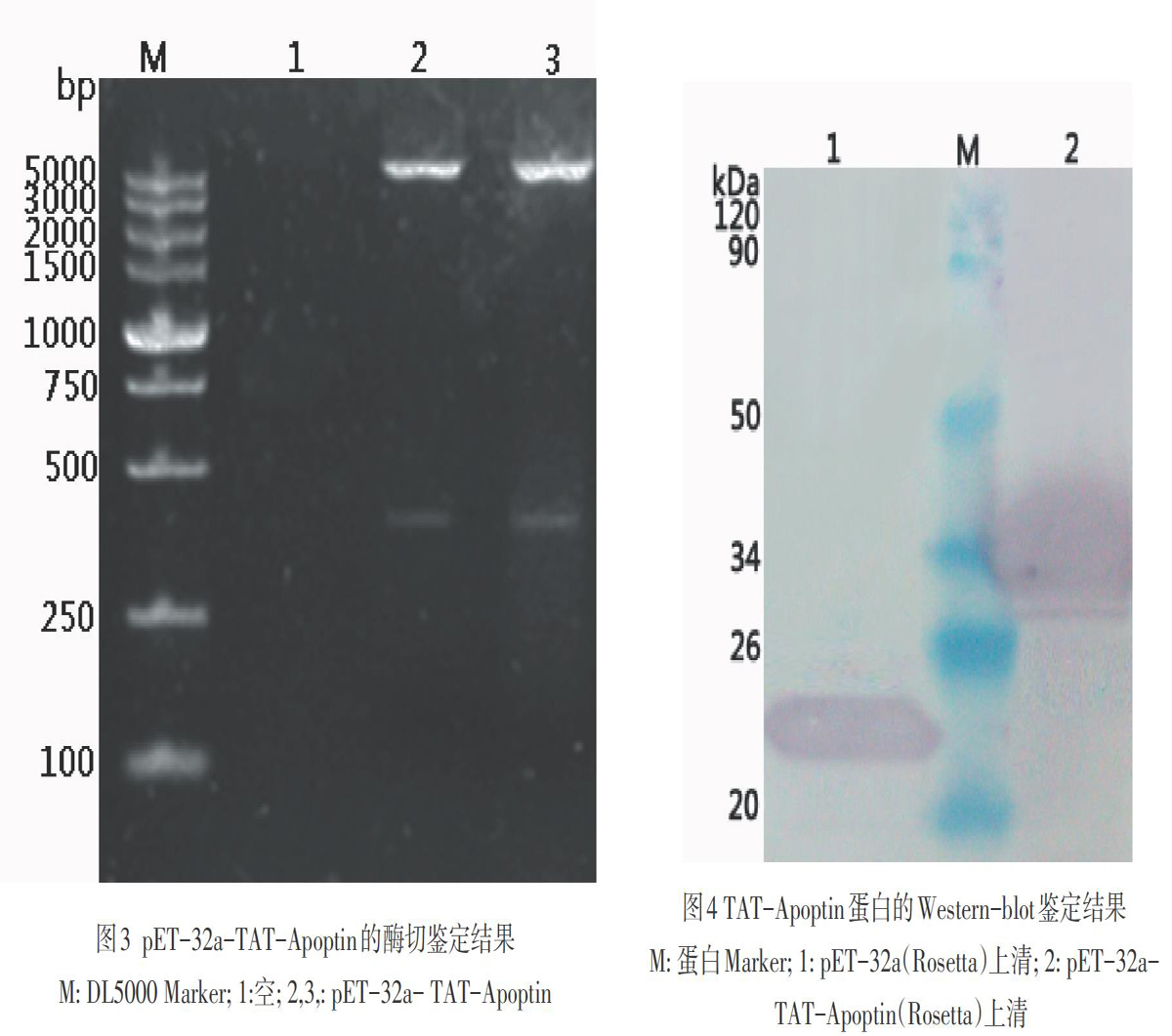
对pET-32a-TAT-Apoptin进行PCR和酶切鉴定:PCR扩增出411bp的目的条带(见图2);经EcoR I和Sal I双酶切后出现大小分别为5900bp和411bp的两条带(见图3)。结果表明,目的片段以正确方向插入原核表达载体pET-32a中。对克隆片段进行序列测定及分析后,结果显示重组载体pET-32a-TAT-Apoptin中包含完整的Apoptin基因及TAT序列,其中Apoptin基因序列与GenBank(AF199501)中发表的鸡贫血病毒CAV基因序列相比同源性为99.7 %。但氨基酸序列同源性为100 %,说明克隆片段为TAT-Apoptin基因序列。
2.3? TAT-Apoptin蛋白的表达鉴定
含有重组质粒的Rosetta经IPTG诱导后,Western-blot显示在约34 kDa处有TAT-Apoptin蛋白条带,并且存在于过滤的上清中,表明TAT-Apoptin可在Rosetta中获得分泌表达(见图4)。
3? ?讨论
肿瘤细胞的不受控增殖性是肿瘤难以治疗的重要原因之一,如何促使肿瘤细胞凋亡成为各国学者探究的热点[5]。研究发现,Apoptin可以选择性促使肿瘤细胞凋亡,但是,处于天然状态下的Apoptin透过细胞膜促使肿瘤细胞凋亡相当困难。因此,如何使Apoptin在肿瘤组织聚集并顺利进入体内肿瘤细胞,发挥其肿瘤特异性杀手的效用,是当前亟待解决的问题。研究证实,HIV-1的反式激活因子TAT可携带小分子蛋白跨膜进入细胞[3],具有广谱蛋白转导作用。因此,本实验将二者结合探究其在原核表达载体中的表达情况,为后续纯化TAT-Apoptin蛋白并诱导肿瘤细胞凋亡奠定了基础。
本实验构建的TAT-Apoptin在Rosetta中具有很高的表达量,且目的蛋白大量出现在裂解上清中,说明其主要以分泌形式进行了表达,这可能与Rosetta中含有的稀有密码子有关,这些稀有密码子为Rosetta菌提供了“万能”翻译,从而避免因大肠杆菌密码子使用频率导致的表达限制。
综上所述,本研究成功构建了能高效表达TAT-Apoptin蛋白的原核表达载体pET-32a-TAT-Apoptin,为进一步探索Apoptin的抗肿瘤作用研究提供了一定材料。
参考文献:
[1]? Yuasa N, Taniguchi T, Yoshida I. Isolation and some properties of an agent iducing anemia in chicks[J]. Avian Dis, 1979,23(2): 366-385.
[2]? Noteborn MH, Todd D, Verschueren CA, et al. A singlechicken anemia virus protein induces apoptosis [J]. J Virol,1994, 68(1): 346-351.
[3] S Debaisieux, F Rayne, H Yezid, et al. The ins and outs ofHIV-1 Tat[J]. Traffic, 2012, 13(3): 355-363.
[4]? L Guelen, H Paterson, J Gaken, et al. TAT-apoptin is effi?ciently delivered and induces apoptosis in cancer cells[J].? ? ? ? ? ? ?Oncogene, 2004, 23(5): 1153-1165.
[5]? LT Jia, SY Chen, AG Yang. Cancer gene therapy targeting?cellular apoptosis machinery[J]. Cancer Treat Rev, 2012, 38? (7): 868-876

