分散液—液微萃取萃取剂分散策略的新进展
李明杰
摘要 分散液液微萃取(DLLME)是近年出现的一种绿色样品处理手段,微升级萃取剂在样品溶液中的分散是完成DLLME至关重要的一步。本文根据萃取剂分散所使用的仪器和依据的原理,将分散方法分为:(1)物理分散法,包括机械振荡法、超声波/微波辅助法以及溶解度调节法等;(2)原位化学反应法,包含原位生成萃取剂和生成有助于萃取剂分散的气体等方法;(3)新分散介质法,是以非挥发性物质(饱和脂肪酸、离子液体、表面活性剂和木棉纤维碎片等)代替常规DLLME中分散剂的一种新的DLLME模式。本文引用了96篇相关文献,并对未来的发展进行了展望。
关键词;分散液液微萃取; 物理分散法; 原位化学反应; 非挥发性溶剂; 综述
1引言
2006年以来,分散液液微萃取(Dispersive liquidliquid microextraction, DLLME)[1]作为一种新型样品预处理技术,以其优异的绿色化学指标和数百倍以上的富集倍数等突出优点,得到了分析化学家的青睐。有关DLLME的SCI研究论文已超过千篇[2],综述论文多篇[2~11]。这些综述都很好地论述了DLLME在近几年取得的突破性进展,但是却没有专门针对萃取剂分散策略进行叙述的论文。
微升级的萃取剂在样品溶液中充分分散是完成DLLME至关重要的一步,因此,本文以此为着眼点, 对DLLME中所用的萃取剂分散法进行了归纳整理。按照实现分散过程所使用的设备和原理,将这些分散方法分为物理分散法、原位反应法和新分散介质法。从发展趋势来看,从初期的萃取剂、分散剂和水样三要素实现DLLME,发展到萃取剂和水样两要素实现DLLME,避免了由于分散剂而导致的萃取剂在水中溶解度增加和萃取效率降低的问题;从初期的依靠仪器设备的物理分散法,发展到原位反应法和分散介质法,避免了DLLME操作对于微波炉、超声波清洗器等设备的依赖,方法更简单、更容易实现;从初期的离线样品处理法,逐渐发展到在线处理法,实现了与后续仪器分析法的完美结合,绿色分析的特征更加突出。
2分散方法
2.1物理方法
2.1.1机械振荡法
机械振荡法是通过外力使萃取混合液发生剧烈运动而形成乳化的方法。依据产生运动所用设备的不同,可分为徒手振荡法[1]、涡旋仪法[13] 、振动仪法[14]、磁力搅拌器法[15]及空气辅助法[16]等,详见表1。徒手振荡法是最为简单的机械振荡分散法。但单靠手振荡很难达到理想的分散效果,通常需与其它分散法配合使用。Chung等[17]发现对萃取混合液先进行手振荡,再进行超声处理,可有效缩短超声处理时间。Tsai等[18]将萃取剂与分散剂的混合液加入到待测水溶液后,需再徒手剧烈振荡90 s才能得到萃取剂均匀分散的乳浊液。此外,已有大量文献[19~23]表明,分散过程中加入可溶性无机盐,有利于微升级别的萃取剂在水相中的分散。Ma等[20]将可溶性无机盐Na2SO4加到含二氯甲烷萃取剂的样品溶液中,徒手振荡1 min即可获得均匀分散的乳浊液。
MSUSAEME: manual shakingenhanced, ultrasoundassisted emulsification microextraction; LSC: little solvent consumption; TBME: tertbutyl methyl ether; SA: saltassisted; PTVGCMS : programmed temperature vaporization gas chromatographymass spectrometry; MSILDLLME: magnetic stirrer induced dispersive ionicliquid microextraction; GFAAS: graphite furnace atomic absorption spectrometry; AA: airassisted; SI: sequential injection; SVSIA: singlevalve sequential injection manifold; UESA: ultrasound enhanced surfactantassisted; UA: ultrasoundassisted; USA: ultrasoundassisted; MALDIMS: matrix assisted laser desorption/ionization mass spectrometry; UASEME: ultrasoundassisted surfactantenhanced emulsification microextraction; MA: microwaveassisted; ET: elevated temperature; ET: elevated temperature; TC: temperaturecontrolled; FI: flow injection; ETAAS: electrothermal atomic absorption spectrometry.[BG)W][HT5][HJ]
徒手振荡法用力难于恒定,会导致不同次的处理分析结果的波动。涡旋仪法利用涡旋仪产生的动能驱使萃取剂分散在待测溶液中,可避免徒手振荡法的不足。Seebunrueng等[24]用涡旋仪加速了低密度萃取剂的分散。2015年,该研究组又完善了该方法(如图1a),省去了分散剂,消除了分散剂加入可能导致的萃取效率下降的问题[25,26];通过AlCl3诱导分相,既减少了有机溶剂的用量,又省去了离心操作。Gure等[13]采用涡旋仪分散离子液体萃取剂,仅用30 s即可获得分散均匀的乳浊液。但涡旋仪法因单次处理量低,不适合于批量样品的预处理
a. 涡旋辅助分散液液微萃取盐诱导去乳化[25],b. 振动仪辅助分散液液微萃取[27], c. 分散悬浮微萃取[28] 。
a. vortexassisted DLLME and saltinduced demulsification (VADLLMESID)[25], b. upanddownshakerassisted dispersive liquidliquid microextraction (UDSADLLME)[27], c. dispersive suspended microextraction (DSME)[28].
振荡仪通过仪器的上下振动带动萃取溶液剧烈振动,使萃取剂分散在待测溶液中。该法可用于批量样品预处理。Wang等[14]将振荡仪引入DLLME的分散过程,他们还利用该装置萃取了水样中的三嗪类除草剂(图1b)[27]。Yang等[29]将磁力搅拌辅助分散应用于DLLME中。Petridis等[28]用此分散方法实现了水样中10种多环芳香烃的富集(图1c(E))。Henríquez [30]和Horstkotte [15] 等又将此技术用于自动化的微萃取中,不仅实现了投料与分散过程的自动化,也实现了分离与检测的一体化。
为了减少DLLME过程中对其它设备的依赖,Farajzadeh等[16]提出了空气辅助法,仅用注射器从萃取装置内反复抽取打出萃取混合液,即可实现分散过程。该方法无需加入分散剂,萃取剂仅需15 μL;所用设备简单,不需要涡旋仪[25]、振动仪[27,31]、磁力搅拌器[28]等特殊仪器的辅助。Guo等[32]利用现有自动进样器,实现了基于抽取与打出操作的DLLME自动化。Alexovi等[33]对该方法作了改进,只需将萃取剂猛力注入待测溶液中即可达到分散的目的,装置构造见图2。
2.1.2超声波、微波分散法Regueiro等[34]提出了超声分散法,利用超声“空化”效应实现了萃取剂的有效分散,于是在DLLME中减少甚至不用分散剂成为可能。可按有无使用分散剂对超声分散法进行分类(图3)。
有分散剂的超声分散法尽管会使用甲醇[35~40]、丙酮[34,41,42]、乙腈[43,44]及己烷[45]等有机溶剂作为分散剂,但用量相对于常规DLLME变少。为了避免使用易挥发性有机溶剂,Abdelhamid等[46]用阳离子表面活性剂溴化十六烷基三甲基铵(CTAB)代替前述的几种易挥发的分散剂,在超声波的辅助下实现了对血样中绿脓杆菌(P. aeruginosa)和金黄色葡萄球菌(S. aureus)的测定。实验前先用二氧化铈 (CeO2)纳米颗粒对CTAB进行修饰,得到CeO2@CTAB。由于CeO2拥有巨大的表面积,又可以通过静电作用使蛋白质分子吸附在其表面,以此提高有机萃取剂的生物亲和性[47]。在萃取过程中,为加强分散效果,需将加有CeO2@CTAB的乳浊液移至超声水浴中超声10 min。结果表明,此方法萃取效果良好,检出限仅为103~104 cfu/mL。
无分散剂的超声分散法可避免由于使用过量分散剂所产生的萃取效率下降的问题。无分散剂的超声分散法常用萃取剂有氯苯[48,49]、氯仿[50,51]、四氯乙烯[52]及甲苯[53]等。Gong等[54] 于313 K下对 [C8mimPF6]离子液体萃取剂作超声处理,温度和超声处理可使其很好地分散在水相中。
超声技术的应用可降低作为分散剂使用的有机溶剂用量,然而多数超声分散过程仍需5~10 min较长的处理时间[43,46,54,55],说明在超声波作用下萃取剂微液滴的形成仍然较慢[56]。此外,样品水温会随着超声操作时间变长而有一定程度的上升,在某些情况下可能会导致分析物分解[57]。这是超声辅助技术的局限性。
微波分散法是在DLLME中依靠微波实现萃取剂分散的方法。Niazi等[58]将注有250 μL分散剂的萃取混合液置于微波下处理,仅用60 s便得到了均匀分散的乳浊液。Xu等[59]又将该技术用于以离子液体为萃取剂的DLLME中,分散剂的用量也仅为750 μL。微波辅助分散所需分散剂的量由传统的mL级降至μL级。
2.1.3溶解度调节法 Farajzadeh等[65]通过调节温度改变萃取剂溶解度,完成其在样品溶液中的分散。该过程可分为两个阶段:(1)升温阶段:将装有样品的离心管置于75℃水浴中4 min后,将萃取剂和分散剂的混合液迅速注入离心管。由于温度提升以及微量分散剂的作用,萃取剂完全分散在样品溶液中;(2)降温阶段:用自来水冷却离心管4 min,由于温度降低萃取剂在样品溶液中的溶解度降低并分散出许多小液滴,使萃取混合溶液变浑浊。该法需要选择沸点较高的萃取剂,以避免升温所引起的萃取剂损失。Vaquez等[36]和Zhao等[61]利用类似的方法实现了具有较高沸点特性的离子液体萃取剂的有效分散。随后,Berton等[62]又利用该方法实现了DLLME的自动化。
2.2原位化学反应法
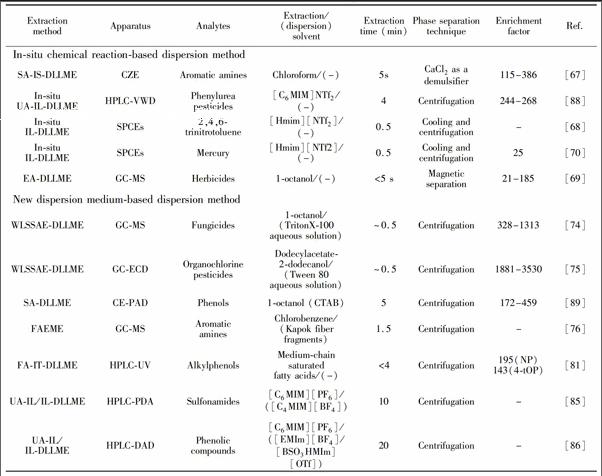
原位反应法是指利用某些水溶性、低毒性的试剂,通过原位生成萃取剂[66~68]或辅助分散的气体[69],使萃取剂均匀分散的方法,详见表2。
本课题组根据易溶于水的水合氯醛和NaOH在常温下可迅速反应生成氯仿的化学反应,建立了一种基于原位化学反应的分散氯仿萃取法\[67\]。该法在不需要使用分散剂的情况下实现了萃取剂的高度分散,同时也避免了氯仿在贮存过程中产生光气。
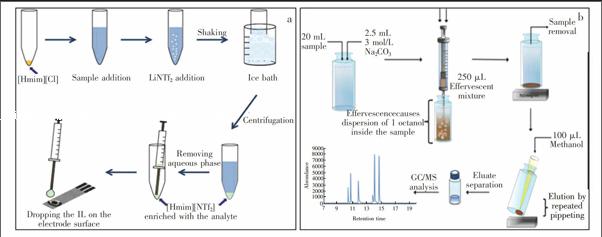
Fernández等[68]先将可溶性离子液体[Hmi][Cl]溶解于待测溶液中,再加入可溶性无机盐LiNTf2。手摇0.5 min后,[Hmim][Cl]便与LiNTf2原位生成均匀分散的疏水性萃取剂[Hmim][NTf2],原理如图3a。萃取完成后,即可将富含目标分析物的离子液体
相置于丝网印刷石墨电极(Screenprinted graphite electrode,SPGE)表面做电化学检测。随后,该组[70]利用HCl溶液将分析物从离子液体相反萃取到水相,克服了离子液体直接用于电化学检测适应性差的难题。
Valcárcel等[71,72]以Na2CO3与NaH2PO4原位生成的CO2气体为驱动力,实现了对毫克级固体吸附
SAISDLLME: sedimentation accelerated by inorganic saltdispersive liquid liquid microextraction; CZE: capillary zone electrophoresis; UAIL: ultrasoundassisted ionicliquid; VWD: variablewavelength detection; SPCEs: Screenprinted carbon electrodes; EA: effervescenceassisted; WLSSAE: water with low concentration of surfactant in dispersed solventassisted emulsion; ECD: electron capture detector; SA: surfactant assisted d; CE: capillary electrophoresis; FAEME: fiberassisted emulsification microextraction; FAIT: fattyacidbased intube; UV: UVvis detector.[BG)W][HT5][HJ]
剂的高度分散。2014年,该研究组又将该思路用于DLLME中[69],以Na2CO3为CO2源,乙酸为质子给予体,原理如图4b。在分散环节,为避免针柄产生额外的压力,需将250 μL含2.5 mL 3 mol/L冰乙酸、200 μL正辛醇萃取剂和100 mg磁性材料的萃取混合液从容器底部缓缓注入含2.5 mL 3 mol/L Na2CO3的待测溶液中。此时原位生成的CO2就会以泡腾的形式冒出,驱使萃取剂从底部逐渐分散在整个待测溶液里,仅需5 s便得到了萃取平衡液。此分散法仅借助简单的无机反应,实现了萃取剂的高度分散。
2.3新分散介质法
除了有机分散剂和辅助分散的设备外,某些低毒性的溶剂或分散材料也被用到DLLME的分散过程。这些溶剂或材料主要有表面活性剂、木棉纤维碎片、中链饱和脂肪酸、离子液体等,它们的使用使得DLLME更加绿色化,同时也简化了分散环节的操作步骤,详见表2。
表面活性剂分子因同时具有亲水和亲油性,已代替传统的有机分散剂\[65,73,74\],广泛应用于DLLME中。Cheng等\[65\]用0.5 g/L表面活性剂作为分散剂,辅助有机萃取剂成功地分散在含有11种多环芳香烃标样的待测溶液里。此过程无需使用有机分散剂,但表面活性的用量较高(g/L级)。2013年Li等\[75\]采用低浓度表面活性剂(低于1 mg/L)辅助法,将表面活性剂与萃取剂的混合液吸进打出4次(约10 s),即可得到均匀分散的乳浊液。2014年,该研究组又将此分散法与振动仪法作了对比研究[31],结果表明,低浓度表面活性剂法减少了有机溶剂的用量,明显缩短了乳化时间。
某些微米尺寸或更小的固体材料也可以起到与表面活性剂类似的作用。Feng等[76]将自制直径50 μm的木棉纤维碎片用作分散材料,利用其与水油两相的界面相互作用而达到分散的目的[77],避免了因加入分散剂而带来的萃取效率下降[78,79]和溶剂污染等问题[8,80]。
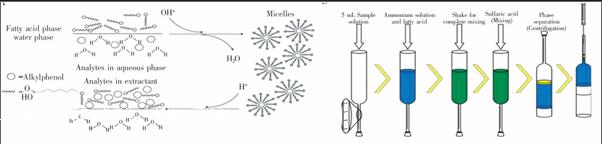
除了加入分散试剂或分散材料外,改变萃取剂在待测样品溶液中的存在状态,也可以实现萃取溶液的乳化过程。Shih等[81]测定水样中壬基苯酚(Nonylphenol, NP)和叔辛基苯酚(4tertoctylphenol, 4tOP)时,以庚酸为萃取剂,萃取原理如图5所示。可通过调节pH值控制庚酸在水溶液中的状态,当溶液的pH>pKa,可以电离出亲水性的阴离子端而溶解于待测溶液中,同时也具备了阴离子表面活性剂的性质[82~84]。当该阴离子表面活性剂进入水相后,疏水性的分析物便被萃取到其形成的胶束中。萃取完成后,将溶液调至pH
3结 论
绿色化学概念由Anastas等[90]于1991年提出,随后绿色分析化学(Green Analytical Chemistry,GCA)的概念在1999年随之提出[91]。文献中经常以3R(以绿色溶剂代替有毒溶剂,降低溶剂消耗和废物的产生,以及溶剂的循环利用)来概括绿色分析法的特征[92]。液相萃取(Liquidliquid extraction,LLE)和固相萃取(Solidphase extraction,SPE)是两种传统的和强有力的分离和预浓缩技术。然而,它们存在操作耗时、经常需要大量有毒有机溶剂等不符合绿色分析要求的缺点,为此需要发展可代替传统的LLE和SPE的微萃取技术。由Arthur and Pawliszyn[93]开创的固相微萃取技术(Solidphase microextraction,SPME)是一种出现较早的绿色样品制备技术,其萃取过程发生在聚合物涂层纤维上,而不需要有机溶剂。尽管SPME纤维越来越普及,但它仍存在一些明显的缺点,例如,它在有机溶剂中的不稳定性和溶胀、相对较贵的价格、较短的使用寿命及纤维断裂[92,94]。发展溶剂微萃取方法实为解决这些问题的一种办法。可将目前的溶剂微萃取技术粗略地分为三类:单滴微萃取技术(Singledrop microextraction, SDME)[95],中空纤维液相微萃取技术(Hollowfiber liquidphase microextraction, HFLPME)[96]和DLLME[1]。SDME具有操作简单、低消耗、降低了有毒有机溶剂的消耗、消除了可能的记忆效应以及可实现原位衍生萃取等优点。但也存在液滴的稳定性差、液滴表面积有限及精密度较低等缺点。HFLPME 凭借聚合物纤维作为萃取剂的载体可克服SDME使用中萃取剂损耗和移位等问题。DLLME是这3种溶剂微萃取技术中出现最晚的,具有操作简单、低消耗、高回收率、高富集倍数和极短的萃取时间等优点。
DLLME是近年来新出现的一种绿色样品预处理方法,实现萃取剂的有效分散是这种技术的关键步骤。物理分散方法(包括徒手振荡法、漩涡仪法、振荡仪法、空气辅助法、超声波法、微波法、溶解度改变法等)、原位化学反应法和新型分散介质法是主要的三类萃取剂分散方法。未来DLLME的研究可能会集中在如下3个方面: (1)联合萃取DLLME的一个主要缺点就是不适于复杂基质样品的处理[1]。为了解决这个问题,可将DLLME与其它前处理方法联合使用(例如,SPE和LLE),可获得高的样品净化效率(甚至可实现不经色谱分离的质谱和荧光检测),实现简单和高通量分析。(2)DLLME的自动化近年来,基于各种不同策略的实现DLLME自动化的技术相继出现[2]。但这些方法的装置相对复杂,与DLLME简单化的要求不一致。因此,减少或避免DLLME过程中对离心机、超声波、漩涡混匀器等的依赖, 在实现DLLME自动化的前提下,进一步实现与后续分析设备在线联用,也应是未来的发展方向之一。(3)无分散剂的DLLME和绿色化学反应有机分散剂不仅可能会降低萃取效率而且往往是有毒的有机物,采用低毒溶剂代替传统的分散剂和萃取剂也是需要进一步研究的领域[5]。尽管目前使用离子液体作为萃取剂有了很多应用实例,但离子液体萃取剂不适于气相色谱分析检测。另外,为了提高萃取效率而进行的衍生和络合反应也应采取绿色反应条件,避免使用有毒试剂,减少废物的产生。
References
1Rezaee M, Assadi Y, Milani Hosseini M R, Aghaee E, Ahmadi F, Berijani S. J. Chromatogr. A, 2006, 1116: 1-9
2Maya F, Horstkotte B, Estela J M, Cerdà V. Trends Anal. Chem., 2014, 59: 1-8
3HerreraHerrera A V,AsensioRamos M, HernándezBorges J, RodríguezDelgado M . Trends Anal. Chem., 2010, 29: 728-751
4ZgoaGrzeskowiak A, Grzeskowiak T. Trends Anal. Chem., 2011, 30: 1382-1399
5Saraji M, Boroujeni M K. Anal. Bioanal. Chem., 2014, 406: 2027-2066
6Andruch V, Burdel M, Kocúrov L, andrejov J, Balogh I S. Trends Anal. Chem., 2013, 49: 1-19
7Leong M I, Fuh M R, Huang S D. J. Chromatogr. A, 2014, 1335: 2-14
8Rezaee M, Yamini Y, Faraji M. J. Chromatogr. A, 2010, 1217: 2342-2357
9ZANG XiaoHuan, ZHANG GuiJiang, WANG Chun, WANG Zhi. Chinese Journal of Chromatography, 2015,33: 103-111
臧晓欢, 张贵江, 王 春, 王 志. 色谱, 2015, 33: 103-111
10ZANG XiaoHuan, WU QiuHua, ZHANG MeiYue, XI GuoHong, WANG Zhi. Chinese J. Anal. Chem., 2009, 37(1): 161-168
臧晓欢, 吴秋华, 张美月, 郗国宏, 王 志. 分析化学, 2009, 37(1): 161-168
11Kocúrová L, Balogh I S, andrejová J, Andruch V. Microchem. J., 2012, 102: 11-17
12Leong M I, Chang C C, Fuh M R, Huang S D. J. Chromatogr. A, 2010, 1217: 5455-5461
13Gure A, Lara F J, GarciaCampana A M, Megersa N, Del OlmoIruela M. Food Chem., 2015, 170: 348-353
14Wang K D, Chen P S, Huang S D. Anal. Bioanal. Chem., 2014, 406: 2123-2131
15Horstkotte B, Suarez R, Solich P, Cerdà V. Anal. Chim. Acta, 2013, 788: 52-60
16Farajzadeh M A, Mogaddam M R. Anal. Chim. Acta, 2012, 728: 31-38
17Chung R J, Leong M I, Huang S D. J. Chromatogr. A, 2012, 1246: 55-61
18Tsai W C, Huang S D. J. Chromatogr. A, 2009, 1216: 5171-5175
19Hosseini M H, Rezaee M, Mashayekhi H A, Akbarian S, Mizani F, Pourjavid M R. J. Chromatogr. A, 2012, 1265: 52-56
20Ma H, Li Y, Zhang H, Shah S M, Chen J. J. Chromatogr. A, 2014, 1358: 14-19
21Haji Hosseimi M, Asaadi P, Rezaee M, Reza Rezaei M, Reza Pourjavid M, Arabieh M, Abhari A A. Chromatographia, 2013, 76: 1779-1784
22Moniruzzaman M, Rodriguez I, Rodriguez-Cabo T, Cela R, Sulaiman S A, Gan S H. J. Chromatogr. A, 2014, 1368: 26-36
23Haddadi H, Rezaee M, Semnani A, Mashayekhi H A. Bull. Chem. Soc. Jpn., 2013, 86: 1282-1286
24Seebunrueng K, Santaladchaiyakit Y, Srijaranai S. Chemosphere, 2014, 103: 51-58
25Seebunrueng K, Santaladchaiyakit Y, Srijaranai S. Talanta, 2015, 132: 769-774
26Chen H, Chen R, Li S. J. Chromatogr. A, 2010, 1217: 1244-1248
27Chen P S, Haung W Y, Huang S D. J. Chromatogr. B, 2014, 955956: 116-123
28Petridis N P, Sakkas V A, Albanis T A. J. Chromatogr. A, 2014, 1355: 46-52
29Yang Z H, Liu Y, Lu Y L, Wu T, Zhou Z Q, Liu D H. Anal. Chim. Acta, 2011, 706: 268-274
30Henriquez C, Horstkotte B, Solich P, Cerdà V. Anal. Bioanal. Chem., 2013, 405: 6761-6769
31Tseng W C, Chen P S, Huang S D. Talanta, 2014, 120: 425-432
32Guo L, Lee H K. Anal. Chem., 2014, 86: 3743-3749
33Alexovi M, Wieczorek M, Kozak J, Koscielniak P, Balogh I S, Andruch V. Talanta, 2015, 133: 127-133
34Regueiro J, Llompart M, GarciaJares C, GarciaMonteagudo J C, Cela R. J. Chromatogr. A, 2008, 1190: 27-38
35Zhang Y, Lee H K. Anal. Chim. Acta, 2012, 750: 120-126
36Vázquez M P, Vázquez P P, Galera M M, Moreno A U. J. Chromatogr. A, 2014, 1356: 1-9
37Fernández P, González C, Pena M T, Carro A M, Lorenzo R A. Anal. Chim. Acta, 2013, 767: 88-96
38Zhang J, Gao H, Peng B, Li S, Zhou Z. J. Chromatogr. A, 2011, 1218: 6621-6629
39Vázquez M M, Vázquez P P, Galera M M, Garcia M D. Anal. Chim. Acta, 2012, 748: 20-27
40Jofre V P, Assof M V, Fanzone M L, Goicoechea H C, Martinez L D, Silva M F. Anal. Chim. Acta, 2010, 683: 126-135
41Yan H, Liu B, Du J, Yang G, Row K H. J. Chromatogr. A, 2010, 1217: 5152-5157
42Wu J W, Chen H C, Ding W H. J. Chromatogr. A, 2013, 1302: 20-27
43Carro A M, Gonzalez P, Lorenzo R A. J. Chromatogr. A, 2013, 1319: 35-45
44Huang K J, Wei C Y, Liu W L, Xie W Z, Zhang J F, Wang W. J. Chromatogr. A, 2009, 1216: 6636-6641
45Wang W X, Yang T J, Li Z G, Jong T T, Lee M R. Anal. Chim. Acta, 2011, 690: 221-227
46Abdelhamid H N, Bhaisare M L, Wu H F. Talanta, 2014, 120: 208-217
47Patil S, Sandberg A, Heckert E, Self W, Seal S. Biomaterials, 2007, 28: 4600-4607
48Cortada C, dos Reis L C, Vidal L, Llorca J, Canals A. Talanta, 2014, 120: 191-197
49Cortada C, Vidal L, Canals A. Talanta, 2011, 85: 2546-2552
50Sereshti H, Heidari R, Samadi S.Food Chem., 2014, 143: 499-505
51Lee C H, Shin Y, Nam M W, Jeong K M, Lee J. Talanta, 2014, 129: 552-559
52Wu J, Xiang B, Xia J. Microchim. Acta., 2009, 166: 157-162
53Su Y S, Jen J F. J. Chromatogr. A, 2010, 1217: 5043-5049
54Gong A, Zhu X. Talanta, 2015, 131: 603-608
55Rajabi M, Ghanbari H, Barfi B, Asghari A, HajiEsfandiari S. Food Res. Int., 2014, 62: 761-770
56Moradi M, Yamini Y, Esrafili A, Seidi S. Talanta, 2010, 82: 1864-1869
57Yang Z H, Lu Y L, Liu Y, Wu T, Zhou Z Q, Liu D H. J. Chromatogr. A, 2011, 1218: 7071-7077
58Niazi A, Khorshidi N, Ghaemmaghami P. Spectrochim. Acta. A, 2015, 135: 69-75
59Xu X, Su R, Zhao X, Liu Z, Zhang Y, Li D, Li X, Zhang H, Wang Z. Anal. Chim. Acta, 2011, 707: 92-99
60Farajzadeh M A, Mogaddam M R, Ghorbanpour H. J. Chromatogr. A, 2014, 1347: 8-16
61Zhao A, Wang X, Ma M, Wang W, Sun H, Yan Z, Xu Z, Wang H. Microchim. Acta, 2012, 177: 229-236
62Berton P, Martinis E M, Wuilloud R G. J. Hazard. Mater., 2010, 176: 721-728
63Naeemullah, Kazi T G, Tuzen M. Food Chem., 2015, 172: 161-165
64Andruch V, Acebal C C, krlíková J, Sklenárová H, Solich P, Balogh I S, Billes F, Kocúrová L. Microchem. J., 2012, 100: 77-82
65Cheng J, Matsadiq G, Liu L, Zhou Y W, Chen G. J. Chromatogr. A, 2011, 1218: 2476-2482
66Baghdadi M, Shemirani F. Anal. Chim. Acta, 2009, 634: 186-191
67ZHANG HongYi, ZHANG ZhiJun, WANG ZiChuan, LIANG YuHuan. Chinese J. Anal. Chem., 2013, 41(12): 1875-1880
张红医, 张志军, 王子川, 梁玉环. 分析化学, 2013, 41(12): 1875-1880
68Fernández E, Vidal L, Iniesta J, Metters J P, Banks C E, Canals A. Anal. Bioanal. Chem., 2014, 406: 2197-2204
69LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. Anal. Chim. Acta, 2014, 807: 61-66
70Fernández E, Vidal L, MartinYerga D, Blanco Mdel C, Canals A, CostaGarcia A. Talanta, 2015, 135: 34-40
71LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. Anal. Bioanal. Chem., 2013, 405: 3269-3277
72LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. J. Chromatogr. A, 2011, 1218: 9128-9134
73Wu Q, Chang Q, Wu C, Rao H, Zeng X, Wang C, Wang Z. J. Chromatogr. A, 2010, 1217: 1773-1778
74Tseng W C, Chu S P, Kong P H, Huang C K, Chen J H, Chen P S, Huang S D. J. Agric. Food Chem., 2014, 62: 9059-9065
75Li Y, Chen P S, Huang S D. J. Chromatogr. A, 2013, 1300: 51-57
76Feng W, Jiang R, Chen B, Ouyang G. J. Chromatogr. A, 2014, 1361: 16-22
77Hunter T N, Pugh R J, Franks G V, Jameson G J. Adv. Colloid Interfac., 2008, 137: 57-81
78Almeida C, Fernandes J, Cunha S. Food Control, 2012, 25: 380-388
79Cunha S, Fernandes J, Oliveira M. J. Chromatogr. A, 2009, 1216: 8835-8844
80AsensioRamos M, RaveloPérez L M, GonzálezCurbelo M , HernándezBorges J. J. Chromatogr. A, 2011, 1218: 7415-7437
81Shih H K, Shu T Y, Ponnusamy V K, Jen J F. Anal. Chim. Acta, 2015, 854: 70-77
82Cistola D P, Hamilton J A, Jackson D, Small D M. Biochemistry, 1988, 27: 1881-1888
83Bravo B, Sánchez J, Cáceres A, Chávez G, Ysambertt F, Márquez N, Jaimes M, Briceno M I, Salager J L. J. Surfactants Deterg., 2008, 11: 13-19
84Igarashi S, Yotsuyanagi T. Microchim. Acta, 1992, 106: 37-44
85Gao S, Yang X, Yu W, Liu Z, Zhang H. Talanta, 2012, 99: 875-882
86Sun J N, Chen J, Shi Y P. Talanta, 2014, 125: 329-335
87Aridoss G, Laali K K. Tetrahedron. Lett., 2011, 52: 6859-6864
88Zhang J, Liang Z, Li S, Li Y, Peng B, Zhou W, Gao H. Talanta, 2012, 98: 145-151
89He H, Liu S, Meng Z, Hu S. J. Chromatogr. A, 2014, 1361: 291-298
90Anastas P T, Kirchhoff M M. Acc. Chem. Res., 2002, 35: 686-694
91Namiesnik J. Environ. Sci. Pollut. Res., 1999, 6: 243-244
92Spietelun A, Marcinkowski L, de la Guardia M, Namiesnik J. J. Chromatogr. A, 2013, 1321: 1-13
93Arthur C L, Pawliszyn J. Anal. Chem., 1990, 62: 2145-2148
94Kumar A,Malik A K, Tewary D K, Singh B. Anal. Chim. Acta, 2008, 610: 1-14
95Jeannot M A, Cantwell F F. Anal. Chem., 1997, 69: 235-239
96PedersenBjergaard S, Rasmussen K E. Anal. Chem., 1999, 71(14): 2650-2656
AbstractDispersive liquidliquid microextraction (DLLME) is a new sample preparation tool emerged recently. The dispersion of organic extraction solvent at microliter level in aqueous samples is the key step in DLLME. The strategies of dispersion for DLLME are roughly classified into three types in terms of the instruments used and their principles: physical dispersion method, insitu chemical reactionbased dispersion method and new dispersion mediumbased dispersion method. The physical dispersion method includes many submethods, such as mechanical shaking method, ultrasound/microwaveassisted method and solubilityadjustment method. The insitu chemical reaction method is referred to the two modes: the dispersed extraction solvent is formed by insitu chemical reaction or the dispersion of extraction solvent is caused by the gas generated from chemical reactions. The new dispersion mediumbased dispersion method uses some nonvolatile substances, such as mediumchain saturated fatty acids, ionic liquid, surfactant and kapok fiber fragments, to substitute the dispersive solvent used in conventional DLLME. 96 relevant literatures are cited here and the prospects are pointed out.



摘要 分散液液微萃取(DLLME)是近年出现的一种绿色样品处理手段,微升级萃取剂在样品溶液中的分散是完成DLLME至关重要的一步。本文根据萃取剂分散所使用的仪器和依据的原理,将分散方法分为:(1)物理分散法,包括机械振荡法、超声波/微波辅助法以及溶解度调节法等;(2)原位化学反应法,包含原位生成萃取剂和生成有助于萃取剂分散的气体等方法;(3)新分散介质法,是以非挥发性物质(饱和脂肪酸、离子液体、表面活性剂和木棉纤维碎片等)代替常规DLLME中分散剂的一种新的DLLME模式。本文引用了96篇相关文献,并对未来的发展进行了展望。
关键词;分散液液微萃取; 物理分散法; 原位化学反应; 非挥发性溶剂; 综述
1引言
2006年以来,分散液液微萃取(Dispersive liquidliquid microextraction, DLLME)[1]作为一种新型样品预处理技术,以其优异的绿色化学指标和数百倍以上的富集倍数等突出优点,得到了分析化学家的青睐。有关DLLME的SCI研究论文已超过千篇[2],综述论文多篇[2~11]。这些综述都很好地论述了DLLME在近几年取得的突破性进展,但是却没有专门针对萃取剂分散策略进行叙述的论文。
微升级的萃取剂在样品溶液中充分分散是完成DLLME至关重要的一步,因此,本文以此为着眼点, 对DLLME中所用的萃取剂分散法进行了归纳整理。按照实现分散过程所使用的设备和原理,将这些分散方法分为物理分散法、原位反应法和新分散介质法。从发展趋势来看,从初期的萃取剂、分散剂和水样三要素实现DLLME,发展到萃取剂和水样两要素实现DLLME,避免了由于分散剂而导致的萃取剂在水中溶解度增加和萃取效率降低的问题;从初期的依靠仪器设备的物理分散法,发展到原位反应法和分散介质法,避免了DLLME操作对于微波炉、超声波清洗器等设备的依赖,方法更简单、更容易实现;从初期的离线样品处理法,逐渐发展到在线处理法,实现了与后续仪器分析法的完美结合,绿色分析的特征更加突出。
2分散方法
2.1物理方法
2.1.1机械振荡法
机械振荡法是通过外力使萃取混合液发生剧烈运动而形成乳化的方法。依据产生运动所用设备的不同,可分为徒手振荡法[1]、涡旋仪法[13] 、振动仪法[14]、磁力搅拌器法[15]及空气辅助法[16]等,详见表1。徒手振荡法是最为简单的机械振荡分散法。但单靠手振荡很难达到理想的分散效果,通常需与其它分散法配合使用。Chung等[17]发现对萃取混合液先进行手振荡,再进行超声处理,可有效缩短超声处理时间。Tsai等[18]将萃取剂与分散剂的混合液加入到待测水溶液后,需再徒手剧烈振荡90 s才能得到萃取剂均匀分散的乳浊液。此外,已有大量文献[19~23]表明,分散过程中加入可溶性无机盐,有利于微升级别的萃取剂在水相中的分散。Ma等[20]将可溶性无机盐Na2SO4加到含二氯甲烷萃取剂的样品溶液中,徒手振荡1 min即可获得均匀分散的乳浊液。
MSUSAEME: manual shakingenhanced, ultrasoundassisted emulsification microextraction; LSC: little solvent consumption; TBME: tertbutyl methyl ether; SA: saltassisted; PTVGCMS : programmed temperature vaporization gas chromatographymass spectrometry; MSILDLLME: magnetic stirrer induced dispersive ionicliquid microextraction; GFAAS: graphite furnace atomic absorption spectrometry; AA: airassisted; SI: sequential injection; SVSIA: singlevalve sequential injection manifold; UESA: ultrasound enhanced surfactantassisted; UA: ultrasoundassisted; USA: ultrasoundassisted; MALDIMS: matrix assisted laser desorption/ionization mass spectrometry; UASEME: ultrasoundassisted surfactantenhanced emulsification microextraction; MA: microwaveassisted; ET: elevated temperature; ET: elevated temperature; TC: temperaturecontrolled; FI: flow injection; ETAAS: electrothermal atomic absorption spectrometry.[BG)W][HT5][HJ]
徒手振荡法用力难于恒定,会导致不同次的处理分析结果的波动。涡旋仪法利用涡旋仪产生的动能驱使萃取剂分散在待测溶液中,可避免徒手振荡法的不足。Seebunrueng等[24]用涡旋仪加速了低密度萃取剂的分散。2015年,该研究组又完善了该方法(如图1a),省去了分散剂,消除了分散剂加入可能导致的萃取效率下降的问题[25,26];通过AlCl3诱导分相,既减少了有机溶剂的用量,又省去了离心操作。Gure等[13]采用涡旋仪分散离子液体萃取剂,仅用30 s即可获得分散均匀的乳浊液。但涡旋仪法因单次处理量低,不适合于批量样品的预处理
a. 涡旋辅助分散液液微萃取盐诱导去乳化[25],b. 振动仪辅助分散液液微萃取[27], c. 分散悬浮微萃取[28] 。
a. vortexassisted DLLME and saltinduced demulsification (VADLLMESID)[25], b. upanddownshakerassisted dispersive liquidliquid microextraction (UDSADLLME)[27], c. dispersive suspended microextraction (DSME)[28].
振荡仪通过仪器的上下振动带动萃取溶液剧烈振动,使萃取剂分散在待测溶液中。该法可用于批量样品预处理。Wang等[14]将振荡仪引入DLLME的分散过程,他们还利用该装置萃取了水样中的三嗪类除草剂(图1b)[27]。Yang等[29]将磁力搅拌辅助分散应用于DLLME中。Petridis等[28]用此分散方法实现了水样中10种多环芳香烃的富集(图1c(E))。Henríquez [30]和Horstkotte [15] 等又将此技术用于自动化的微萃取中,不仅实现了投料与分散过程的自动化,也实现了分离与检测的一体化。
为了减少DLLME过程中对其它设备的依赖,Farajzadeh等[16]提出了空气辅助法,仅用注射器从萃取装置内反复抽取打出萃取混合液,即可实现分散过程。该方法无需加入分散剂,萃取剂仅需15 μL;所用设备简单,不需要涡旋仪[25]、振动仪[27,31]、磁力搅拌器[28]等特殊仪器的辅助。Guo等[32]利用现有自动进样器,实现了基于抽取与打出操作的DLLME自动化。Alexovi等[33]对该方法作了改进,只需将萃取剂猛力注入待测溶液中即可达到分散的目的,装置构造见图2。
2.1.2超声波、微波分散法Regueiro等[34]提出了超声分散法,利用超声“空化”效应实现了萃取剂的有效分散,于是在DLLME中减少甚至不用分散剂成为可能。可按有无使用分散剂对超声分散法进行分类(图3)。
有分散剂的超声分散法尽管会使用甲醇[35~40]、丙酮[34,41,42]、乙腈[43,44]及己烷[45]等有机溶剂作为分散剂,但用量相对于常规DLLME变少。为了避免使用易挥发性有机溶剂,Abdelhamid等[46]用阳离子表面活性剂溴化十六烷基三甲基铵(CTAB)代替前述的几种易挥发的分散剂,在超声波的辅助下实现了对血样中绿脓杆菌(P. aeruginosa)和金黄色葡萄球菌(S. aureus)的测定。实验前先用二氧化铈 (CeO2)纳米颗粒对CTAB进行修饰,得到CeO2@CTAB。由于CeO2拥有巨大的表面积,又可以通过静电作用使蛋白质分子吸附在其表面,以此提高有机萃取剂的生物亲和性[47]。在萃取过程中,为加强分散效果,需将加有CeO2@CTAB的乳浊液移至超声水浴中超声10 min。结果表明,此方法萃取效果良好,检出限仅为103~104 cfu/mL。
无分散剂的超声分散法可避免由于使用过量分散剂所产生的萃取效率下降的问题。无分散剂的超声分散法常用萃取剂有氯苯[48,49]、氯仿[50,51]、四氯乙烯[52]及甲苯[53]等。Gong等[54] 于313 K下对 [C8mimPF6]离子液体萃取剂作超声处理,温度和超声处理可使其很好地分散在水相中。
超声技术的应用可降低作为分散剂使用的有机溶剂用量,然而多数超声分散过程仍需5~10 min较长的处理时间[43,46,54,55],说明在超声波作用下萃取剂微液滴的形成仍然较慢[56]。此外,样品水温会随着超声操作时间变长而有一定程度的上升,在某些情况下可能会导致分析物分解[57]。这是超声辅助技术的局限性。
微波分散法是在DLLME中依靠微波实现萃取剂分散的方法。Niazi等[58]将注有250 μL分散剂的萃取混合液置于微波下处理,仅用60 s便得到了均匀分散的乳浊液。Xu等[59]又将该技术用于以离子液体为萃取剂的DLLME中,分散剂的用量也仅为750 μL。微波辅助分散所需分散剂的量由传统的mL级降至μL级。
2.1.3溶解度调节法 Farajzadeh等[65]通过调节温度改变萃取剂溶解度,完成其在样品溶液中的分散。该过程可分为两个阶段:(1)升温阶段:将装有样品的离心管置于75℃水浴中4 min后,将萃取剂和分散剂的混合液迅速注入离心管。由于温度提升以及微量分散剂的作用,萃取剂完全分散在样品溶液中;(2)降温阶段:用自来水冷却离心管4 min,由于温度降低萃取剂在样品溶液中的溶解度降低并分散出许多小液滴,使萃取混合溶液变浑浊。该法需要选择沸点较高的萃取剂,以避免升温所引起的萃取剂损失。Vaquez等[36]和Zhao等[61]利用类似的方法实现了具有较高沸点特性的离子液体萃取剂的有效分散。随后,Berton等[62]又利用该方法实现了DLLME的自动化。
2.2原位化学反应法
原位反应法是指利用某些水溶性、低毒性的试剂,通过原位生成萃取剂[66~68]或辅助分散的气体[69],使萃取剂均匀分散的方法,详见表2。
本课题组根据易溶于水的水合氯醛和NaOH在常温下可迅速反应生成氯仿的化学反应,建立了一种基于原位化学反应的分散氯仿萃取法\[67\]。该法在不需要使用分散剂的情况下实现了萃取剂的高度分散,同时也避免了氯仿在贮存过程中产生光气。
Fernández等[68]先将可溶性离子液体[Hmi][Cl]溶解于待测溶液中,再加入可溶性无机盐LiNTf2。手摇0.5 min后,[Hmim][Cl]便与LiNTf2原位生成均匀分散的疏水性萃取剂[Hmim][NTf2],原理如图3a。萃取完成后,即可将富含目标分析物的离子液体
相置于丝网印刷石墨电极(Screenprinted graphite electrode,SPGE)表面做电化学检测。随后,该组[70]利用HCl溶液将分析物从离子液体相反萃取到水相,克服了离子液体直接用于电化学检测适应性差的难题。
Valcárcel等[71,72]以Na2CO3与NaH2PO4原位生成的CO2气体为驱动力,实现了对毫克级固体吸附
SAISDLLME: sedimentation accelerated by inorganic saltdispersive liquid liquid microextraction; CZE: capillary zone electrophoresis; UAIL: ultrasoundassisted ionicliquid; VWD: variablewavelength detection; SPCEs: Screenprinted carbon electrodes; EA: effervescenceassisted; WLSSAE: water with low concentration of surfactant in dispersed solventassisted emulsion; ECD: electron capture detector; SA: surfactant assisted d; CE: capillary electrophoresis; FAEME: fiberassisted emulsification microextraction; FAIT: fattyacidbased intube; UV: UVvis detector.[BG)W][HT5][HJ]
剂的高度分散。2014年,该研究组又将该思路用于DLLME中[69],以Na2CO3为CO2源,乙酸为质子给予体,原理如图4b。在分散环节,为避免针柄产生额外的压力,需将250 μL含2.5 mL 3 mol/L冰乙酸、200 μL正辛醇萃取剂和100 mg磁性材料的萃取混合液从容器底部缓缓注入含2.5 mL 3 mol/L Na2CO3的待测溶液中。此时原位生成的CO2就会以泡腾的形式冒出,驱使萃取剂从底部逐渐分散在整个待测溶液里,仅需5 s便得到了萃取平衡液。此分散法仅借助简单的无机反应,实现了萃取剂的高度分散。
2.3新分散介质法
除了有机分散剂和辅助分散的设备外,某些低毒性的溶剂或分散材料也被用到DLLME的分散过程。这些溶剂或材料主要有表面活性剂、木棉纤维碎片、中链饱和脂肪酸、离子液体等,它们的使用使得DLLME更加绿色化,同时也简化了分散环节的操作步骤,详见表2。
表面活性剂分子因同时具有亲水和亲油性,已代替传统的有机分散剂\[65,73,74\],广泛应用于DLLME中。Cheng等\[65\]用0.5 g/L表面活性剂作为分散剂,辅助有机萃取剂成功地分散在含有11种多环芳香烃标样的待测溶液里。此过程无需使用有机分散剂,但表面活性的用量较高(g/L级)。2013年Li等\[75\]采用低浓度表面活性剂(低于1 mg/L)辅助法,将表面活性剂与萃取剂的混合液吸进打出4次(约10 s),即可得到均匀分散的乳浊液。2014年,该研究组又将此分散法与振动仪法作了对比研究[31],结果表明,低浓度表面活性剂法减少了有机溶剂的用量,明显缩短了乳化时间。
某些微米尺寸或更小的固体材料也可以起到与表面活性剂类似的作用。Feng等[76]将自制直径50 μm的木棉纤维碎片用作分散材料,利用其与水油两相的界面相互作用而达到分散的目的[77],避免了因加入分散剂而带来的萃取效率下降[78,79]和溶剂污染等问题[8,80]。
除了加入分散试剂或分散材料外,改变萃取剂在待测样品溶液中的存在状态,也可以实现萃取溶液的乳化过程。Shih等[81]测定水样中壬基苯酚(Nonylphenol, NP)和叔辛基苯酚(4tertoctylphenol, 4tOP)时,以庚酸为萃取剂,萃取原理如图5所示。可通过调节pH值控制庚酸在水溶液中的状态,当溶液的pH>pKa,可以电离出亲水性的阴离子端而溶解于待测溶液中,同时也具备了阴离子表面活性剂的性质[82~84]。当该阴离子表面活性剂进入水相后,疏水性的分析物便被萃取到其形成的胶束中。萃取完成后,将溶液调至pH
3结 论
绿色化学概念由Anastas等[90]于1991年提出,随后绿色分析化学(Green Analytical Chemistry,GCA)的概念在1999年随之提出[91]。文献中经常以3R(以绿色溶剂代替有毒溶剂,降低溶剂消耗和废物的产生,以及溶剂的循环利用)来概括绿色分析法的特征[92]。液相萃取(Liquidliquid extraction,LLE)和固相萃取(Solidphase extraction,SPE)是两种传统的和强有力的分离和预浓缩技术。然而,它们存在操作耗时、经常需要大量有毒有机溶剂等不符合绿色分析要求的缺点,为此需要发展可代替传统的LLE和SPE的微萃取技术。由Arthur and Pawliszyn[93]开创的固相微萃取技术(Solidphase microextraction,SPME)是一种出现较早的绿色样品制备技术,其萃取过程发生在聚合物涂层纤维上,而不需要有机溶剂。尽管SPME纤维越来越普及,但它仍存在一些明显的缺点,例如,它在有机溶剂中的不稳定性和溶胀、相对较贵的价格、较短的使用寿命及纤维断裂[92,94]。发展溶剂微萃取方法实为解决这些问题的一种办法。可将目前的溶剂微萃取技术粗略地分为三类:单滴微萃取技术(Singledrop microextraction, SDME)[95],中空纤维液相微萃取技术(Hollowfiber liquidphase microextraction, HFLPME)[96]和DLLME[1]。SDME具有操作简单、低消耗、降低了有毒有机溶剂的消耗、消除了可能的记忆效应以及可实现原位衍生萃取等优点。但也存在液滴的稳定性差、液滴表面积有限及精密度较低等缺点。HFLPME 凭借聚合物纤维作为萃取剂的载体可克服SDME使用中萃取剂损耗和移位等问题。DLLME是这3种溶剂微萃取技术中出现最晚的,具有操作简单、低消耗、高回收率、高富集倍数和极短的萃取时间等优点。
DLLME是近年来新出现的一种绿色样品预处理方法,实现萃取剂的有效分散是这种技术的关键步骤。物理分散方法(包括徒手振荡法、漩涡仪法、振荡仪法、空气辅助法、超声波法、微波法、溶解度改变法等)、原位化学反应法和新型分散介质法是主要的三类萃取剂分散方法。未来DLLME的研究可能会集中在如下3个方面: (1)联合萃取DLLME的一个主要缺点就是不适于复杂基质样品的处理[1]。为了解决这个问题,可将DLLME与其它前处理方法联合使用(例如,SPE和LLE),可获得高的样品净化效率(甚至可实现不经色谱分离的质谱和荧光检测),实现简单和高通量分析。(2)DLLME的自动化近年来,基于各种不同策略的实现DLLME自动化的技术相继出现[2]。但这些方法的装置相对复杂,与DLLME简单化的要求不一致。因此,减少或避免DLLME过程中对离心机、超声波、漩涡混匀器等的依赖, 在实现DLLME自动化的前提下,进一步实现与后续分析设备在线联用,也应是未来的发展方向之一。(3)无分散剂的DLLME和绿色化学反应有机分散剂不仅可能会降低萃取效率而且往往是有毒的有机物,采用低毒溶剂代替传统的分散剂和萃取剂也是需要进一步研究的领域[5]。尽管目前使用离子液体作为萃取剂有了很多应用实例,但离子液体萃取剂不适于气相色谱分析检测。另外,为了提高萃取效率而进行的衍生和络合反应也应采取绿色反应条件,避免使用有毒试剂,减少废物的产生。
References
1Rezaee M, Assadi Y, Milani Hosseini M R, Aghaee E, Ahmadi F, Berijani S. J. Chromatogr. A, 2006, 1116: 1-9
2Maya F, Horstkotte B, Estela J M, Cerdà V. Trends Anal. Chem., 2014, 59: 1-8
3HerreraHerrera A V,AsensioRamos M, HernándezBorges J, RodríguezDelgado M . Trends Anal. Chem., 2010, 29: 728-751
4ZgoaGrzeskowiak A, Grzeskowiak T. Trends Anal. Chem., 2011, 30: 1382-1399
5Saraji M, Boroujeni M K. Anal. Bioanal. Chem., 2014, 406: 2027-2066
6Andruch V, Burdel M, Kocúrov L, andrejov J, Balogh I S. Trends Anal. Chem., 2013, 49: 1-19
7Leong M I, Fuh M R, Huang S D. J. Chromatogr. A, 2014, 1335: 2-14
8Rezaee M, Yamini Y, Faraji M. J. Chromatogr. A, 2010, 1217: 2342-2357
9ZANG XiaoHuan, ZHANG GuiJiang, WANG Chun, WANG Zhi. Chinese Journal of Chromatography, 2015,33: 103-111
臧晓欢, 张贵江, 王 春, 王 志. 色谱, 2015, 33: 103-111
10ZANG XiaoHuan, WU QiuHua, ZHANG MeiYue, XI GuoHong, WANG Zhi. Chinese J. Anal. Chem., 2009, 37(1): 161-168
臧晓欢, 吴秋华, 张美月, 郗国宏, 王 志. 分析化学, 2009, 37(1): 161-168
11Kocúrová L, Balogh I S, andrejová J, Andruch V. Microchem. J., 2012, 102: 11-17
12Leong M I, Chang C C, Fuh M R, Huang S D. J. Chromatogr. A, 2010, 1217: 5455-5461
13Gure A, Lara F J, GarciaCampana A M, Megersa N, Del OlmoIruela M. Food Chem., 2015, 170: 348-353
14Wang K D, Chen P S, Huang S D. Anal. Bioanal. Chem., 2014, 406: 2123-2131
15Horstkotte B, Suarez R, Solich P, Cerdà V. Anal. Chim. Acta, 2013, 788: 52-60
16Farajzadeh M A, Mogaddam M R. Anal. Chim. Acta, 2012, 728: 31-38
17Chung R J, Leong M I, Huang S D. J. Chromatogr. A, 2012, 1246: 55-61
18Tsai W C, Huang S D. J. Chromatogr. A, 2009, 1216: 5171-5175
19Hosseini M H, Rezaee M, Mashayekhi H A, Akbarian S, Mizani F, Pourjavid M R. J. Chromatogr. A, 2012, 1265: 52-56
20Ma H, Li Y, Zhang H, Shah S M, Chen J. J. Chromatogr. A, 2014, 1358: 14-19
21Haji Hosseimi M, Asaadi P, Rezaee M, Reza Rezaei M, Reza Pourjavid M, Arabieh M, Abhari A A. Chromatographia, 2013, 76: 1779-1784
22Moniruzzaman M, Rodriguez I, Rodriguez-Cabo T, Cela R, Sulaiman S A, Gan S H. J. Chromatogr. A, 2014, 1368: 26-36
23Haddadi H, Rezaee M, Semnani A, Mashayekhi H A. Bull. Chem. Soc. Jpn., 2013, 86: 1282-1286
24Seebunrueng K, Santaladchaiyakit Y, Srijaranai S. Chemosphere, 2014, 103: 51-58
25Seebunrueng K, Santaladchaiyakit Y, Srijaranai S. Talanta, 2015, 132: 769-774
26Chen H, Chen R, Li S. J. Chromatogr. A, 2010, 1217: 1244-1248
27Chen P S, Haung W Y, Huang S D. J. Chromatogr. B, 2014, 955956: 116-123
28Petridis N P, Sakkas V A, Albanis T A. J. Chromatogr. A, 2014, 1355: 46-52
29Yang Z H, Liu Y, Lu Y L, Wu T, Zhou Z Q, Liu D H. Anal. Chim. Acta, 2011, 706: 268-274
30Henriquez C, Horstkotte B, Solich P, Cerdà V. Anal. Bioanal. Chem., 2013, 405: 6761-6769
31Tseng W C, Chen P S, Huang S D. Talanta, 2014, 120: 425-432
32Guo L, Lee H K. Anal. Chem., 2014, 86: 3743-3749
33Alexovi M, Wieczorek M, Kozak J, Koscielniak P, Balogh I S, Andruch V. Talanta, 2015, 133: 127-133
34Regueiro J, Llompart M, GarciaJares C, GarciaMonteagudo J C, Cela R. J. Chromatogr. A, 2008, 1190: 27-38
35Zhang Y, Lee H K. Anal. Chim. Acta, 2012, 750: 120-126
36Vázquez M P, Vázquez P P, Galera M M, Moreno A U. J. Chromatogr. A, 2014, 1356: 1-9
37Fernández P, González C, Pena M T, Carro A M, Lorenzo R A. Anal. Chim. Acta, 2013, 767: 88-96
38Zhang J, Gao H, Peng B, Li S, Zhou Z. J. Chromatogr. A, 2011, 1218: 6621-6629
39Vázquez M M, Vázquez P P, Galera M M, Garcia M D. Anal. Chim. Acta, 2012, 748: 20-27
40Jofre V P, Assof M V, Fanzone M L, Goicoechea H C, Martinez L D, Silva M F. Anal. Chim. Acta, 2010, 683: 126-135
41Yan H, Liu B, Du J, Yang G, Row K H. J. Chromatogr. A, 2010, 1217: 5152-5157
42Wu J W, Chen H C, Ding W H. J. Chromatogr. A, 2013, 1302: 20-27
43Carro A M, Gonzalez P, Lorenzo R A. J. Chromatogr. A, 2013, 1319: 35-45
44Huang K J, Wei C Y, Liu W L, Xie W Z, Zhang J F, Wang W. J. Chromatogr. A, 2009, 1216: 6636-6641
45Wang W X, Yang T J, Li Z G, Jong T T, Lee M R. Anal. Chim. Acta, 2011, 690: 221-227
46Abdelhamid H N, Bhaisare M L, Wu H F. Talanta, 2014, 120: 208-217
47Patil S, Sandberg A, Heckert E, Self W, Seal S. Biomaterials, 2007, 28: 4600-4607
48Cortada C, dos Reis L C, Vidal L, Llorca J, Canals A. Talanta, 2014, 120: 191-197
49Cortada C, Vidal L, Canals A. Talanta, 2011, 85: 2546-2552
50Sereshti H, Heidari R, Samadi S.Food Chem., 2014, 143: 499-505
51Lee C H, Shin Y, Nam M W, Jeong K M, Lee J. Talanta, 2014, 129: 552-559
52Wu J, Xiang B, Xia J. Microchim. Acta., 2009, 166: 157-162
53Su Y S, Jen J F. J. Chromatogr. A, 2010, 1217: 5043-5049
54Gong A, Zhu X. Talanta, 2015, 131: 603-608
55Rajabi M, Ghanbari H, Barfi B, Asghari A, HajiEsfandiari S. Food Res. Int., 2014, 62: 761-770
56Moradi M, Yamini Y, Esrafili A, Seidi S. Talanta, 2010, 82: 1864-1869
57Yang Z H, Lu Y L, Liu Y, Wu T, Zhou Z Q, Liu D H. J. Chromatogr. A, 2011, 1218: 7071-7077
58Niazi A, Khorshidi N, Ghaemmaghami P. Spectrochim. Acta. A, 2015, 135: 69-75
59Xu X, Su R, Zhao X, Liu Z, Zhang Y, Li D, Li X, Zhang H, Wang Z. Anal. Chim. Acta, 2011, 707: 92-99
60Farajzadeh M A, Mogaddam M R, Ghorbanpour H. J. Chromatogr. A, 2014, 1347: 8-16
61Zhao A, Wang X, Ma M, Wang W, Sun H, Yan Z, Xu Z, Wang H. Microchim. Acta, 2012, 177: 229-236
62Berton P, Martinis E M, Wuilloud R G. J. Hazard. Mater., 2010, 176: 721-728
63Naeemullah, Kazi T G, Tuzen M. Food Chem., 2015, 172: 161-165
64Andruch V, Acebal C C, krlíková J, Sklenárová H, Solich P, Balogh I S, Billes F, Kocúrová L. Microchem. J., 2012, 100: 77-82
65Cheng J, Matsadiq G, Liu L, Zhou Y W, Chen G. J. Chromatogr. A, 2011, 1218: 2476-2482
66Baghdadi M, Shemirani F. Anal. Chim. Acta, 2009, 634: 186-191
67ZHANG HongYi, ZHANG ZhiJun, WANG ZiChuan, LIANG YuHuan. Chinese J. Anal. Chem., 2013, 41(12): 1875-1880
张红医, 张志军, 王子川, 梁玉环. 分析化学, 2013, 41(12): 1875-1880
68Fernández E, Vidal L, Iniesta J, Metters J P, Banks C E, Canals A. Anal. Bioanal. Chem., 2014, 406: 2197-2204
69LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. Anal. Chim. Acta, 2014, 807: 61-66
70Fernández E, Vidal L, MartinYerga D, Blanco Mdel C, Canals A, CostaGarcia A. Talanta, 2015, 135: 34-40
71LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. Anal. Bioanal. Chem., 2013, 405: 3269-3277
72LasarteAragonés G, Lucena R, Cárdenas S, Valcárcel M. J. Chromatogr. A, 2011, 1218: 9128-9134
73Wu Q, Chang Q, Wu C, Rao H, Zeng X, Wang C, Wang Z. J. Chromatogr. A, 2010, 1217: 1773-1778
74Tseng W C, Chu S P, Kong P H, Huang C K, Chen J H, Chen P S, Huang S D. J. Agric. Food Chem., 2014, 62: 9059-9065
75Li Y, Chen P S, Huang S D. J. Chromatogr. A, 2013, 1300: 51-57
76Feng W, Jiang R, Chen B, Ouyang G. J. Chromatogr. A, 2014, 1361: 16-22
77Hunter T N, Pugh R J, Franks G V, Jameson G J. Adv. Colloid Interfac., 2008, 137: 57-81
78Almeida C, Fernandes J, Cunha S. Food Control, 2012, 25: 380-388
79Cunha S, Fernandes J, Oliveira M. J. Chromatogr. A, 2009, 1216: 8835-8844
80AsensioRamos M, RaveloPérez L M, GonzálezCurbelo M , HernándezBorges J. J. Chromatogr. A, 2011, 1218: 7415-7437
81Shih H K, Shu T Y, Ponnusamy V K, Jen J F. Anal. Chim. Acta, 2015, 854: 70-77
82Cistola D P, Hamilton J A, Jackson D, Small D M. Biochemistry, 1988, 27: 1881-1888
83Bravo B, Sánchez J, Cáceres A, Chávez G, Ysambertt F, Márquez N, Jaimes M, Briceno M I, Salager J L. J. Surfactants Deterg., 2008, 11: 13-19
84Igarashi S, Yotsuyanagi T. Microchim. Acta, 1992, 106: 37-44
85Gao S, Yang X, Yu W, Liu Z, Zhang H. Talanta, 2012, 99: 875-882
86Sun J N, Chen J, Shi Y P. Talanta, 2014, 125: 329-335
87Aridoss G, Laali K K. Tetrahedron. Lett., 2011, 52: 6859-6864
88Zhang J, Liang Z, Li S, Li Y, Peng B, Zhou W, Gao H. Talanta, 2012, 98: 145-151
89He H, Liu S, Meng Z, Hu S. J. Chromatogr. A, 2014, 1361: 291-298
90Anastas P T, Kirchhoff M M. Acc. Chem. Res., 2002, 35: 686-694
91Namiesnik J. Environ. Sci. Pollut. Res., 1999, 6: 243-244
92Spietelun A, Marcinkowski L, de la Guardia M, Namiesnik J. J. Chromatogr. A, 2013, 1321: 1-13
93Arthur C L, Pawliszyn J. Anal. Chem., 1990, 62: 2145-2148
94Kumar A,Malik A K, Tewary D K, Singh B. Anal. Chim. Acta, 2008, 610: 1-14
95Jeannot M A, Cantwell F F. Anal. Chem., 1997, 69: 235-239
96PedersenBjergaard S, Rasmussen K E. Anal. Chem., 1999, 71(14): 2650-2656
AbstractDispersive liquidliquid microextraction (DLLME) is a new sample preparation tool emerged recently. The dispersion of organic extraction solvent at microliter level in aqueous samples is the key step in DLLME. The strategies of dispersion for DLLME are roughly classified into three types in terms of the instruments used and their principles: physical dispersion method, insitu chemical reactionbased dispersion method and new dispersion mediumbased dispersion method. The physical dispersion method includes many submethods, such as mechanical shaking method, ultrasound/microwaveassisted method and solubilityadjustment method. The insitu chemical reaction method is referred to the two modes: the dispersed extraction solvent is formed by insitu chemical reaction or the dispersion of extraction solvent is caused by the gas generated from chemical reactions. The new dispersion mediumbased dispersion method uses some nonvolatile substances, such as mediumchain saturated fatty acids, ionic liquid, surfactant and kapok fiber fragments, to substitute the dispersive solvent used in conventional DLLME. 96 relevant literatures are cited here and the prospects are pointed out.

