应用于小鼠早期胚胎细胞的ChIP-seq体系中基因组水解酶的筛选
高晗 钟蓓

摘要:在过去的十几年中,染色质免疫共沉淀测序技术(ChIP-seq)成为了分析表观基因组和鉴定DNA相关蛋白重要结合位点的主要技术。然而,ChIP-seq技术目前仍存在一些技术难点。其中一个重要限制是ChIP-seq需要大量的起始材料,需要至少数百万个细胞才能启动,然而实验中有两个关键步骤往往会造成所使用的样本丢失,即染色质制备和免疫沉淀。本实验通过从染色体制备入手,通过选择两种不同核酸水解酶DNase和MNase,设计不同实验组验证最佳酶切浓度,以优化ChIP-seq体系。结果证明0.1U/μL的MNase为本实验中ChIP-seq最佳酶切浓度。结果为ChIP-seq体系的优化提供了参考,对ChIP-seq技术在小鼠早期胚胎细胞中的应用以及发展有一定的积极意义。
关键词:小鼠早期胚胎;ChIP-seq;核酸水解酶;酶切效率
中图分类号:S865.1?文献标识码:A文章编号:2095-9737(2020)01-0008-04
Abstract:In the past decade,Chromatin immunoprecipitation followed by sequencing,ChIP-Seq has become the main technology to analyze epigenome and identify important binding sites of DNA related proteins.However, chip-seq still has some technical difficulties.One important limitation is that chip-seq requires a large amount of starting material,which requires at least millions of cells to start.However, chromatin preparation and immunoprecipitation as two key steps in the experiment usually result in the loss of samples.This experiment started with chromosome preparation,in order to optimize the ChIP-seq system, two different nuclease hydrolases DNase and MNase were selected to design different experimental groups.The results showed that 0.1U/μL MNase was the optimal concentration of ChIP-seq.The results provide a reference for the optimization of ChIP-seq system, and have positive significance for the application and development of chip-seq technology in early mouse embryonic cells.
Key words:Early embryo of mouse; ChIP-seq; Nucleic acid hydrolase; Enzyme digestion efficiency
目前,结合染色质免疫沉淀(chromatin immunoprecipitation assay,ChIP)和下一代测序(Sequencing)的染色质免疫共沉淀测序技术(ChIP-seq)因其能够真实、完整地反映结合在DNA序列上的靶蛋白的调控信息,已使许多细胞系和组织类型的全基因组表观遗传学分析成为可能,并常使用这一方法研究蛋白质和核酸之间的相互作用[1]。
ChIP-seq的原理是:首先通过染色质免疫共沉淀技术,使用特异性抗体对DNA结合蛋白进行免疫沉淀。然后将结合的DNA共沉淀、纯化;随后对富集得到的DNA片段进行高通量测序。将获得的上百万条序列标签精确定位到对应的基因组上,然后得到全基因组范围内与组蛋白、转录因子等互作的DNA区段信息。然而ChIP-seq的一个主要限制是需要大量的细胞来生成高质量的数据集,需要的细胞数量往往在百万级别,而这一实验的两个关键步骤往往会造成样本丢失:染色质制备和免疫沉淀。这就排除了使用這一技术对罕见细胞群的研究。在染色质制备上面,可以有超声和酶切消化两种方法。由于早期胚胎细胞分裂十分旺盛,染色质比较疏松,且含有许多细胞质[2],若使用传统的超声方法制备染色质,裂解液中会溶解大量的细胞质蛋白,对后一步免疫沉淀过程产生影响,且超声的方法重复性差和具备样品多的特点不适合早期胚胎细胞量少的情况。
因此,本实验希望从染色体制备这一实验环节入手,利用核酸水解酶将染色质酶切成100~200 bp左右的单核小体片段。而实现这一目标则需要选择合适种类的基因组水解酶以及摸索出合适的ChIP体系。因而本实验对使用的基因组水解酶进行种类和离子浓度的筛选,进而对小鼠早期胚胎细胞进行ChIP-seq的体系进行优化。
1?核酸水解酶的选择
本实验中选用两种不同的核酸水解酶进行筛选:脱氧核糖核酸酶(DNase)和微球菌核酸酶(MNase)。
DNaseI是一种可以消化单链或双链DNA产生单脱氧核苷酸或单链或双链的寡脱氧核苷酸的核酸内切酶。DNaseI水解单链或双链DNA后的产物,5'端为磷酸基团,3'端为羟基。DNaseI 活性依赖于钙离子,并能被镁离子或二价锰离子激活。镁离子存在条件下,DNaseI可随机剪切双链DNA的任意位点;二价锰离子存在条件下,DNaseI可在同一位点剪切DNA双链,形成平末端,或1~2个核苷酸突出的粘末端。
MNase是由金黄色葡萄球菌分泌的一种胞外核酸内切酶,可以较好地分解DNA中富含AT区域或RNA中富含AU区域,产物为3'-磷酸的单核苷酸或寡核苷酸。MNase在核酸水解、RNA测序、染色质和蛋白质的结构研究等方面都具有重要意义。
2?材料与方法
2.1?材料
大量小鼠胚胎内层细胞团(R1),大量猪胚胎成纤维细胞(PEF),PBS,0.3%BSA,1%甲醛,125 mmol/L甘氨酸(Glycine),核酸提取缓冲液(MNase Master mix),MNase反应混合物,MNase Stop Buffer,Nuclear Breaker Buffer,核酸电泳相关试剂等。
2.2?方法
2.2.1?设置实验组
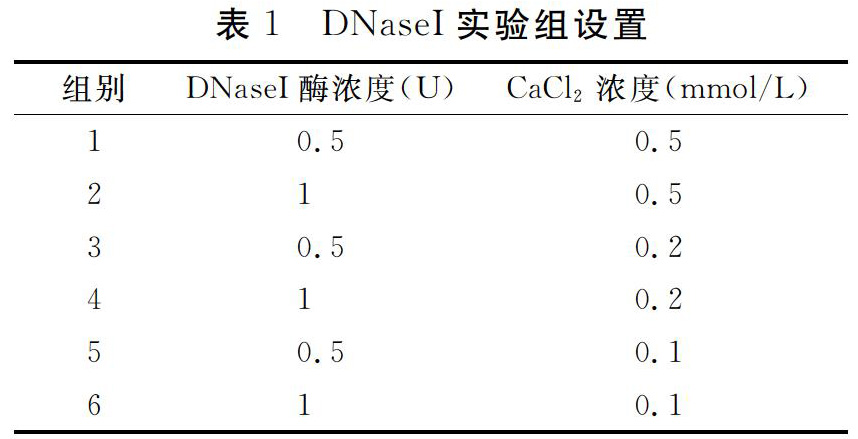
DNaseI:调整钙离子浓度和酶浓度,分别设置六组实验,具体见表1。
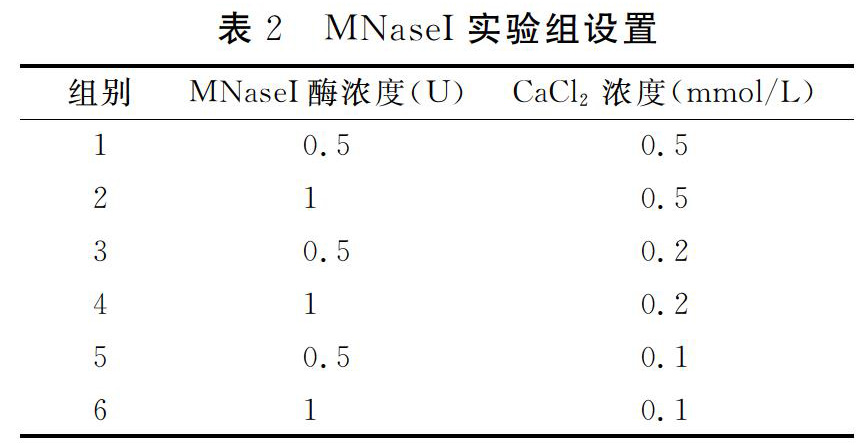
MNase:调整钙离子浓度和酶浓度,分别设置六组实验,具体见表2。
2.2.2?DNaseI酶切浓度验证
(1)消化大量R1细胞后用PBS+0.3%BSA洗2次;
(2)1%的甲醛室温固定15 min,混旋固定;
(3)用125?mmol/L的甘氨酸(Glycine)解交联,室温混旋5 min;
(4)4℃离心500 g 5 min,用预冷的PBS+0.3%BSA洗2次,弃上清加入20 μL Nuclei Extraction on Buffer和30 μL MNase Master mix,25℃水浴6 min;
(5)加5.5 μL MNase Stop Buffer、5.5 μL Nuclear Breaker Buffer、1 μL PIC和130 μL CHIP Buffer,混匀后吸出10 μL作为Input;
(6)加100 μL CHIP Buffer洗一遍抗体结合的磁珠,将样品加入磁珠中4℃过夜;
(7)用预冷的Low Salt Wash Buffer和High Salt Wash Buffer分别洗2次,加入100 μL Hot Elution Buffer,Input中加入90 μL Elution Buffer,样品放入65℃水浴锅中水浴1.5~2 h后用DNA片段的回收试剂盒进行回收纯化,并跑胶;
(8)随后使用大量PEF细胞对结果较好组进行重复验证。
2.2.3?MNaseI酶切浓度验证
(1)消化大量R1细胞后用PBS+0.3%BSA洗2次;
(2)1%的甲醛室温固定15 min,混旋固定;
(3)用125 mmol/L的甘氨酸Glycine解交联,室温混旋5 min;
(4)4℃离心500 g 5 min,用预冷的PBS+0.3%BSA洗2次,弃上清加入20 μl Nuclei Extraction on Buffer和30 μL MNase Master mix,25℃水浴6 min;
(5)加5.5 μL MNase Stop Buffer、5.5 μL Nuclear Breaker Buffer、1 μL PIC和130 μL CHIP Buffer,混匀后吸出10 μL作为Input;
(6)加100 μL CHIP Buffer洗一遍抗体结合的磁珠,将样品加入磁珠中4℃过夜;
(7)用预冷的Low Salt Wash Buffer和High Salt Wash Buffer分别洗2次,加入100 μL Hot Elution Buffer,Input中加入90 μL Elution Buffer,样品放入65℃水浴锅中水浴1.5~2 h后用DNA片段的回收试剂盒进行回收纯化,并跑胶。
3?结果与分析
3.1?DNaseI酶切浓度验证
3.1.1?大量R1细胞不同实验组跑胶图
由图1可知,在1~6组的DNaseI酶浓度以及钙离子浓度下,DNaseI酶切后所获得片段条带大多数大于250 bp。
3.1.2?对1和5组使用大量PEF细胞和R1细胞进行重新验证
由2图和图3可知,在1和5组的DNaseI酶浓度以及钙离子浓度下,PEF细胞和R1细胞DNaseI酶切后所获得片段条带为100~250 bp左右。
3.2?MNase酶切浓度验证
3.2.1?使用R1细胞进行了MNase酶切浓度的摸索
根据2.2.1中实验组的设置,使用R1细胞进行了MNase酶切浓度的摸索。发现0.1 U/μL即可获得目标长度的条带,故选用0.1 U/μL的MNase作为后续实验浓度。
3.2.2?进行不同样本量(1、2、5、10和20个克隆)的R1细胞0.1 U/μL MNase酶切浓度验证
1:1个克隆,In1:1组INPUT;2:2个克隆,In2:2组INPUT;5:5个克隆,In5:5组INPUT;10:2个克隆,In10:10组INPUT;20:20個克隆,In20:20组INPUT
由图4可知,使用0.1 U/μL浓度的MNase进行酶切在五组不同样本量的(1、2、5、10和20个克隆)R1细胞实验组中均可获得目标长度(100~200 bp左右)的条带。实验验证了使用0.1 U/μLMNase酶切浓度进行酶切在小样本量中也可获得目标长度的条带,达到较理想的实验效果。
根据以上实验结果选用0.1 U/μL即可获得高质量的目标长度(100~200 bp左右)的条带。
3.3?分析
使用DNaseI消化小鼠早期胚胎细胞后得到染色质片段多大于250 bp,重复验证后得到的染色质片段也在100~250 bp左右,因而通过DNaseI消化小鼠早期胚胎细胞不能保证所获得的染色质均为高质量的单核小体,可能存在大于250 bp的双核小体,对于后续ChIP-seq实验效率有一定影响。而选用MNase的消化小鼠早期胚胎细胞后得到染色质片段多为100~200 bp左右,其中0.1 U/μL的MNase能得到高质量单核小体的目标长度。
因此,本ChIP-seq体系中选用0.1 U/μL的MNase作为后续实验的最佳浓度。
4?讨论
ChIP-seq技术可以应用到任何基因组序列已知的物种,通过测序完整揭示免疫沉淀富集的DNA片段包含的蛋白定位信息。近些年来,ChIP-seq技术已经发展成为研究转录因子结合位点和组蛋白修饰的最有力的实验手段。而基于多种高通量测序平台的ChIP-seq在基因调控网络研究中也发挥着重要作用。
进行ChIP实验关键的一个步骤就是染色质的制备,根据小鼠早期胚胎细胞的性质,传统的利用超声制备染色质的方法显然不可行,因此本实验通过筛选核酸酶种类以及酶浓度和钙离子浓度,选择使用0.1 U/μL微球菌核酸酶(MNase)消化,来制备高质量的单核小体染色质。
本实验中对应用于小鼠早期胚胎细胞的ChIP-seq体系中的基因组水解酶的筛选,对早期胚胎细胞的研究产生一定积极意义。以小鼠早期胚胎细胞为材料进行ChIP-seq,可以用于研究转录因子或其它表观遗传修饰的信息,并可为改良育种提供高效和正确的遗传信息。实验中这一体系的获得,为制备高质量的单核小体染色质、将ChIP应用于样本量较少的小鼠早期胚胎细胞中提供了一定参考,减少了早期胚胎细胞样本量少、分裂活动旺盛、染色质较为疏松、含有大量的细胞质等特点对ChIP-seq实验的影响。对现在正在火热进行的Low Input ChIP-seq的研究有一定积极作用。
参考文献:
[1] Chen Y W,Negre N,Li Q H,et al. Systematic evaluation of factors influencing ChIP-seq fidelity[J].Nat Methods,2012,9(6):609-614.
[2]?展望,王文,施威揚.长牡蛎中ChIP-seq方法的建立[J].海洋与湖沼,2015,46(6):1557-1563.

