芳胺—甘二肽钴(Ⅱ)、镍(Ⅱ)配合物的超氧化物歧化酶活性及其与人血清白蛋白的相互作用研究
马俊怀等


摘 要 以甘氨酰甘氨酸(Glygly)为第一配体,2,2′联吡啶(2,2′bpy)、4,4′联吡啶(4,4′bpy)和邻菲罗啉(Phen)为第二配体,与金属钴和镍的硝酸盐作用,合成了6种新的金属配合物,采用红外光谱方法、元素分析、差热热重和核磁共振等方法对其进行了表征。并通过氯化硝基四氮唑蓝(Four nitrogen chloride nitro blue, NBT)光照还原法测试了配合物的 超氧化物歧化酶(Superoxide dismutase, SOD)活性。为探讨配合物在血液中的行为,用荧光光谱法研究了配合物和人血清白蛋白(human serum albumin, HSA)之间的相互作用。结果表明:所合成的配合物的化学组成为\[M(Glygly)(2,2′bpy/Phen)(H2O)\]·2H2O 和[M2(Glygly)2(4,4′bpy)(H2O)4]·4H2O 。6种配合物均具有良好的SOD活性和较好的细胞相容性,IC50值的范围为0.327~0.564 μmol/L。 与HSA作用的结果表明,配合物可与HSA分子作用生成复合物,可以通过HSA输送配合物,在生物体内发挥其作用。
关键词 甘二肽; 芳胺; 配合物; 超氧化物歧化酶活性; 人血清白蛋白
1 引 言
超氧化物歧化酶(SOD)是一类广泛存在于动物、植物、微生物中的金属酶,作为生物体内自由基的清洁剂,SOD对生物体具有重要的功能作用。天然 SOD 有许多不足之处,如分子量大、稳定性低、膜透性差、易受胃蛋白酶分解和价格昂贵等,使其应用受到较大的限制。因此设计和合成既能避免天然酶自身不足,同时又具有较高 SOD 活性的小分子 SOD 模拟物,已成为生物化学领域的研究热点之一[1~3]。由于二肽在生物体内具有良好的生理活性,作为配体能有效提高生物利用率和配合物的生物活性,降低毒副作用,SOD 模拟物中以二肽和芳胺为配体的铜配合物的研究报道较多[4],例如,丁杨等[5]合成的二肽铜多吡啶三元配合物表现出了良好SOD活性,可作为SOD模拟物;Tabassum等[6]合成的\[Cu2(Glygly)2(ppz)(H2O)4\] ·2H2O配合物具有对DNA分子的氧化切割作用,对拓扑异构酶I也具有很好的抑制作用,同时还具有很小的SOD活性的IC50值,该配合物具有较好的应用前景。为了探索其它过渡金属的二肽配合物的SOD 活性,本课题组设计合成了未见报道的具有SOD活性的6种Co和Ni的甘氨酰甘氨酸和2,2′bpy,4,4′bpy,Phen为配体的配合物,采用NBT(氯化硝基四氮唑蓝)光照还原法测试了它们的SOD活性,并测试了配合物浓度对其SOD活性的影响。 结果表明,合成的6种金属配合物与文献[7~12]相比,金属配合物有较好的清除超氧自由基的作用。配合物的SOD活性表现出规律性的变化,即随配体中分子平面性的增加而减小。对6种合成的配合物与HSA(人血清白蛋白)分子之间的相互作用采用光谱方法进行了研究。结果表明,配合物与人血清白蛋白相互作用形成了一种新的复合物。配合物与HSA分子结合后,可以被HSA 分子输送,在体内发挥其消除自由基的作用。
2 实验部分
2.1 仪器与试剂
FTS3000 FTIR傅里叶红外光谱仪(DIGILAB公司),TG/DTA6300热重差热分析仪(美国PE公司),LS55荧光分光光度计(美国PE公司),Mercury plus 400超导核磁仪(美国Varian公司),2400CHN型元素分析仪(美国PE公司)。
甘二肽(C4H8N2O3,生化试剂,98%,成都蒽萊生物科技有限公司);2,2′联吡啶(2,2′bpy)、4,4′联吡啶(4,4′bpy)、邻菲罗啉(Phen)、无水乙醇均为市售分析纯试剂;甲硫氨酸(MET)、 核黄素 (VB2) 和氯化硝基四氮唑蓝 (NBT) 为生化试剂,整个实验过程均使用二次蒸馏水。
2.2 配合物的合成
分别将5 mL 含 0.5 mmol甘二肽的水溶液、10 mL含 0.5 mmol的2,2′联吡啶无水乙醇溶液滴加到5 mL 0.1 mol/L Co(NO3)2溶液中,再用 1 mol/L NaOH 溶液调节至pH 8.0~8.2。 在氮气保护下,80℃回流搅拌3 h,室温搅拌8 h后过滤,滤液室温下静置挥发,数周后析出红色颗粒状晶体,过滤后干燥保存。其它5种配合物的合成方法与之类似。
2.3 配合物的SOD活性测试
采用 NBT光照还原法测定配合物的SOD活性,用磷酸盐缓冲液(pH=7.8)配制含有以下物质的混合溶液:空白组:3.3×10
Symbolm@@ 5 mol/L核黄素、0.01 mol/L甲硫氨酸(MET)、4.6×10
Symbolm@@ 5 mol/L NBT;配合物组:空白组加入0.6×10
Symbolm@@ 6 mol/L配合物。将以上两组混合溶液分别置于30℃的恒温水浴中保温10 min,然后用荧光灯照射3 min,用722型分光光度计测定560 nm处溶液的吸光度。每种混合溶液平行测定3次,取平均值。
2.4 配合物和人血清白蛋白(HSA)之间的作用
用pH=7.15的TrisHCl缓冲溶液将HSA配制成浓度为1×10
Symbolm@@ 5 mol/L溶液,加入配合物溶液,在室温下反应3 min,固定激发波长和发射波长间距Δλ=15 nm,Δλ=60 nm,扫描同步荧光光谱。入射狭缝和出射狭缝宽设为5 nm,扫描速度固定为240 nm/min。
2.5 配合物的细胞相容性测试
将培养好的人肝癌细胞HepG2细胞接种于96孔培养板中,分别加入浓度为0.6×10
Symbolm@@ 6 mol/L配合物20 μL,对照组加等体积的1640培养基, 24 h后,加入MTT溶液10 μL,孵育后,用酶标仪(波长570 nm)测定其吸光度值,计算细胞的生长存活率。
3 结果与讨论
3.1 配合物的表征
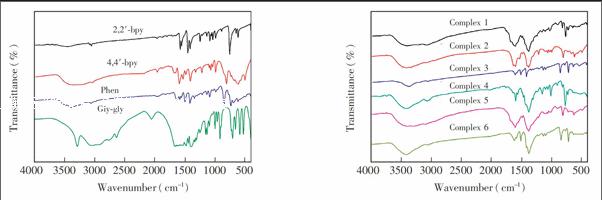
Symbolm@@ 1 附近吸收峰归属于CN伸缩振动,且相对于配体中的CN吸收峰向低波数移动,表明芳胺配体中的N原子参与了配位。由以上配体中和配合物中相应配位基团的红外光谱吸收峰的变化说明了配合物的生成。配合物在3408~3336 cm
Symbolm@@ 1处强的吸收峰归属于羟基的对称和反对称的伸缩振动吸收峰,配合物中有水分子和羟基存在。配体及其配合物的主要红外数据列于表1。
[KH*4D][HT5”SS][HJ*4]表1 配合物的主要红外光谱数据(cm
Symbolm@@ 1)
Table 1 Selected IR data (ν/cm
Symbolm@@ 1) of the complexes
[HT6SS][BG(][BHDFG3,WK15,WK7。6W]配体及配合物Ligands and complexs
3.1.2 元素分析
根据元素分析结果和文献报道[5,6],推测配合物2 和配合物5 具有双核结构,其余具有单核结构,配合物的元素分析结果和化学组成见表2。
[KH*4D][HT5”SS][HJ*4]表2 配合物的化学组成和元素分析
Table 2 Results of elemental analysis and composition of the complexes
[HT6SS][BG(][BHDFG4*2,WK33,WK24W]配合物
Complex实测值 Found(理论值 Calcd.)
碳含量
3.1.3 配合物的热分解性质 配合物3 (Co甘二肽邻菲罗啉配合物)的热分解过程如图3所示 (αAl2O3,氮气气氛,气流速率为50 mL/min,升温速度为10℃/min,温度范围为25℃~800℃)。在25℃~120℃范围内,出现第一个失重台阶,失重率约为9.0%,相当于2个H2O分子的失重率(理论值8.5%),说明配合物的外界有2个结晶H2O分子。在151℃~789℃范围出现第两个失重台阶,失重率约为75.1%,相当于一个甘二肽分子、一个邻菲罗啉分子和一个H2O的失重率(理论值74.0%),且在179℃产生了较强的放热峰,可能是配合物的热分解过程,伴随配体甘二肽分子和邻菲罗啉分子的同时失去和分解, 750℃后曲线趋于平缓,最终产物为金属氧化物CoO,残留重13.8%,与理论值13.9%基本相符,故推测配合物3的化学式为 \[Co(Glygly)(Phen)(H2O)\]·2H2O 。其它几种具有相同配体的配合物的热谱图较为相似,进而推断它们具有相似的化学式和分子结构。6种配合物的热重差热数据列于表3。
3.1.4 配合物的核磁共振谱 (1H NMR) 将配合物\[Co2(Glygly)2(4,4bpy)(H2O)4\]·4H2O的核磁共振光谱图(1H NMR,D2O, 400 MHz)与配体的核磁共振光谱图对比,配合物中化学位移在δ 3.61 处的多重吸收峰应为配体二肽分子中胺基NH2)H(和亚甲基CH2H()的吸收峰,由于
[LM][HT5”SS][HJ*4]
受羰基吸电子效应和氨基配位作用的影响,导致氨基和亚甲基上的电子云密度降低,化学位移(δ 2.0~3.34)向低场(δ 3.61)移动;配合物中化学位移在δ 7.65~8.42范围的多重吸收峰(8H)应归属于配体4,4bpy分子中两类化学环境不同的H,由于N参与了配位,也使得吡啶环上的电子云密度降低,化学位移(δ 7.50~8.21)移向低场(δ 7.65~8.42);配合物中δ 9.50处的2H归属于二肽配体中的亚胺氢(NH),同时,二肽配体中的羧基氢的吸收峰(δ 11.0)在形成配合物后并未出现,说明羧基脱去质子后参与了配位。
3.2 配合物的SOD活性
应用NBT光照还原法测定了配合物的SOD活性。反应机理为:光照条件下,VB2 (核黄素)能与MET作用产生超氧阴离子自由基(O
Symbolm@@ ﹒2 ):
VB2+C5H11O2NS光照LightingO
Symbolm@@ ﹒2 (1)
O
Symbolm@@ ﹒2 使NBT还原为蓝色的化合物甲腙(Methyl hydrazone):
NBT+O
Symbolm@@ ·2甲腙(Methyl hydrazone)(2)
甲腙在560 nm处有最大吸收,且浓度越高,吸光度越大。不同时间下的吸光度A560对光照时间作图可得一条直线,直线斜率k值的大小可以反映甲腙生成速率的快慢。当在上述体系中加入具有SOD活性的配合物时,配合物会催化O
Symbolm@@ ﹒2 的歧化反应(反应式3),使NBT还原为蓝色化合物甲腙的速率减慢,吸光度相对于无配合物存在的反应体系而减小。根据反应体系中有无配合物存在时吸光度的变化,可以比较不同配合物SOD活性的大小。
O
Symbolm@@ ·2+H+化合物ComplesH2O2+O2(3)
3.2.1 配合物的SOD活性 在相同浓度的配合物存在下,反应体系 (VB2 METNBT)的吸光度A560随时间的变化如图4所示。与无配合物存在的空白组的A560比较,有配合物
存在的反应体系的A560明显变小,说明6个配合物均有明显的清除超氧自由基的作用。且实验结果呈规律性变化,即:配合物 1> 配合物 2>配合物3;配合物4>配合物5>配合物6。影响配合物SOD活性的因素很多,如中心离子、配体的几何结构以及配合物的配位构型等。在相同的实验条件下,由于采用了相同的中心离子,平面性大小不同的配体,因此推测两类配合物的SOD活性与配体的结构有关[15],具有疏水性的多吡啶配体2,2′bpy,4,4′bpy 和Phen的疏水性作用随着芳环刚性的增大而增加,即: 2,2′bpy<4,4′bpy
3.2.2 配合物浓度对SOD活性的影响 配合物6 (\[Ni (Glygly)(Phen)(H2O)\]·2H2O )的浓度对体系吸光度的影响见图5。直线 a~f 的斜率随着体系中配合物6的浓度的增加而逐渐变小,表明配合
物6浓度增大后,使O
Symbolm@@ ﹒2 还原 NBT 为甲腙化合物的速率降低,说明配合物6浓度越大,抑制甲腙化合物生成的作用越明显。在一定浓度范围内,配合物6的SOD活性随着该配合物浓度的增加而增大。
配合物 对O
Symbolm@@ ﹒2 的抑制率I由公式I= (1-k′/k)×100% 求出,其中, k′为加入配合物后 A560t 直线的斜率,k为无配合物的反应体系的直线斜率。以抑制率 I 对配合物浓度作图得一曲线(图6),获得抑制率为50%时所需配合物的浓度,即为一个活性单位值IC50,IC50 值愈小,说明配合
物SOD活性愈大[4,6]。本研究合成的配合物及已报道的类似结构配合物的IC50 值列于表4, 可见,其中合成的钴甘二肽邻菲
罗啉配合物和镍甘二肽邻菲罗啉配合物具有较好的清除超氧自由基的作用。
3.3 荧光光谱法对配合物与HSA的相互作用研究
3.3.1 配合物对HSA荧光光谱的影响 蛋白质的內源荧光主要由色氨酸、酪氨酸和苯丙氨酸所产生且对周围环境十分灵敏,当蛋白质周围的微环境或结构发生改变时,其内源荧光也会发生相应的变化,这在研究蛋白质结构变化时是一个很好判断依据[17]。通常外来物质加入后若使HSA分子内源荧光基团周围微环境的极性增强,则色氨酸等疏水基团外露,产生荧光猝灭效应;其次外来物质分子结合到HSA分子上,HSA分子的能量发生转移,也是HSA荧光猝灭的一个原因。
图7 配合物6与HSA相互作用的荧光光谱
Fig.7 Fluorescence spectra of HSA in the presence of complex 6
(a→g) Concentration of complex: (0,0.2,0.4,0.6,0.8,1.0 and 1.2)×10
Symbolm@@ 5 mol/L respectively; CHSA=3×10
Symbolm@@ 5 mol/L; λex=280 nm.
由图7可知,当HSA溶液中配合物6的浓度不断增大时,HSA的荧光强度却在不断减小,同时其最大发射波长 (360 nm)发生显著的红移,而配合物6在360 nm 处没有发射峰,这表示配合物分子对HSA的荧光具有猝灭作用。配合物的存在使得HSA分子内源荧光基团周围微环境的极性增强,疏水性的发光基团外露,导致HSA的三级结构更加舒展,其最大发射波长发生红移。在375 nm处出现发射强度相等点,这也是复合物存在的一个标志。其它配合物与HSA 作用的荧光光谱类似于配合物6与HSA 作用的荧光光谱。
3.3.2 配合物对HSA构象的影响 同步荧光是考查HSA构象变化的一个重要手段。因为最大发射波长的位置与HSA分子周围的疏水性能是相对应的,同步荧光则是通过检测其最大发射波长是否有位移来衡量氨基酸残基所处的微环境有无变化的,也是考察HSA构象变化的一个依据[16]。蛋白质的荧光主要来自于色氨酸、酪氨酸和苯丙氨酸所产生的荧光,它们的荧光强度之比通常为100∶9∶0.5。由于苯丙氨酸的荧光强度太弱,所以一般重点考察构象发生变化的是色氨酸或酪氨酸[17,18]。HSA的同步荧光分别显示酪氨酸残基和色氨酸残基的特征信息[18]。Δλ=15 nm时表示的是酪氨酸残基的特征信息,Δλ=60 nm时表示的是色氨酸残基的特征信息。图8是Ni的3种配合物与HSA分子相互作用的同步荧光光谱。
室温下,固定HSA的浓度,分别依次加入相应的镍配合物溶液。随着配合物浓度的增加,HSA的荧光发射峰强度有规律地减弱(图8),说明镍配合物与人血清白蛋白之间存在一定的作用。然而3种配合物对HSA荧光发射波长的影响是不同的,配合物4可使得酪氨酸残基发射波长略微蓝移(图8A),色氨酸残基的发射波长明显蓝移(图8B);配合物 5对酪氨酸残基发射波长几乎没有影响(图8C),使得色氨酸残基的发射波长明显红移(图8D);配合物 6使得酪氨酸残基发射波长和色氨酸残基发射波长明显红移(图8E和8F)。发射波长的改变,说明配合物的存在使HSA分子中的色氨酸残基和酪氨酸残基周围的微环境都发生了改变,从而导致HSA构象发生了改变。进一步说明Ni的3种配合物都可与HSA分子作用,形成复合物[17,18]。这些配合物可以通过HSA分子进行输送、传递,在生物体内发挥SOD活性。
3.3.3 HSA对配合物SOD活性的影响 为考察在HSA存在时配合物的SOD活性,在测试配合物6的SOD活性的溶液中加入了HSA溶液,发现配合物6的SOD活性比无HAS存在时减小,说明HAS对中配合物的SOD活性有一定的影响(图9)。
3.3.4 配合物的细胞相容性 6种配合物对人肝癌细胞HepG2的生长存活率影响如图10所示。用只
加培养液而不加细胞的对照组为参比[19],配合物存在时HepG2的生长存活率在85%~95%之间,说明配合物对细胞的生长的影响较小,配合物有较好的细胞相容性,毒性较低。
结 论
本研究采用金属钴和镍的硝酸盐和具有生物活性的甘二肽及芳胺配体合成了6种配合物,推测其化学组成为\[M(Glygly) (2,2′bpy/Phen)(H2O)\]·2H2O 和 \[M2(Glygly)2(4,4′bpy)(H2O)4\]·4H2O 。SOD活性实验结果表明,所合成的两类配合物具有良好的SOD活性,且 SOD活性优于所报道的类似结构配合物,故这6种配合物可作为SOD模拟物,在医疗卫生、保健、护肤行业有潜在的应用前景。
References
1 WANG Zhen, ZHANG LiMin, TIAN Yan. Chinese J. Anal. Chem., 2014, 42(1): 1-9
王 振, 张立敏, 田 阳. 分析化学, 2014, 42(1): 1-9
2 LUO QinHui. Chem. J. Chinese Universities, 1997, 18(7): 1012-1018
罗勤慧. 高等学校化学学报, 1997, 18(7): 1012-1018
3 FU XiaBing, LIN ZiHua, LE XueYi. Chinese J. Inorg. Chem., 2013, 29(2): 215-230
傅夏兵, 林子华, 乐学义. 无机化学学报, 2013, 29(2): 215-230
4 SU Min, LI Tao, LIU DianJun, WANG ZhenXin. Chinese J. Anal. Chem., 2015, 43(2): 199-206
苏 敏, 李 桃, 刘殿骏, 王振新. 分析化学, 2015, 43(2): 199-206
5 DING Yang, REN XiangXiang, SHENG ShuYi. J. South China Agri. Univ., 2010, 31(1): 108-111
丁 杨, 任祥祥, 沈淑仪. 华南农业大学学报, 2010, 31(1): 108-111
6 Tabassum S, AIAsbahy W M, Afzal M. Dalton Trans., 2012, 41(16): 4955-4964
7 DING Yang, SHEN ShuYi, REN XiangXiang. Chem.Bull., 2009, (10): 922-926
丁 杨, 沈淑仪, 任祥祥. 化学通报, 2009, (10): 922-926
8 Gu Q, Le X Y, Lin Q B, Liao S R, Ma X D, Feng X L. Chin. J. Chem., 2007, 25(6): 791-796
9 GU Qin, LIN QingBin, LE XueYi. Chem. Bull., 2007, (6): 450-455
古 琴, 林庆斌, 乐学义. 化学通报, 2007, (6): 450-455
10 Liao S R , Le X Y, Feng X L. J. Coord. Chem., 2008, 61(6): 847-856
11 LIAO ShengRong, MAO XiaoYun, LE XueYi. Chinese J. Soil Sci., 2007, 38(5): 962-965
廖升荣, 毛小云, 乐学义. 土壤通报, 2007, 38(5): 962-965
12 LIAO ShengRong, REN XiangXiang, LE XueYi. Chinese Agri. Sci. Bull., 2008, 24(6): 237-242
廖升荣, 任祥祥, 乐学义. 中国农学通报, 2008, 24(6): 237-242
13 XIE FengXia, ZHANG Dan, ZHANG XinXin, HUA Min. Chinese J. Inorg. Chem., 2013, 29(10): 2162-2168
解凤霞, 张 丹, 张欣欣, 华 敏. 无机化学学报, 2013, 29(10): 2162-2168
14 DING Yang, DENG JianSheng, LE XueYi. Chinese J.Org.Chem., 2011, 31(7): 1081-1086
丁 杨, 邓剑生, 乐学义. 有机化学, 2011, 31(7): 1081-1086
15 ZHOU XiaoHua, MA HuiFang, ZHAO Pan. Chinese Agri.Sci. Bull., 2010, 26(22): 170-174
周晓华, 马卉芳, 赵 盼. 中国农学通报, 2010, 26(22): 170-174
16 Sallam A, Steinbuchel A. Appl. Microbiol. Biotechnol., 2010, 87(3): 815-828
17 ZHANG Min, ZHANG YuHao, MA Liang. Chinese J. Anal. Chem., 2011, 39(12): 1907-1911
张 敏, 张宇昊, 马 良. 分析化学, 2011, 39(12): 1907-1911
18 ZHAO Fang, HUANG ChaoFeng , LIANG Hui, XIONG Wei, CHEN Yan, HU XinYi. Chinese J. Anal. Chem., 2011, 39(3): 401-404
赵 芳, 黄超峰, 梁 慧, 熊 伟, 陈 燕, 胡欣怡. 分析化学, 2011, 39(3): 401-404
19 LIU Jie, WEI ChunYing, YANG Pin. Acta Chim. Sin., 2012, 70(3): 277-283
刘 洁, 魏春英, 杨 频. 化学学报, 2012, 70(3): 277-283
Abstract The complexes have been synthesized by the reaction of Co, Ni nitrate with the first ligand Glycylglycine (Glygly) and the second ligand 2,2′bipyridine/4,4′bipyridine/1,10phenanthrolinec in water solution (pH 8.0-8.2). The compositions of the complexes were characterized by elemental analysis, thermal gravimetric analysis/differential thermal analysis (TG/DTA), infrared spectroscopy (IR), and 1H nuclear magnetic resonace (1H NMR) methods. The superoxide dismutase (SOD)like activities and the interaction with HSA of these complexes were investigated. The results showed that all of the Co, Ni complexes have the composition of \[M(Glygly) (2,2′bpy/Phen)(H2O)]·2H2O and [M2(Glygly)2(4,4′bpy)(H2O)4]·4H2O . The IC50 of the complexes was about 0.327-0.564 μmol/L, which meant the complexes had good SODlike activities. The fluorescence spectra showed that these complexes could combine with HSA and be delivered by HSA molecules in human blood.
第十五届国际化学计量学大会在中国顺利召开
由中国化学会、国家自然科学基金委员会主办,中南大学、湖南大学(化学生物传感与计量学国家重点实验室) 共同承办的第十五届国际化学计量学大会(以下简称CAC 2015)已于2015年6月23~27日在中国湖南长沙明城国际大酒店成功举办。
本次会议是该系列会议首次在亚洲举办。中国科学院院士、湖南大学俞汝勤教授担任本次会议组织委员会名誉主席,中南大学梁逸曾教授任主席,中南大学许青松教授和湖南大学吴海龙教授任副主席。有来自20国家的近80名国外专家学者代表和来自国内的众多专家学者,共约300人共同参与、见证了这一盛会。本着继往开来、与时俱进的精神,会议全力展现在化学计量学领域的世界最新研究进展及成果,充分提高亚洲化学计量学领域在国际上的影响力,以期增进广大化学计量学工作者们之间的学术交流与合作,促进亚洲化学计量学事业发展。
梁逸曾教授主持了开幕式。中南大学副校长周科朝教授代表承办单位致欢迎词,国际化学计量学科学委员会常任委员会主席Lutgarde Buydens 教授隆重颁发本届"化学计量学终身成就奖"(Chemometrics Lifetime Achievement Award)。会议期间,仪器信息网还专题采访了俞汝勤先生,畅谈分析化学与化学计量学、化学计量学在中国、化学计量学与中国分析仪器产业升级等话题。
本届大会围绕7个研究方向,安排了4个大会特邀报告、17个主题报告、50个口头报告,另外还有129篇墙报。与会者围绕化学计量学当前研究热点展开了充分的学术交流和深入探讨。化学计量学在中国已经发展30多年,如今中国的化学计量学已成为具有国际声誉的、具有特色和优势的重要组成部分,相对独立地开展了化学多维校正、中药现代化与模型集群分析等前沿学术研究。CAC 2015的召开,将有力地推动中国化学计量学的快速进步和蓬勃发展。
本次会议还举行了颁奖晚宴,颁发了最佳青年科学家(The best young scientist award)、优秀青年科学家(Outstanding young scientist award)和最佳墙报奖(Best poster award)。还安排了中南大学、湖南大学随访,并参观千年学府——岳麓学院。在会议结束之时,Lutgarde Buydens主席再次高度赞赏本届组委会的努力,祝贺CAC2015取得圆满成功,并特别致谢会务组工作人员及所有志愿者的细致入微的工作



摘 要 以甘氨酰甘氨酸(Glygly)为第一配体,2,2′联吡啶(2,2′bpy)、4,4′联吡啶(4,4′bpy)和邻菲罗啉(Phen)为第二配体,与金属钴和镍的硝酸盐作用,合成了6种新的金属配合物,采用红外光谱方法、元素分析、差热热重和核磁共振等方法对其进行了表征。并通过氯化硝基四氮唑蓝(Four nitrogen chloride nitro blue, NBT)光照还原法测试了配合物的 超氧化物歧化酶(Superoxide dismutase, SOD)活性。为探讨配合物在血液中的行为,用荧光光谱法研究了配合物和人血清白蛋白(human serum albumin, HSA)之间的相互作用。结果表明:所合成的配合物的化学组成为\[M(Glygly)(2,2′bpy/Phen)(H2O)\]·2H2O 和[M2(Glygly)2(4,4′bpy)(H2O)4]·4H2O 。6种配合物均具有良好的SOD活性和较好的细胞相容性,IC50值的范围为0.327~0.564 μmol/L。 与HSA作用的结果表明,配合物可与HSA分子作用生成复合物,可以通过HSA输送配合物,在生物体内发挥其作用。
关键词 甘二肽; 芳胺; 配合物; 超氧化物歧化酶活性; 人血清白蛋白
1 引 言
超氧化物歧化酶(SOD)是一类广泛存在于动物、植物、微生物中的金属酶,作为生物体内自由基的清洁剂,SOD对生物体具有重要的功能作用。天然 SOD 有许多不足之处,如分子量大、稳定性低、膜透性差、易受胃蛋白酶分解和价格昂贵等,使其应用受到较大的限制。因此设计和合成既能避免天然酶自身不足,同时又具有较高 SOD 活性的小分子 SOD 模拟物,已成为生物化学领域的研究热点之一[1~3]。由于二肽在生物体内具有良好的生理活性,作为配体能有效提高生物利用率和配合物的生物活性,降低毒副作用,SOD 模拟物中以二肽和芳胺为配体的铜配合物的研究报道较多[4],例如,丁杨等[5]合成的二肽铜多吡啶三元配合物表现出了良好SOD活性,可作为SOD模拟物;Tabassum等[6]合成的\[Cu2(Glygly)2(ppz)(H2O)4\] ·2H2O配合物具有对DNA分子的氧化切割作用,对拓扑异构酶I也具有很好的抑制作用,同时还具有很小的SOD活性的IC50值,该配合物具有较好的应用前景。为了探索其它过渡金属的二肽配合物的SOD 活性,本课题组设计合成了未见报道的具有SOD活性的6种Co和Ni的甘氨酰甘氨酸和2,2′bpy,4,4′bpy,Phen为配体的配合物,采用NBT(氯化硝基四氮唑蓝)光照还原法测试了它们的SOD活性,并测试了配合物浓度对其SOD活性的影响。 结果表明,合成的6种金属配合物与文献[7~12]相比,金属配合物有较好的清除超氧自由基的作用。配合物的SOD活性表现出规律性的变化,即随配体中分子平面性的增加而减小。对6种合成的配合物与HSA(人血清白蛋白)分子之间的相互作用采用光谱方法进行了研究。结果表明,配合物与人血清白蛋白相互作用形成了一种新的复合物。配合物与HSA分子结合后,可以被HSA 分子输送,在体内发挥其消除自由基的作用。
2 实验部分
2.1 仪器与试剂
FTS3000 FTIR傅里叶红外光谱仪(DIGILAB公司),TG/DTA6300热重差热分析仪(美国PE公司),LS55荧光分光光度计(美国PE公司),Mercury plus 400超导核磁仪(美国Varian公司),2400CHN型元素分析仪(美国PE公司)。
甘二肽(C4H8N2O3,生化试剂,98%,成都蒽萊生物科技有限公司);2,2′联吡啶(2,2′bpy)、4,4′联吡啶(4,4′bpy)、邻菲罗啉(Phen)、无水乙醇均为市售分析纯试剂;甲硫氨酸(MET)、 核黄素 (VB2) 和氯化硝基四氮唑蓝 (NBT) 为生化试剂,整个实验过程均使用二次蒸馏水。
2.2 配合物的合成
分别将5 mL 含 0.5 mmol甘二肽的水溶液、10 mL含 0.5 mmol的2,2′联吡啶无水乙醇溶液滴加到5 mL 0.1 mol/L Co(NO3)2溶液中,再用 1 mol/L NaOH 溶液调节至pH 8.0~8.2。 在氮气保护下,80℃回流搅拌3 h,室温搅拌8 h后过滤,滤液室温下静置挥发,数周后析出红色颗粒状晶体,过滤后干燥保存。其它5种配合物的合成方法与之类似。
2.3 配合物的SOD活性测试
采用 NBT光照还原法测定配合物的SOD活性,用磷酸盐缓冲液(pH=7.8)配制含有以下物质的混合溶液:空白组:3.3×10
Symbolm@@ 5 mol/L核黄素、0.01 mol/L甲硫氨酸(MET)、4.6×10
Symbolm@@ 5 mol/L NBT;配合物组:空白组加入0.6×10
Symbolm@@ 6 mol/L配合物。将以上两组混合溶液分别置于30℃的恒温水浴中保温10 min,然后用荧光灯照射3 min,用722型分光光度计测定560 nm处溶液的吸光度。每种混合溶液平行测定3次,取平均值。
2.4 配合物和人血清白蛋白(HSA)之间的作用
用pH=7.15的TrisHCl缓冲溶液将HSA配制成浓度为1×10
Symbolm@@ 5 mol/L溶液,加入配合物溶液,在室温下反应3 min,固定激发波长和发射波长间距Δλ=15 nm,Δλ=60 nm,扫描同步荧光光谱。入射狭缝和出射狭缝宽设为5 nm,扫描速度固定为240 nm/min。
2.5 配合物的细胞相容性测试
将培养好的人肝癌细胞HepG2细胞接种于96孔培养板中,分别加入浓度为0.6×10
Symbolm@@ 6 mol/L配合物20 μL,对照组加等体积的1640培养基, 24 h后,加入MTT溶液10 μL,孵育后,用酶标仪(波长570 nm)测定其吸光度值,计算细胞的生长存活率。
3 结果与讨论
3.1 配合物的表征
Symbolm@@ 1 附近吸收峰归属于CN伸缩振动,且相对于配体中的CN吸收峰向低波数移动,表明芳胺配体中的N原子参与了配位。由以上配体中和配合物中相应配位基团的红外光谱吸收峰的变化说明了配合物的生成。配合物在3408~3336 cm
Symbolm@@ 1处强的吸收峰归属于羟基的对称和反对称的伸缩振动吸收峰,配合物中有水分子和羟基存在。配体及其配合物的主要红外数据列于表1。
[KH*4D][HT5”SS][HJ*4]表1 配合物的主要红外光谱数据(cm
Symbolm@@ 1)
Table 1 Selected IR data (ν/cm
Symbolm@@ 1) of the complexes
[HT6SS][BG(][BHDFG3,WK15,WK7。6W]配体及配合物Ligands and complexs
3.1.2 元素分析
根据元素分析结果和文献报道[5,6],推测配合物2 和配合物5 具有双核结构,其余具有单核结构,配合物的元素分析结果和化学组成见表2。
[KH*4D][HT5”SS][HJ*4]表2 配合物的化学组成和元素分析
Table 2 Results of elemental analysis and composition of the complexes
[HT6SS][BG(][BHDFG4*2,WK33,WK24W]配合物
Complex实测值 Found(理论值 Calcd.)
碳含量
3.1.3 配合物的热分解性质 配合物3 (Co甘二肽邻菲罗啉配合物)的热分解过程如图3所示 (αAl2O3,氮气气氛,气流速率为50 mL/min,升温速度为10℃/min,温度范围为25℃~800℃)。在25℃~120℃范围内,出现第一个失重台阶,失重率约为9.0%,相当于2个H2O分子的失重率(理论值8.5%),说明配合物的外界有2个结晶H2O分子。在151℃~789℃范围出现第两个失重台阶,失重率约为75.1%,相当于一个甘二肽分子、一个邻菲罗啉分子和一个H2O的失重率(理论值74.0%),且在179℃产生了较强的放热峰,可能是配合物的热分解过程,伴随配体甘二肽分子和邻菲罗啉分子的同时失去和分解, 750℃后曲线趋于平缓,最终产物为金属氧化物CoO,残留重13.8%,与理论值13.9%基本相符,故推测配合物3的化学式为 \[Co(Glygly)(Phen)(H2O)\]·2H2O 。其它几种具有相同配体的配合物的热谱图较为相似,进而推断它们具有相似的化学式和分子结构。6种配合物的热重差热数据列于表3。
3.1.4 配合物的核磁共振谱 (1H NMR) 将配合物\[Co2(Glygly)2(4,4bpy)(H2O)4\]·4H2O的核磁共振光谱图(1H NMR,D2O, 400 MHz)与配体的核磁共振光谱图对比,配合物中化学位移在δ 3.61 处的多重吸收峰应为配体二肽分子中胺基NH2)H(和亚甲基CH2H()的吸收峰,由于
[LM][HT5”SS][HJ*4]
受羰基吸电子效应和氨基配位作用的影响,导致氨基和亚甲基上的电子云密度降低,化学位移(δ 2.0~3.34)向低场(δ 3.61)移动;配合物中化学位移在δ 7.65~8.42范围的多重吸收峰(8H)应归属于配体4,4bpy分子中两类化学环境不同的H,由于N参与了配位,也使得吡啶环上的电子云密度降低,化学位移(δ 7.50~8.21)移向低场(δ 7.65~8.42);配合物中δ 9.50处的2H归属于二肽配体中的亚胺氢(NH),同时,二肽配体中的羧基氢的吸收峰(δ 11.0)在形成配合物后并未出现,说明羧基脱去质子后参与了配位。
3.2 配合物的SOD活性
应用NBT光照还原法测定了配合物的SOD活性。反应机理为:光照条件下,VB2 (核黄素)能与MET作用产生超氧阴离子自由基(O
Symbolm@@ ﹒2 ):
VB2+C5H11O2NS光照LightingO
Symbolm@@ ﹒2 (1)
O
Symbolm@@ ﹒2 使NBT还原为蓝色的化合物甲腙(Methyl hydrazone):
NBT+O
Symbolm@@ ·2甲腙(Methyl hydrazone)(2)
甲腙在560 nm处有最大吸收,且浓度越高,吸光度越大。不同时间下的吸光度A560对光照时间作图可得一条直线,直线斜率k值的大小可以反映甲腙生成速率的快慢。当在上述体系中加入具有SOD活性的配合物时,配合物会催化O
Symbolm@@ ﹒2 的歧化反应(反应式3),使NBT还原为蓝色化合物甲腙的速率减慢,吸光度相对于无配合物存在的反应体系而减小。根据反应体系中有无配合物存在时吸光度的变化,可以比较不同配合物SOD活性的大小。
O
Symbolm@@ ·2+H+化合物ComplesH2O2+O2(3)
3.2.1 配合物的SOD活性 在相同浓度的配合物存在下,反应体系 (VB2 METNBT)的吸光度A560随时间的变化如图4所示。与无配合物存在的空白组的A560比较,有配合物
存在的反应体系的A560明显变小,说明6个配合物均有明显的清除超氧自由基的作用。且实验结果呈规律性变化,即:配合物 1> 配合物 2>配合物3;配合物4>配合物5>配合物6。影响配合物SOD活性的因素很多,如中心离子、配体的几何结构以及配合物的配位构型等。在相同的实验条件下,由于采用了相同的中心离子,平面性大小不同的配体,因此推测两类配合物的SOD活性与配体的结构有关[15],具有疏水性的多吡啶配体2,2′bpy,4,4′bpy 和Phen的疏水性作用随着芳环刚性的增大而增加,即: 2,2′bpy<4,4′bpy
3.2.2 配合物浓度对SOD活性的影响 配合物6 (\[Ni (Glygly)(Phen)(H2O)\]·2H2O )的浓度对体系吸光度的影响见图5。直线 a~f 的斜率随着体系中配合物6的浓度的增加而逐渐变小,表明配合
物6浓度增大后,使O
Symbolm@@ ﹒2 还原 NBT 为甲腙化合物的速率降低,说明配合物6浓度越大,抑制甲腙化合物生成的作用越明显。在一定浓度范围内,配合物6的SOD活性随着该配合物浓度的增加而增大。
配合物 对O
Symbolm@@ ﹒2 的抑制率I由公式I= (1-k′/k)×100% 求出,其中, k′为加入配合物后 A560t 直线的斜率,k为无配合物的反应体系的直线斜率。以抑制率 I 对配合物浓度作图得一曲线(图6),获得抑制率为50%时所需配合物的浓度,即为一个活性单位值IC50,IC50 值愈小,说明配合
物SOD活性愈大[4,6]。本研究合成的配合物及已报道的类似结构配合物的IC50 值列于表4, 可见,其中合成的钴甘二肽邻菲
罗啉配合物和镍甘二肽邻菲罗啉配合物具有较好的清除超氧自由基的作用。
3.3 荧光光谱法对配合物与HSA的相互作用研究
3.3.1 配合物对HSA荧光光谱的影响 蛋白质的內源荧光主要由色氨酸、酪氨酸和苯丙氨酸所产生且对周围环境十分灵敏,当蛋白质周围的微环境或结构发生改变时,其内源荧光也会发生相应的变化,这在研究蛋白质结构变化时是一个很好判断依据[17]。通常外来物质加入后若使HSA分子内源荧光基团周围微环境的极性增强,则色氨酸等疏水基团外露,产生荧光猝灭效应;其次外来物质分子结合到HSA分子上,HSA分子的能量发生转移,也是HSA荧光猝灭的一个原因。
图7 配合物6与HSA相互作用的荧光光谱
Fig.7 Fluorescence spectra of HSA in the presence of complex 6
(a→g) Concentration of complex: (0,0.2,0.4,0.6,0.8,1.0 and 1.2)×10
Symbolm@@ 5 mol/L respectively; CHSA=3×10
Symbolm@@ 5 mol/L; λex=280 nm.
由图7可知,当HSA溶液中配合物6的浓度不断增大时,HSA的荧光强度却在不断减小,同时其最大发射波长 (360 nm)发生显著的红移,而配合物6在360 nm 处没有发射峰,这表示配合物分子对HSA的荧光具有猝灭作用。配合物的存在使得HSA分子内源荧光基团周围微环境的极性增强,疏水性的发光基团外露,导致HSA的三级结构更加舒展,其最大发射波长发生红移。在375 nm处出现发射强度相等点,这也是复合物存在的一个标志。其它配合物与HSA 作用的荧光光谱类似于配合物6与HSA 作用的荧光光谱。
3.3.2 配合物对HSA构象的影响 同步荧光是考查HSA构象变化的一个重要手段。因为最大发射波长的位置与HSA分子周围的疏水性能是相对应的,同步荧光则是通过检测其最大发射波长是否有位移来衡量氨基酸残基所处的微环境有无变化的,也是考察HSA构象变化的一个依据[16]。蛋白质的荧光主要来自于色氨酸、酪氨酸和苯丙氨酸所产生的荧光,它们的荧光强度之比通常为100∶9∶0.5。由于苯丙氨酸的荧光强度太弱,所以一般重点考察构象发生变化的是色氨酸或酪氨酸[17,18]。HSA的同步荧光分别显示酪氨酸残基和色氨酸残基的特征信息[18]。Δλ=15 nm时表示的是酪氨酸残基的特征信息,Δλ=60 nm时表示的是色氨酸残基的特征信息。图8是Ni的3种配合物与HSA分子相互作用的同步荧光光谱。
室温下,固定HSA的浓度,分别依次加入相应的镍配合物溶液。随着配合物浓度的增加,HSA的荧光发射峰强度有规律地减弱(图8),说明镍配合物与人血清白蛋白之间存在一定的作用。然而3种配合物对HSA荧光发射波长的影响是不同的,配合物4可使得酪氨酸残基发射波长略微蓝移(图8A),色氨酸残基的发射波长明显蓝移(图8B);配合物 5对酪氨酸残基发射波长几乎没有影响(图8C),使得色氨酸残基的发射波长明显红移(图8D);配合物 6使得酪氨酸残基发射波长和色氨酸残基发射波长明显红移(图8E和8F)。发射波长的改变,说明配合物的存在使HSA分子中的色氨酸残基和酪氨酸残基周围的微环境都发生了改变,从而导致HSA构象发生了改变。进一步说明Ni的3种配合物都可与HSA分子作用,形成复合物[17,18]。这些配合物可以通过HSA分子进行输送、传递,在生物体内发挥SOD活性。
3.3.3 HSA对配合物SOD活性的影响 为考察在HSA存在时配合物的SOD活性,在测试配合物6的SOD活性的溶液中加入了HSA溶液,发现配合物6的SOD活性比无HAS存在时减小,说明HAS对中配合物的SOD活性有一定的影响(图9)。
3.3.4 配合物的细胞相容性 6种配合物对人肝癌细胞HepG2的生长存活率影响如图10所示。用只
加培养液而不加细胞的对照组为参比[19],配合物存在时HepG2的生长存活率在85%~95%之间,说明配合物对细胞的生长的影响较小,配合物有较好的细胞相容性,毒性较低。
结 论
本研究采用金属钴和镍的硝酸盐和具有生物活性的甘二肽及芳胺配体合成了6种配合物,推测其化学组成为\[M(Glygly) (2,2′bpy/Phen)(H2O)\]·2H2O 和 \[M2(Glygly)2(4,4′bpy)(H2O)4\]·4H2O 。SOD活性实验结果表明,所合成的两类配合物具有良好的SOD活性,且 SOD活性优于所报道的类似结构配合物,故这6种配合物可作为SOD模拟物,在医疗卫生、保健、护肤行业有潜在的应用前景。
References
1 WANG Zhen, ZHANG LiMin, TIAN Yan. Chinese J. Anal. Chem., 2014, 42(1): 1-9
王 振, 张立敏, 田 阳. 分析化学, 2014, 42(1): 1-9
2 LUO QinHui. Chem. J. Chinese Universities, 1997, 18(7): 1012-1018
罗勤慧. 高等学校化学学报, 1997, 18(7): 1012-1018
3 FU XiaBing, LIN ZiHua, LE XueYi. Chinese J. Inorg. Chem., 2013, 29(2): 215-230
傅夏兵, 林子华, 乐学义. 无机化学学报, 2013, 29(2): 215-230
4 SU Min, LI Tao, LIU DianJun, WANG ZhenXin. Chinese J. Anal. Chem., 2015, 43(2): 199-206
苏 敏, 李 桃, 刘殿骏, 王振新. 分析化学, 2015, 43(2): 199-206
5 DING Yang, REN XiangXiang, SHENG ShuYi. J. South China Agri. Univ., 2010, 31(1): 108-111
丁 杨, 任祥祥, 沈淑仪. 华南农业大学学报, 2010, 31(1): 108-111
6 Tabassum S, AIAsbahy W M, Afzal M. Dalton Trans., 2012, 41(16): 4955-4964
7 DING Yang, SHEN ShuYi, REN XiangXiang. Chem.Bull., 2009, (10): 922-926
丁 杨, 沈淑仪, 任祥祥. 化学通报, 2009, (10): 922-926
8 Gu Q, Le X Y, Lin Q B, Liao S R, Ma X D, Feng X L. Chin. J. Chem., 2007, 25(6): 791-796
9 GU Qin, LIN QingBin, LE XueYi. Chem. Bull., 2007, (6): 450-455
古 琴, 林庆斌, 乐学义. 化学通报, 2007, (6): 450-455
10 Liao S R , Le X Y, Feng X L. J. Coord. Chem., 2008, 61(6): 847-856
11 LIAO ShengRong, MAO XiaoYun, LE XueYi. Chinese J. Soil Sci., 2007, 38(5): 962-965
廖升荣, 毛小云, 乐学义. 土壤通报, 2007, 38(5): 962-965
12 LIAO ShengRong, REN XiangXiang, LE XueYi. Chinese Agri. Sci. Bull., 2008, 24(6): 237-242
廖升荣, 任祥祥, 乐学义. 中国农学通报, 2008, 24(6): 237-242
13 XIE FengXia, ZHANG Dan, ZHANG XinXin, HUA Min. Chinese J. Inorg. Chem., 2013, 29(10): 2162-2168
解凤霞, 张 丹, 张欣欣, 华 敏. 无机化学学报, 2013, 29(10): 2162-2168
14 DING Yang, DENG JianSheng, LE XueYi. Chinese J.Org.Chem., 2011, 31(7): 1081-1086
丁 杨, 邓剑生, 乐学义. 有机化学, 2011, 31(7): 1081-1086
15 ZHOU XiaoHua, MA HuiFang, ZHAO Pan. Chinese Agri.Sci. Bull., 2010, 26(22): 170-174
周晓华, 马卉芳, 赵 盼. 中国农学通报, 2010, 26(22): 170-174
16 Sallam A, Steinbuchel A. Appl. Microbiol. Biotechnol., 2010, 87(3): 815-828
17 ZHANG Min, ZHANG YuHao, MA Liang. Chinese J. Anal. Chem., 2011, 39(12): 1907-1911
张 敏, 张宇昊, 马 良. 分析化学, 2011, 39(12): 1907-1911
18 ZHAO Fang, HUANG ChaoFeng , LIANG Hui, XIONG Wei, CHEN Yan, HU XinYi. Chinese J. Anal. Chem., 2011, 39(3): 401-404
赵 芳, 黄超峰, 梁 慧, 熊 伟, 陈 燕, 胡欣怡. 分析化学, 2011, 39(3): 401-404
19 LIU Jie, WEI ChunYing, YANG Pin. Acta Chim. Sin., 2012, 70(3): 277-283
刘 洁, 魏春英, 杨 频. 化学学报, 2012, 70(3): 277-283
Abstract The complexes have been synthesized by the reaction of Co, Ni nitrate with the first ligand Glycylglycine (Glygly) and the second ligand 2,2′bipyridine/4,4′bipyridine/1,10phenanthrolinec in water solution (pH 8.0-8.2). The compositions of the complexes were characterized by elemental analysis, thermal gravimetric analysis/differential thermal analysis (TG/DTA), infrared spectroscopy (IR), and 1H nuclear magnetic resonace (1H NMR) methods. The superoxide dismutase (SOD)like activities and the interaction with HSA of these complexes were investigated. The results showed that all of the Co, Ni complexes have the composition of \[M(Glygly) (2,2′bpy/Phen)(H2O)]·2H2O and [M2(Glygly)2(4,4′bpy)(H2O)4]·4H2O . The IC50 of the complexes was about 0.327-0.564 μmol/L, which meant the complexes had good SODlike activities. The fluorescence spectra showed that these complexes could combine with HSA and be delivered by HSA molecules in human blood.
第十五届国际化学计量学大会在中国顺利召开
由中国化学会、国家自然科学基金委员会主办,中南大学、湖南大学(化学生物传感与计量学国家重点实验室) 共同承办的第十五届国际化学计量学大会(以下简称CAC 2015)已于2015年6月23~27日在中国湖南长沙明城国际大酒店成功举办。
本次会议是该系列会议首次在亚洲举办。中国科学院院士、湖南大学俞汝勤教授担任本次会议组织委员会名誉主席,中南大学梁逸曾教授任主席,中南大学许青松教授和湖南大学吴海龙教授任副主席。有来自20国家的近80名国外专家学者代表和来自国内的众多专家学者,共约300人共同参与、见证了这一盛会。本着继往开来、与时俱进的精神,会议全力展现在化学计量学领域的世界最新研究进展及成果,充分提高亚洲化学计量学领域在国际上的影响力,以期增进广大化学计量学工作者们之间的学术交流与合作,促进亚洲化学计量学事业发展。
梁逸曾教授主持了开幕式。中南大学副校长周科朝教授代表承办单位致欢迎词,国际化学计量学科学委员会常任委员会主席Lutgarde Buydens 教授隆重颁发本届"化学计量学终身成就奖"(Chemometrics Lifetime Achievement Award)。会议期间,仪器信息网还专题采访了俞汝勤先生,畅谈分析化学与化学计量学、化学计量学在中国、化学计量学与中国分析仪器产业升级等话题。
本届大会围绕7个研究方向,安排了4个大会特邀报告、17个主题报告、50个口头报告,另外还有129篇墙报。与会者围绕化学计量学当前研究热点展开了充分的学术交流和深入探讨。化学计量学在中国已经发展30多年,如今中国的化学计量学已成为具有国际声誉的、具有特色和优势的重要组成部分,相对独立地开展了化学多维校正、中药现代化与模型集群分析等前沿学术研究。CAC 2015的召开,将有力地推动中国化学计量学的快速进步和蓬勃发展。
本次会议还举行了颁奖晚宴,颁发了最佳青年科学家(The best young scientist award)、优秀青年科学家(Outstanding young scientist award)和最佳墙报奖(Best poster award)。还安排了中南大学、湖南大学随访,并参观千年学府——岳麓学院。在会议结束之时,Lutgarde Buydens主席再次高度赞赏本届组委会的努力,祝贺CAC2015取得圆满成功,并特别致谢会务组工作人员及所有志愿者的细致入微的工作

