牙鲆、大菱鲆传染性造血器官坏死病病毒检测报告
申红旗++鲁梦雪++蒋红艳
牙鲆、大菱鲆是我省海水养殖主要品种,近年来在养殖生产过程中发生疫病时,使用抗菌类药物往往效果不佳。为摸清上述鱼病是否因病毒引起,今年4-5月,笔者采集了部分人工养殖的牙鲆、大菱鲆样品,进行了鱼传染性造血器官坏死病病毒(IHNV)实验室检测,有关情况报告如下。
1 采样
4月中下旬,从我省沿海6个海水鱼养殖单位采集了牙鲆、大菱鲆成鱼样品11个,其中牙鲆样品5个,大菱鲆样品6个,每个样品1.5 kg,冷藏运至实验室。
2 实验室检验
本实验采用逆转录-聚合酶链反应(RT-PCR)检测方法。
2.1 IHNV的分离
2.1.1 制样 按照GB/T18088-2000的规定,采取样品鱼的肝、肾、脾。
2.1.2 样品处理 制好的样品用组织匀浆器低温匀浆。匀浆后的样品按1∶10的最终稀释度悬浮于细胞培养液(含有1 000 IU/mL的青霉素和1 000 μg/mL的链霉素)中,4 ℃孵育过夜。7 000 r/min离心15 min,收集上清液。
2.1.3 IHNV分离 处于对数生长期的FHM细胞以适宜密度接种至细胞培养板内,培养约24 h。收集的样品上清液用细胞培养液再做两次10倍稀释,然后将适当体积的稀释度为1∶10、1∶100、1∶1000的上清液分别接种至FHM单层细胞中(正对照为含阳性IHNV的病毒悬液;负对照为细胞培养液),17 ℃吸附1 h,再加入细胞培养液,置于17 ℃培养。7 d内每天用导致显微镜观察并记录细胞是否出现病变。
2.2 IHNV鉴定
2.2.1 RNA提取及cDNA合成 将对照细胞和有CPE的细胞冻融一次,取冻融后的细胞悬液按GB/T 15805.2-2008的方法抽提RNA,抽提好的RNA按下列程序进行反转录,反转录体系及程序如下:
体系中加入10 μL模板,2.5 μLR1,2.5 μL水,共15 μL,70 ℃反应5 min,立即冰浴,瞬时离心;再加入5 μL逆转录酶浓缩缓冲液(5x),2 μLdNTPs,0.5 μL RI(20U),1 μL AMV(10U),1.5 μL 水,共25 μL ,42 ℃反应1 h,产物作为模板。
2.2.2 套式PCR 见表1。
反应体系在PCR扩增仪中按照94 ℃预变性4 min,再94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,30次循环,然后72 ℃ 8 min,最后4 ℃保温的程序反应。
2.2.3 琼脂糖电泳 8 μL PCR产物+2 μL 5x loading buffer混样,混好的样点入TBE缓冲液配制成的1.5%的琼脂糖凝胶孔内,5 V/cm电泳约40 min。凝胶成像仪中观察并拍照记录。
3 检验结果
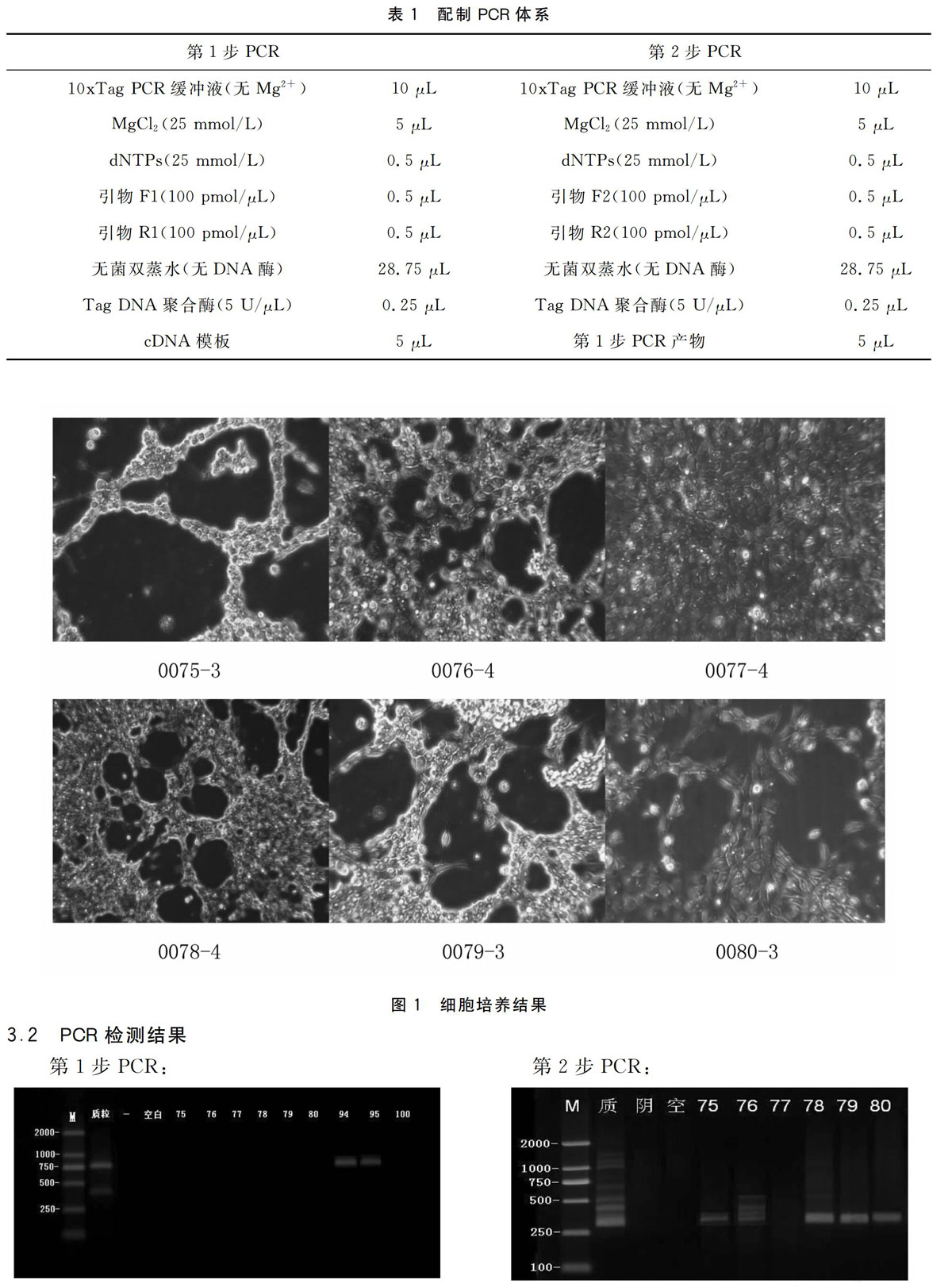
3.1 接种细胞培养结果
待测样品接种细胞后3~4 d,编号0075、0076、0078、0079、0080的5个样品细胞培养中出现细胞病变(CPE),0077未发生病变。见图1 。
3.3 基因测序结果
5个阳性样品PCR代谢物送有关单位基因测序,符合率98%。
4 小结
采集的11个牙鲆、大菱鲆样品中,共检出IHNV阳性5例,IHNV阳性检出率为45.45%。其中牙鲆IHNV阳性2例,阳性率40.00%,大菱鲆牙鲆IHNV阳性3例,阳性率50.00%;6个养殖单位中有2个单位的样品检出IHNV阳性,检出率为33.33%。详见表2。
本次检测实验证明,我省养殖的部分牙鲆、大菱鲆体内存在传染性造血器官坏死病病毒。IHN是农业部公告第1125号规定的二类水生动物疫病,具有很强的传染性与危害。因此,在牙鲆、大菱鲆养殖苗种阶段应做好检疫工作,避免引进带有IHNV阳性的鱼苗。养殖过程中如发现鱼眼球突出、浑身出血等症状,应考虑感染IHN疫病的可能性,使用聚维酮碘等抗病毒药物进行防控。
(收稿日期:2015-08-31)

