鲈鱼骨酸溶性和酶溶性胶原的性质比较
马国红 张延华 宋理平
摘要:以鲈鱼骨为原料提取得到酸溶性胶原(ASC)和酶溶性胶原(PSC),对ASC和PSC的性质进行比较。粘度测定结果表明,ASC的变性温度25~30 ℃,PSC的变性温度为30~35 ℃;电泳结果表明,ASC和PSC都属于Ⅰ型胶原且纯度比较高;氨基酸分析结果显示,羟脯氨酸和脯氨酸含量ASC均低于PSC,氨基酸检测结果与粘度检测结果相一致。
关键词:酸溶性胶原(ASC);酶溶性胶原(PSC);电泳;粘度;氨基酸
胶原蛋白(或胶原)是由三条多肽链组成的呈螺旋结构的高分子蛋白质,具有一定的生物活性,广泛存在于生物体的结缔组织中,具有支撑和保护生物体的功能[1-2]。因胶原蛋白其良好的生物相容性、加工适应性和低免疫排斥性,近年来在医学材药、组织工程、美容、食品保健等领域均得到了广泛的应用。
利用鱼皮、鱼鳞、鱼骨提取胶原的研究越来越被人们所重视,本研究以鲈鱼骨为原料提取得到酸溶性胶原(ASC)和酶溶性胶原(PSC),并对其部分生物学特性进行了测试、比较,从而为今后水产品的深加工提供可靠的理论基础。
1 材料与方法
1.1 实验材料与仪器
试验用鲈鱼购自济南市海鲜市场,为冰鲜鲈鱼,宰杀后取鱼骨放入聚乙烯密封袋中,置于-25 ℃冰箱保存。
实验仪器包括:NDJ-1B旋转粘度计,海昌吉地质仪器有限公司;CS-501超级恒温水浴,上海博讯实业有限公司;DL-5-B型离心机,德国Eppendorf;JB300-D型强力搅拌器,上海标本模型厂;EPS-300电泳仪,北京六一仪器厂;ND-1勃氏粘度测试仪,上海化学试剂公司;日立835氨基酸分析仪,日本Hitachi公司。
1.2 鲈鱼骨胶原提取方法
样品前处理:冰冻原料→去杂蛋白(0.1 mol/L NaOH浸泡6 h)→脱钙(0.5 mol/L EDTA浸泡5 d,每24 h换一次溶液)→脱脂(10%异丙醇浸泡24 h)→冷冻干燥→冰箱保存。
ASC的提取:冷冻干燥材料→0.5 mol/L乙酸提取72 h(每24 h更换溶液一次)→离心取上清→0.9 mol/L NaCl盐析三次→透析(0.5 mol/L乙酸24 h→0.1 mol/L乙酸24 h→蒸馏水24 h,中间多更换几次溶液)→冷冻干燥→冷冻保存。
PSC的提取:冷冻干燥材料→0.5 mol/L乙酸+2‰胃蛋白酶(1∶3 000)提取72 h→离心取上清→0.9 mol/L NaCl盐析三次→透析(0.5 mol/L乙酸24 h→0.1 mol/L乙酸24 h→蒸馏水24 h,中间多更换几次溶液)→冷冻干燥→冷冻保存。
所有操作均在4 ℃以下进行。
1.3 检测内容及方法
1.3.1 胶原粘度的测定 取300 mg胶原溶于4 ℃的40 mL 0.1 mol/L的乙酸溶液,用旋转粘度计在不同温度下测定粘度值,测定温度15~45 ℃(间隔5 ℃),每个温度点保持30 min,以粘度值降低50%时所对应的温度为变性温度。
1.3.2 SDS-PAGE电泳(聚丙烯酰胺凝胶电泳) 取2 mg胶原溶于4 ℃的1 mL 0.1 mol/L乙酸溶液,该溶液100 μL与100 μL SDS样品处理液混合后,沸水浴加热5 min,电泳上样10 μL,浓缩胶80 v,分离胶120 v,电泳4 h左右。电泳结束后,用考马斯亮蓝R-250染色15 min,脱色直至无底色,做成干胶,扫描保存。
1.3.3 胶原氨基酸检测 氨基酸测定采用盐酸水解前处理法,即将样品用6 mol/L的HCl在110 ℃水解20 h后用氨基酸自动分析仪进行检测。
2 结果与分析
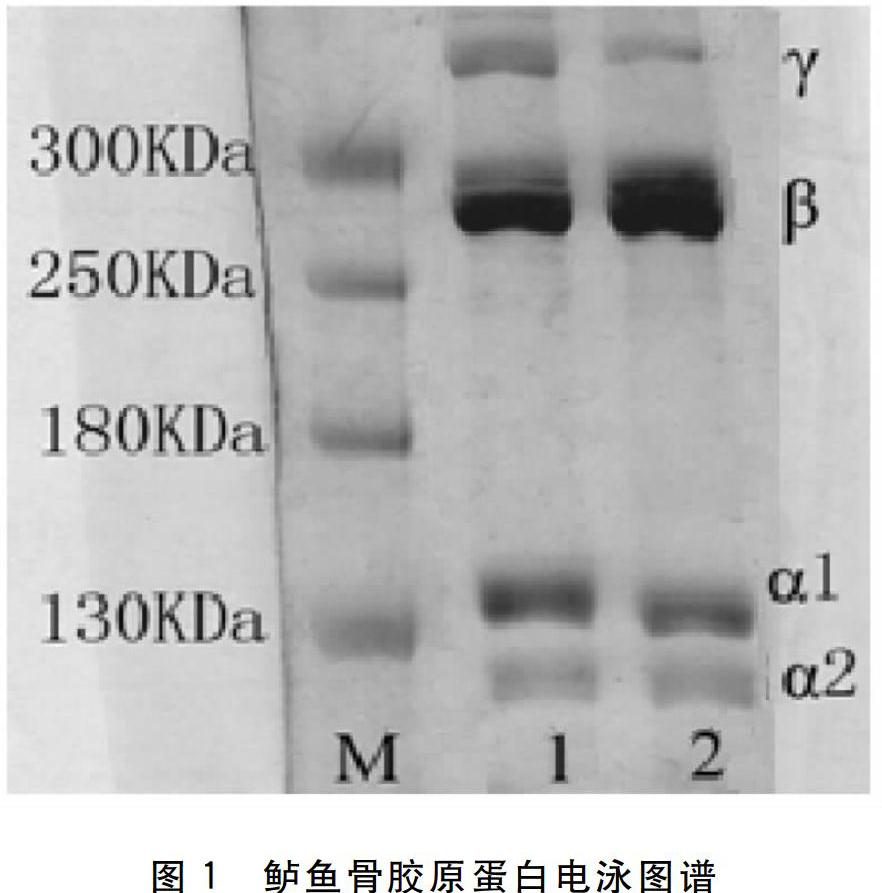
2.1 SDS-PAGE电泳
胶原蛋白是由3条左手螺旋构型的多肽链(即α链)组成的三股螺旋结构, α链又互相缠成右手螺旋结构,构成超螺旋结构[3]。由图1可以看出,鲈鱼骨ASC、PSC电泳图谱较为相似,都有4条比较清晰的条带,分别为α1、α2、β和γ。α链至少由α1和α2组成,β链含量较高,并含有少量的γ链,这是典型的Ⅰ型胶原蛋白的特征,γ条带是两条α肽链的聚合体,分子量在260 kDa左右,是α肽链的两倍,;α1链分子量高于α2链,分子量在130 kDa左右。电泳结果表明实验制备的胶原分子完整,分子量大于300 kDa,图谱上无其它蛋白质杂带,所提取胶原为Ⅰ型胶原且纯度比较高。同时,根据在电泳中胶原分子迁移位置的差别,可以看出鲈鱼骨PSC分子量小于鲈鱼骨ASC的分子量。这可能是因为胃蛋白酶非特异性的切断了胶原蛋白的部分尾肽,从而使得PSC的分子量略微减小所致[4]。这与金成[5]等的实验结果一致。
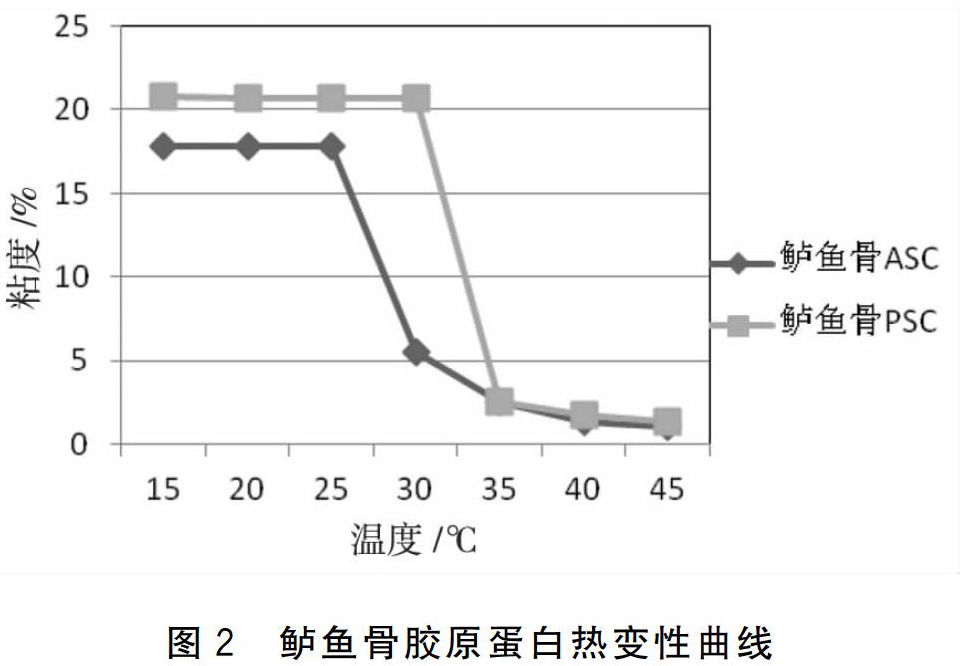
2.2 粘度(变性温度)的测定
由受热引起的胶原变性与胶原溶液的粘度变化有关[6]。胶原变性的结果是蛋白质的天然构象发生改变,肽链由规则状态转变为随机卷曲状态[5]。由图2可以看出,鲈鱼鱼骨ASC的变性温度为25~30 ℃,PSC的变性温度为30~35 ℃,PSC>ASC,同时,PSC的变性起始温度也高于ASC。曾名勇等[7]测定了鳙、鲈、鲫鱼鱼皮ASC的热变性温度分别为30、25、27 ℃,而鳙鱼、鲈鱼、鲫鱼的栖息水温分别为32 ℃,26~27 ℃,29 ℃,与其ASC的变性温度相适应。所以酸溶性胶原蛋白的热变性温度与其栖息的水环境温度相关,汪海波等也研究认为胶原的热变性温度与其所处的环境温度有关[8]。
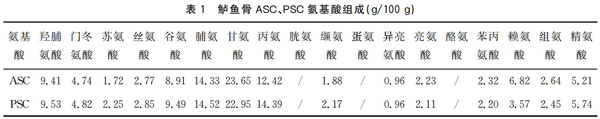
本实验中鲈鱼骨ASC的变性温度与鲈鱼皮的变性温度相差不大,鲈鱼骨PSC的变性温度稍高于ASC。 许多研究[7,9-10]证明:胶原中亚氨酸(羟脯氨酸和脯氨酸统称为亚氨酸)含量越高,胶原蛋白的三螺旋结构越稳定,胶原蛋白的变性温度也越高。Johnston-Banks[11]研究认为亚氨基酸的砒咯环和羟脯氨酸的羟基形成的氢键对胶原结构的稳定起着重要作用。实验测得鲈鱼骨ASC羟脯氨酸含量为9.41g/100 g,PSC羟脯氨酸含量为9.53 g/100 g;ASC脯氨酸含量为14.33 g/100 g,PSC脯氨酸含量为14.52 g/100g (表1),PSC亚氨酸含量高于ASC, 氨基酸实验结果与热变性结果相吻合。
鲈鱼骨ASC、PSC共检测出15种氨基酸,其中包括6种必需氨基酸(赖氨酸、苏氨酸、缬氨酸、亮氨酸、异亮氨酸和苯丙氨酸)和8种非必需氨基酸(脯氨酸、谷氨酸、精氨酸、甘氨酸、丙氨酸、丝氨酸、组氨酸和天冬氨酸),由表1可以看出,鲈鱼骨ASC、PSC具有非常相似的氨基酸组成,其中甘氨酸含量最高,丙氨酸、脯氨酸、谷氨酸和羟脯氨酸含量相对较高,酪氨酸、蛋氨酸和胱氨酸含量未检出。符合胶原蛋白的基本特性。
3 小结
粘度测定结果表明,ASC的变性温度25~30 ℃,PSC的变性温度为30~35 ℃;电泳结果表明,ASC和PSC都属于Ⅰ型胶原且纯度比较高;氨基酸分析结果ASC羟脯氨酸含量为9.41 g/100 g,PSC羟脯氨酸含量为9.53 g/100 g,ASC脯氨酸含量为14.33 g/100 g,PSC脯氨酸含量为14.529.53 g/100 g,氨基酸检测结果与粘度检测结果相一致。
参考文献:
[1]王师俊.明胶[J].化学世界,1991,32(2):49-55
[2] 张其清,王彭延,朱明华,等.胶原材料的生物学评价[J].生物医学工程学杂志,1989,6(3):216-218
[3] 段蕊,张俊杰,陈玲,等.鲤鱼鱼皮和鱼骨酶溶性胶原蛋白的性质比较[J].食品与发酵工业,2008,34(5)10-13
[4] 永进裕.藤本大三郎.刘平.胶原蛋白实验方法[M].上海:上海中医学院出版社,1992
[5] 金成.草鱼鱼鳞胶原蛋白的提取及特性研究[D].武汉:华中农业大学硕士学位论文,2005。
[6] Nagai T,Suzuki N.Preparation and characterization of several fish bone collagens[J].Journal of Food Biochemistry,2000,24(5):427-436
[7] 曾名勇,张联英,刘尊英,等.几种鱼皮胶原蛋白的理化特性及其影响因素[J].中国海洋大学学报,2005,35(4):608-612
[8] 汪海波,梁艳萍,汪海婴,等.草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J].水产学报,2012,36(4)553-561
[9] 刘邦辉,郁二蒙,谢骏,等. 脆肉鲩鱼皮和肌肉胶原蛋白的理化特性及其影响因素研究[J].江苏农业科学,2012,40(2):200-204
[10] 张俊杰 段蕊,刘佳梅,等.鲤鱼鱼皮和鱼骨酶溶性胶原蛋白性质异同的分析[J].食品科学,2008,29(12):128-131
[11] Johnstone-Banks F A.Gelatin,Chapter7 in Food Gels[M].London:Elsevier Applied Science Publishers,1990,233-291
Abstract:Acid-soluble and pepsin-soluble collagens (ASC and PSC) were extracted from the bond of Lateolabrax japonicus C and partially characterized.The compositions and certain properties of Acid-soluble and pepsin-soluble collagens (ASC and PSC) of the bond of Lateolabrax japonicus C. were strdied.The denaturation temperature (Td) of collagens were researched by viscosity of collagen solution.The Td of ASC and PSC from bone were 25~30 ℃ and 30~35 ℃,respectively.Electrophoretic patterns of collagens from bone were high purity Collagen type Ⅰ, hydroxyproline and proline were lower the ASC than the PSC.which was in accordance with the results of composition analysis and Td.
Key words:Acid-soluble collagen, pepsin-soluble collagen, electrophoresis, viscosity, a mino acid

