不同养殖环境中的中华绒螯蟹组织抗氧化剂水平和抗氧化酶活力
叶桂煊 王禹 李翔 潘国峰

摘要:对不同养殖环境中的中华绒螯蟹(Eriocheir sinensis)肝胰脏、鳃中进行总抗氧化能力(TAC)、丙二醛(MDA)含量、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽-S转移酶(GST)活性的测定。结果表明不同养殖环境中,中华绒螯蟹的肝胰脏和鳃中MDA含量呈显著性差异(P<0.05),分别为:肝胰脏:8.74±3.37(牛山湖),18.28±5.45(牛山池塘);鳃:2.31±0.41(牛山湖),3.46±0.80(牛山池塘)。在中华绒螯蟹鳃的测定中CAT活性呈显著性差异(P<0.05)分别为:453.24±143.97(牛山湖),231.16±49.05(牛山池塘)。但其它生理生化指标均无显著性差异。说明不同养殖环境对中华绒螯蟹体内MDA影响较明显,可通过测定MDA的值来选择适合的养殖环境。
关键词:中华绒螯蟹;抗氧化剂;抗氧化酶;养殖环境
活性氧(ROA)的产生是需氧生物生命活动过程中的代谢产物及其衍生的含氧物质[1]。分子如过氧化氢(H2O2),超氧阴离子(O2-·)和氢氧自由基(HO·) 通过氧化代谢途径对能源的产生形成非常有效的副作用。在哺乳动物中,据估计,几乎1%~4%的总耗氧量(OC)转换成O2-·及H2O2[2]。产生的活性氧,必须被阻止或分解,以避免氧化损伤几种高分子物质(蛋白质,脂类和DNA),这任务由抗氧化系统完成[3]。机体内的抗氧化体系包括抗氧化酶体系和抗氧化物质体系,通过清除活性氧及其自由基、分解过氧化产物,阻断过氧化链和除去起催化作用的金属离子这三个途径来保持体内自由基的动态平衡[4]。
器官组织中的总抗氧化能力是反映机体抗氧化作用的重要指标之一,而超氧化物歧化酶(SOD)作为机体关键性抗氧化酶,对生物体体内氧化与抗氧化平衡起着重要的作用。此酶可催化超氧阴离子自由基(O2-·)发生歧化反应,从而保护机体免受自由基的侵害。丙二醛(MDA)是由自由基与生物膜中的脂类发生过氧化反应,形成的氧化终产物,是膜脂过氧化最重要的产物之一,可通过MDA的量了解膜脂过氧化程度,间接反映膜系统受损程度。过氧化氢酶(CAT)可分解化学性质最活泼的活性氧氢氧自由基(HO·),后者几乎可以与细胞内的一切有机物进行反应,并且反应速率快、对细胞损害极大,因此对CAT的测定就有其重要意义。谷胱甘肽-S转移酶(GST)是一组多功能的同工酶,具有解毒的作用,亦有清除自由基的作用。
总抗氧化能力和上述抗氧化物质的研究在人、高等动物和植物中已有较多报道[5-7],而在甲壳动物中研究较少。中华绒螯蟹(Eriocheir sinensis),俗称河蟹,是一类淡水养殖甲壳动物,具有重要的经济价值。在养殖过程中,由于水体污染、低温、低盐和其它环境因子的变化,会使其体内自由基水平不断变化,从而需要体内抗氧化体系的不断作用,来维持体内自由基的动态平衡。本实验研究了不同养殖环境中的中华绒螯蟹组织抗氧化剂水平和抗氧化酶活力,以期为中华绒螯蟹的健康养殖提供基础资料。
1 材料和方法
1.1 实验材料
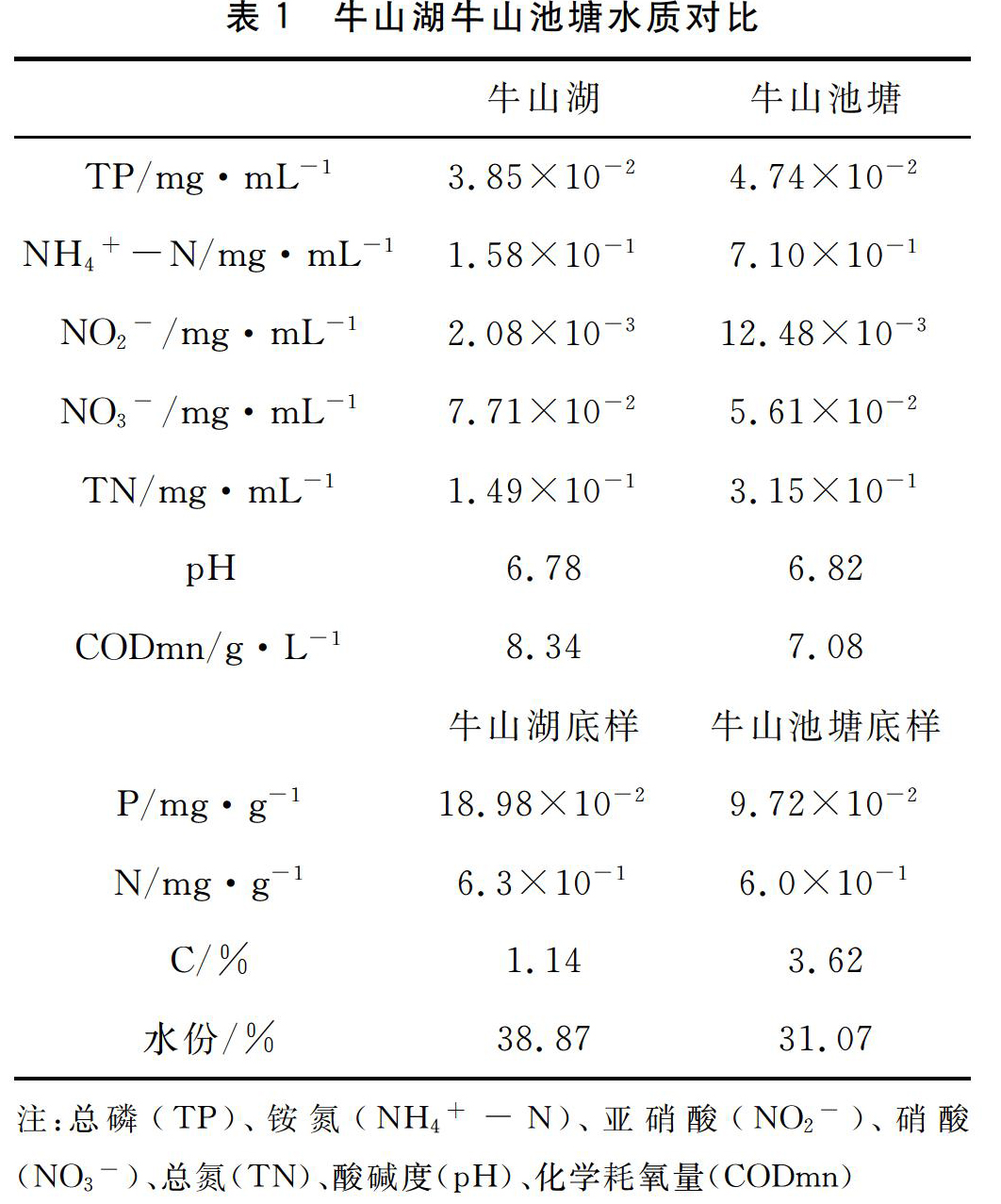
实验用中华绒螯蟹采于湖北牛山湖和牛山池塘两采样点,每点10只,选择体色鲜亮,无病无伤,附肢齐全的蟹用于实验。
在采样的同时对牛山湖和牛山池塘两处水质进行了简单的测定,从表1可以看出,牛山湖与牛山池塘水质差异并不显著。
1.2样品制备
1.2.1 取材 从每个采样点随机抽取5只河蟹,分别取每只蟹的鳃、肝胰脏,置于-78 ℃冰箱保存。
1.2.2 器官组织匀浆 保存的器官组织用电子天平称取,加入9倍生理盐水进行冰浴匀浆,在4 ℃,3 500 r/min条件下离心10 min,取上清液备用。
1.3 测定方法
采用南京建成生物工程研究所的试剂盒进行蛋白含量的测定,具体方法参照试剂盒说明,单位为g/L。蛋白含量的测定为其它生理生化指标的计算提供依据。
总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽-S转移酶(GST)、过氧化氢酶(CAT)的测定方法按照南京建成生物工程研究所的试剂盒说明进行测定。
组织匀浆中T-AOC单位定义:在37 ℃时,每毫克组织蛋白每分钟使反应体系吸光度(OD)值增加0.01时,记为一个总抗氧化能力单位,单位为U/mg蛋白。SOD活力单位定义:在每毫升反应液中,每毫克组织蛋白使SOD抑制率达50%时所对应的SOD值为一个SOD活力单位,单位为U/mg蛋白。MDA单位为nmol/mg蛋白。GST活力单位定义:在37 ℃时,每分钟每毫克组织蛋白扣除非酶促反应,使反应体系中GSH浓度降低1 μmol/L为一个活力单位,单位为U/mg蛋白。CAT单位定义:每克组织蛋白中过氧化氢酶(CAT)每分钟分解吸光度为0.50~0.55的底物中的过氧化氢相对量为一个过氧化氢酶的活力单位,单位为U/g蛋白。
1.4 数据处理
试验数据通过STATISTCA(Version6.0)统计软件进行处理分析,采用独立性t检验的方法进行差异性分析。
2 实验结果与分析
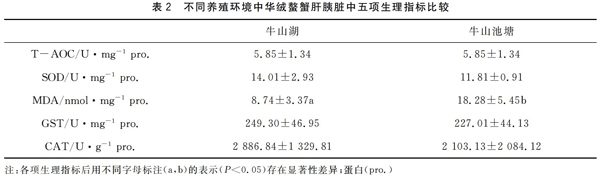
2.1 中华绒螯蟹肝胰脏中各项生理指标的测定
从表2可以看出不同养殖环境中,中华绒螯蟹肝胰脏中的各项抗氧化指标有一定的差异。统计分析表明,中华绒螯蟹肝胰脏中的T-AOC、SOD、GST、CAT均无显著性差异(P>0.05),而MDA表现出显著性差异(P<0.05)。
2.2 中华绒螯蟹鳃中各项生理指标的测定
从表3可以看出不同养殖环境中,中华绒螯蟹鳃中的各项抗氧化指标有一定的差异。统计分析表明,中华绒螯蟹鳃中的T-AOC、SOD、GST均无显著性差异(P>0.05),而MDA、CAT表现出显著性差异(P<0.05)。
3 讨论
SOD是生物体内清除自由基的首要物质,可催化超氧阴离子发生歧化反应从而保护机体免受伤害,所以机体内SOD活性反映组织器官的抗氧化能力[4]。自由基对机体的攻击力很强,它最易破坏生物膜中的脂类物质引发脂质过氧化反应[8-9],而MDA是膜脂过氧化最重要的产物之一,因此MDA的高低可以间接反应出机体受到自由基攻击的损伤程度[10]。CAT可催化H2O2分解无害的氧和水,而H2O2是由SOD清除O2-·所产生的,所以CAT是生物体内抗氧化体系的关键酶之一[11]。GST是生物体内主要的抗氧化酶,在保护细胞膜免受过氧化损伤中具有特殊而重要的意义,其活力大小可体现出活性氧自由基的积累和对细胞膜损伤的程度[12]。T-AOC可反映机体自由基代谢状态和机体抗氧化系统的工作能力,由于T-AOC具有很强的代表性,所以是机体反映体内组织抗氧化功能的一个良好指标[13]。
实验结果表明,不同环境中,所测定的中华绒螯蟹组织抗氧化水平和抗氧化酶活力不同,其中T-AOC、SOD、GST无显著性差异(P>0.05),其原因可能是由于环境因素差异不大造成的。而且健康的机体其抗氧化水平维持在一定范围内,也不容易出现显著性差异。在中华绒螯蟹肝胰脏和鳃中各项生理指标的测定显示MDA表现出显著性差异(P<0.05)。牛山池塘中中华绒螯蟹组织中MDA含量高于牛山湖中华绒螯蟹组织中MDA含量,说明牛山池塘中中华绒螯蟹组织中脂质过氧化的程度高、机体细胞损伤大,这可能是由于其他抗氧化酶活性低造成的,而测定结果刚好反映出这点。由于MDA含量受环境等诸多因素的影响,本实验无法确定出哪一种具体的因素造成MDA表现出显著性差异,尚需更加深入的研究和比较。
许多外国学者研究证明自由基是造成衰老的重要因素之一[14]。随着年龄的增长,机体清除自由基的能力降低,脂质过氧化物(LPO)增加[15]。丙二醛(MDA)由氧化物酶分解LPO产生,可与磷脂酰乙醇胺交联在细胞内合成脂褐素沉淀,使细胞老化[16]。而Vc、VE是可以降低LPO脂质过氧化反应的天然抗氧化剂[17]。所以MDA表现出的显著性差异可能和环境或饵料中的Vc、VE等抗氧化物质的差异有关。
CAT活性测定在鳃中表现出显著性差异,而在干胰脏中却没有表现,这可能是与不同组织的组成和功能的不同有关。鳃呼吸过程中产生的大量超氧阴离子自由基主要靠SOD清除[18],而SOD清除过量的O2-·所带来的过量的H2O2需要CAT消除,出现的显著性差异也可能是个体呼吸系统差异或损伤造成的。刘晓玲等研究表明CAT活性在饲料中添加Vc后有所降低,机体内H2O2水平受到Vc的调节和影响[19]。说明非酶促反应体系对酶促反应体系的活性有所影响,所以CAT表现出的显著性差异可能受到环境中抗氧化物质因素的影响。
参考文献:
[1]李大鹏,刘松岩,谢从新,等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J].水生生物学报,2008,3(32):34-39
[2] Storey KB. Oxidative stress: animal adaptations in nature[J]. Braz. J. Med. Biol. Res. 1996, 29, 1715-1733
[3] Halliwell B, Gutteridge J M, Free Radicals in Biology and Medicine[J]. Oxford University Press, New York. 1999
[4] 方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002:122-161
[5] Meister A. Glutatuione-ascorbic acid antioxidant system in animals[J]. Journal Biology Chemistry, 1994, 269: 9397-9400
[6] Hee L, Bum L. Chilling stress-inducd changes of antioxidant enzymes in the leaves of cucumber: in gel enzyme activity assays[J]. Plant Science, 2000, 195: 75-85
[7] Karlsson K, Marklund S. Extracellular superoxide dismutase in the vascular system of mammals[J]. Journal Biochemistry, 1988, 255: 223-228
[8] Mourente G, Diaz-Salvago E, Bell J G. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (Sparus aurata L.)fed dietary oxidized oil: attenuation by dietary vitamin E[J]. Aquaculture, 2002, 214: 343-361
[9] Wolf R, Wolf D, Ruocco V. Vitamin E: the radical protector[J]. J Europ Acade Dermatol Venereol, 1998, (10): 103-117
[10] 殷作明,胡德耀,李素芝,等.高原高寒战时环境猪肢体枪弹伤后T-AOC、SOD、MDA的特点变化及意义[J].第三军医大学学报,2005,9(27):809-812
[11] 许黎黎,邵雪玲.鲫鱼不同组织过氧化氢酶同工酶活性的比较[J].氨基酸和生物资源,2003(04):69-71
[12] 陈家长,孟顺龙,瞿建宏,等.低浓度阿特拉津对鲫鱼谷胱甘肽-S转移酶(GSTs)活性的影响[J].生态与农村环境学报,2007,23(1):68-72
[13] Lewis SEM, Young IS, Boyle PM, et al. Total antioxidant capacity of seminal plasma is different in fertile and infertile men. Fertil Steril, 1996, 64: 868
[14] Schafter I, Thorling EB. Lipid peroxidation and antioxidant supplementation in old age. Scandinavian Journal of Clinical and Laboratory Investigation, 1990, 50(1): 69-75
[15] Simonaffm S. Garnier N. Antioxidant status(selenium, Vitamins A and E)and aging[J]. Exs, 1992, 62: 368
[16] 胡亚军,赵夷军.硒与衰老[J].中华老年医学杂志,1994,10(13):313
[17] 季晓莉,林娜,常丽华,等.老年人长期服用Vc、VE对脂质过氧化和血脂的影响[J].中华老年医学杂志,1997(03):152-153
[18] 孔祥会,王桂忠,艾春香.锯缘青蟹不同器官组织中总抗氧化能力和S O D活性的比较研究[J].台湾海峡,2003,4(22):469-474
[19] 刘晓玲,周忠良,陈立侨,等.维生素C、E对镉致毒后中华绒螯蟹抗氧化系统酶活性的影响[J].海洋科学,2006(01):39-43
Abstract:This paper studied the effect of the different farming environment on the total antioxidant capacity (TAC), Malondialdehyde (MDA) content, catalase (CAT), superoxide dismutase Superoxide dismutase (SOD), glutathione-S-transferase (GST) activity in hepatopancreas and gill of Chinese mitten crab (Eriocheir sinensis). The results showed that between two culture sites with the different environment, the Chinese mitten crab stem and gills in the pancreas MDA content was significantly different (P<0.05), respectively: hepatopancreas: 8.74 ± 3.37 (Niushan Lake), 18.28 ± 5.45 (Niushan pond); Gill: 2.31 ± 0.41 (Niushan Lake), 3.46 ± 0.80 (Niushan pond). In the determination of the Chinese mitten crab gill CAT activity was significantly different (P<0.05), respectively: 453.24 ± 143.97 (Niushan Lake), 231.16 ± 49.05 (Niushan pond). However, other physiological and biochemical indicators there were no significant difference. Note different culture environment on the Chinese mitten crab in a significant impact on MDA, the MDA can be of value to choose the suitable breeding environment.
Key words:Chinese mitten crab (Eriocheir sinensis); Antioxidants; Antioxidant enzymes; Rearing environment

