线鳞型黄金鲫(框鳞镜鲤♀×红鲫♂)mtDNA及同工酶的遗传分析
杨晶晶等


摘要:对全鳞型黄金鲫和线鳞型黄金鲫的mtDNA D-loop及其邻近区段进行PCR扩增并测序,并检测了两种类型黄金鲫肌肉的GPI和LDH同工酶。1尾黄金鲫(全鳞型)获得了碱基排列顺序清晰的1348 bp的片段,2尾黄金鲫(全鳞型)尾为1351 bp,3尾黄金鲫(均为线鳞型)为1349 bp。应用MEGA6.0软件与GenBank上的3个鲤鱼(KC292935、KC292936和X61010.1)和3个鲫鱼(KC292946、KC292947和KC292948)相应区段比较结果表明,6尾黄金鲫与鲤鱼和鲫鱼的遗传距分别为0.011和0.095,鲤鱼与鲫鱼的遗传距为0.097。GPI与LDH两种同工酶谱显示两种类型黄金鲫均具有来自鲤鲫双方的遗传物质。结果表明,全鳞型与线鳞型黄金鲫均符合母本为鲤鱼、父本为鲫鱼的遗传特征,推测线鳞型黄金鲫母本鳞被的基因型应为SSNn、SsNn或ssNn,父本应为SSnn,线鳞型黄金鲫鳞被的基因型应为SSNn或SsNn。
关键词:黄金鲫;鳞被;基因型;mtDNA;碱基序列;同工酶
黄金鲫为国家级天津市换新水产良种场培育的以框鳞镜鲤为母本、红鲫为父本的杂交种,2007年被国家认定为养殖新品种(品种登记号:GS02-001-2007)。鱼体背部及两侧呈浅黄色,腹部银灰色,体被全鳞,鳞片中等大小,侧线鳞31~34枚[1-2]。2013年11月份在天津市两个养殖场养殖的黄金鲫中发现有线鳞型个体(90尾中有6尾线鳞型个体,占6.67%)。
鲤鱼中依据鳞被特征可以分为鳞鲤(scaled carp)、线鳞镜鲤(linear mirror carp)、散鳞镜鲤(scattered mirror carp)和革鲤(leather carp)或裸鲤(nude carp)共四种类型,其中线鳞镜鲤和裸鲤均含有N基因,而楼允东认为在我国用于杂交的鲤鱼品种不包括线鳞镜鲤和革鲤[3-4]。至今在我国鲤鲫杂交子代中没有关于线鳞型个体的报导。mtDNA为母性遗传,其D-loop以及COⅠ等区段的序列分析可以作为种类鉴别的DNA条形码[5-10]。同工酶可以有效鉴别鲤鲫杂交种[11-14]。
为探讨线鳞型个体是否属于黄金鲫,是否具有黄金鲫的遗传结构,鳞被遗传特点如何,本研究以3尾全鳞型黄金鲫以及3尾线鳞型个体(以下也称为黄金鲫)为实验材料进行了mtDNA D-loop及其邻近区段的PCR扩增和序列测定,与GenBank上的鲤鱼、鲫鱼的相应区段进行了序列比较。同时检测了两种类型黄金鲫肌肉的GPI和LDH同工酶。以期为黄金鲫的种质鉴定以及鲤、鲫鱼遗传育种工作提供依据。
1材料与方法
1.1试验鱼
于2013年11月从天津市某鱼类养殖场采集3尾全鳞型黄金鲫以及3尾线鳞型黄金鲫(图1、表1)。鲜活状态下剪取大小约1.0 cm×0.5 cm的鳍条用于DNA提取,-20 ℃冷冻保存鱼体用于同工酶的检测。
1.2DNA的提取、mtDNA D-loop及邻近区段PCR扩增
用苯酚-氯仿抽提法从鳍条提取总基因组DNA,4 ℃下保存备用[15]。以提取的DNA为模板,使用L15923和H1067引物对每尾试验鱼的mtDNA D-loop及其邻近区段进行扩增,两个引物的结合位点分别位于tRNAThr和12S rRNA 编码区上。将PCR产物委托深圳华大基因科技有限公司纯化并测序,得到的序列依据峰图进行确认[9]。
1.3DNA序列分析
使用MEGA6.0软件对6个黄金鲫序列、GenBank上的3个鲤鱼序列(KC292935、KC292936和X61010.1)和3个鲫鱼序列(KC292946、KC292947和KC292948)进行比对分析,计算6尾黄金鲫与鲤鱼、鲫鱼的遗传距,构建NJ树[16]。
1.4同工酶电泳
使用水平式淀粉凝胶电泳法(缓冲液为C-APM)检测试验鱼背部肌肉的葡萄糖磷酸异构酶(GPI)和乳酸脱氢酶(LDH),并与鲤、鲫对照。电泳及染色同鲍迪等采用的方法[14]。
2结果
2.1mtDNA D-loop 及其邻近区段的PCR扩增
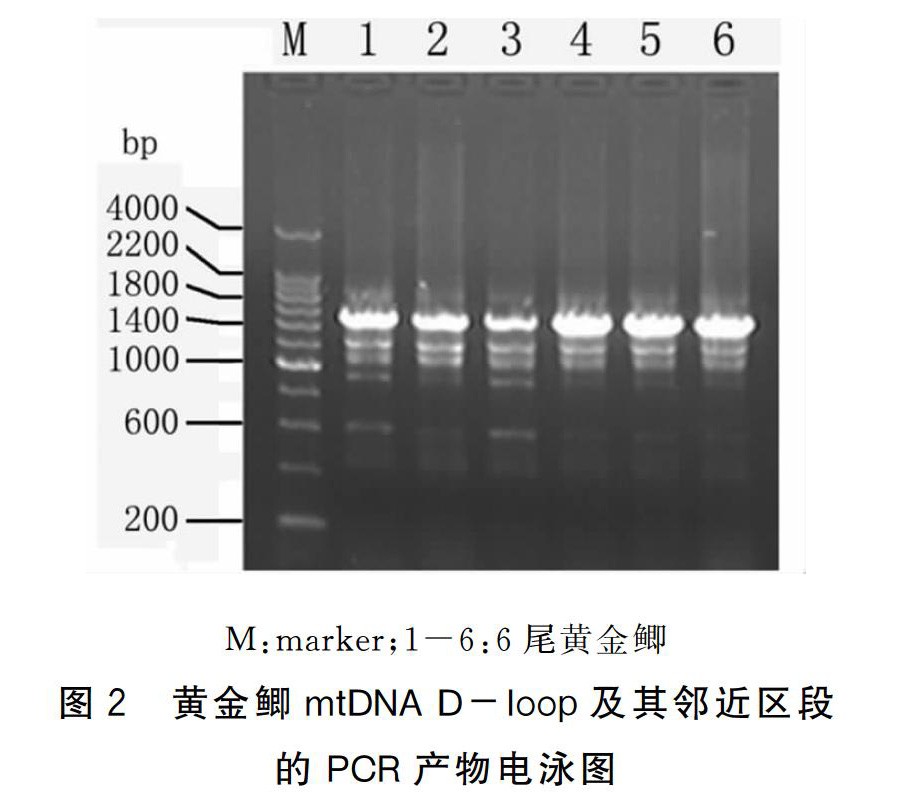
对6尾黄金鲫的mtDNA D-loop及其邻近区段进行PCR扩增,经1%的琼脂糖凝胶电泳均得到长度大约为1600bp的DNA片段(图2)。
2.2黄金鲫序列与GenBank中的鲤鱼序列(KC292936)的比较
PCR产物经纯化、测序、峰图确认,获得了碱基排列顺序清晰的1348bp-1351 bp 的片段。与GenBank中的鲤鱼序列(KC292936)进行BLAST比对,有碱基插入现象,所得片段位于KC292936中的100至1447之间,包含部分tRNAThr、全部D-loop和部分tRNAPhe。6尾黄金鲫中1号和3号为1种单倍型、片段长度为1351bp,2号为1种单倍型、片段长度为1348bp,4号、5号和6号为1种单倍型、片段长度为1349bp(表2)。
2.3黄金鲫与鲤、鲫的遗传距离和系统树
使用MEGA6.0对6尾黄金鲫和GenBank上的3个鲤鱼序列和3个鲫鱼序列进行分析。6尾黄金鲫个体间、鲤鱼3个序列间和鲫鱼3个序列间的遗传距分别为0.006、0.018和0.001。3尾全鳞型黄金鲫与3尾线鳞型黄金鲫、鲤及鲫的遗传距分别为0.009、0.012和0.094,3尾线鳞型黄金鲫与鲤、鲫的遗传距分别为0.010和0.096,鲤、鲫之间的遗传距为0.097。12个序列间的NJ树见图3。
2.4同工酶
同工酶电泳分析结果表明全鳞型、线鳞型的GPI和LDH两种同工酶均由来自于鲤、鲫双方的遗传物质所支配(图4)。
3讨论
3.1线鳞型黄金鲫父母本的推测
线粒体DNA(mtDNA)为母性遗传,其一些区段的RFLP或碱基序列可以用于物种的遗传多样性分析,也可以作为DNA条形码进行物种鉴定[4-11]。本研究中得到的包含部分tRNAThr、全部D-loop和部分tRNAPhe 的DNA片段,3尾全鳞型黄金鲫与3尾线鳞型黄金鲫之间的遗传距为0.009,3尾全鳞型黄金鲫和3尾线鳞型黄金鲫与GenBank中3个鲤鱼序列的遗传距分别为0.012和0.010,均小于2%,符合种内遗传特征[7-8,10]。由此可以认为无论是全鳞型黄金鲫还是线鳞型黄金鲫,其母本均为鲤鱼。同工酶是杂交种鉴别的有效手段之一[11-14]。全鳞型黄金鲫和线鳞型黄金鲫的葡萄糖磷酸变位酶(GPI)和乳酸脱氢酶(LDH)均具有鲤鲫双方的遗传物质,符合鲤鲫杂交种的特性[11-12,14]。
3.2线鳞型黄金鲫鳞被基因型的推测
鲤鱼鳞被是由S-s和N-n两对基因控制,可分为四种类型,分别为鳞鲤(全鳞)(S-nn)、线鳞镜鲤(S-Nn)、散鳞镜鲤(ssnn)和革鲤(ssNn),NN个体不能存活[3-4]。欧鲫、丁鱥和鲤鱼具有位于同源染色体上的同源基因,欧鲫与革鲤的杂交的子代中几乎一半是全鳞型、一半是线鳞型,线鳞型鲤鲫杂种外形颇似线鳞镜鲤[3]。由于鲤鱼中NN个体不能存活,所以推测本研究中线鳞型黄金鲫母本鳞被的基因型应为SSNn、SsNn或ssNn,这样的母本与红鲫杂交,理论上一半子代应为全鳞型个体(SSnn或Ssnn)、另一半应为线鳞型个体(SSNn或SsNn)。
参考文献:
[1]金万昆.淡水鱼类远缘杂交实验报告[M].北京:中国农业科学技术出版社,2009:127-140
[2] 金万昆,付连君.黄金鲫养殖技术[J].河南水产,2010(4):24-25
[3] 张兴忠,仇潜如,陈曾龙,等.鱼类遗传与鱼种[M].北京:农业出版社,1988:93-99
[4] 楼允东.鱼类育种学[M].北京:中国农业出版社,1999:305-313
[5] 肖武汉,张亚平.鱼类线粒体DNA的遗传与进化[J].水生生物学报,2000,24(4):384-391
[6] 周延清,杨清香,张改娜.生物遗传标记与应用[M].北京:化学工业出版社,2008:119-132
[7] Hebert P D N,Ratnasingham S,deWaard J R.Barcoding animal life: cytochrome c oxidase subunit 1 divergences among closely related species[J].Proceedings of the Royal Society B,2003,270:96-99
[8] Hebert P D N,Cywinska A,Ball S L, et al.Biological identifications through DNA barcodes[J].Proceedings of the Royal Society B,2003,270:313-321
[9] 郝君,杨蔷,鲍迪,等.6种鱼mtDNA D-loop及其邻近区段的序列比较分析[J].大连海洋大学学报,2013,28(2):160-165
[10] 张大莉,董仕,白俊杰,等.大口黑鲈北方亚种和佛罗里达亚种mtDNACOⅠ序列的分析[J].大连海洋大学学报,2014,29(3):212-216
[11] Dong S, Taniguchi N.Allozyme, morphology and growth autotriploids and allotriploids in common carp[J].Suisanzoshoku,1993,41(1):35-43
[12] 董仕,王茜,孟宪军.湘云鲫红细胞大小及同工酶分析[C].2001年中国水产学会学术年会论文集(中国水产学会编),北京:海洋出版社,2002:61-65
[13]丁立云,曹义虎,贺刚,等.同工酶分析技术及其在水产动物研究中的应用[J].江西水产科技,2013(3):31-35
[14] 鲍迪,梁爱军,董莹,等.鲤鲫杂交子代的同工酶分析[J].水产科学,2012,31(5):283-287.
[15] Perez-Enriquze R,Taniguchi N.Genetic structure of red sea bream(Pagrus major) population of Japan and the Southwest Pacific,using Microsatellite DNA Markers[J].Fisheries Science,1999,65(1):23-30
[16] Tamura K,Stecher G,Peterson D,et al.MEGA6:molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12) :2725-2729
(收稿日期:2015-05-26)

