鱼配合饲料中氯霉素残留量的检测方法
罗靳
摘要:研究了一种相比于GB/T 21108-2007《饲料中氯霉素的测定 高效液相色谱串联质谱法》前处理步骤相对简单的方法测定鱼配合饲料,采用内标法定量,添加0.1 μg/kg、0.3 μg/kg、1.0 μg/kg、5.0 μg/kg四个浓度,回收率在90.2%~119.9%。氯霉素在0.1~20.0 ng/mL范围内线性关系良好,R2>0.999,相对标准偏差(RSD)<6%,满足GB/T 27404-2008以及GB/T 21108-2007对回收率和精密度的所有要求。通过计算得到方法检出限(LOD)为0.002 μg/kg,方法定量限(LOQ)为0.006 μg/kg。
关键词:氯霉素检测,鱼配合饲料,检测方法研究,液相色谱串联质谱法
氯霉素属广谱抗生素,它通过与核糖体的50S亚单位结合,而抑制细菌蛋白质的合成。对革兰氏阳性菌和革兰氏阴性菌均有较好的抑制作用,对立克次体、衣原体也有抑制作用。因其效高价廉,曾在水产、畜牧业中广为应用。但氯霉素有较强的毒副作用和毒性,长期应用可导致再生障碍性贫血和粒细胞缺乏症。如果氯霉素在食用动物中残留,可通过食物链传给人类,对人类的健康造成危害。目前检测饲料中氯霉素的方法有气相色谱-质谱法[1-3]、液相色谱-质谱法[4-6]和酶联免疫法[7-8]。本实验参考GB/T 20756-2006等方法[5-6,9-10]研究出一种前处理步骤相对简单的液相-质谱法用于检测鱼配合饲料,降低了不确定度,并且缩短了检测时间,提高了检测效率。
1材料与方法
1.1主要试剂
氯霉素标准品均购自Dr.Ehrenstorfer Gmb公司,纯度≥98.5% Lot No.90424,氘代氯霉素(chloramphenicol-D5)购自Dr.Ehrenstorfer GmbH Lot No.30417AC 100 μg/mL。乙酸乙酯,Fisher ,色谱纯;正己烷,沃凯,色谱纯;实验用水为Mili-Q制得的电导率18.2Ω的超纯水。
1.2主要仪器
IKA分析研磨机;湘仪离心机TDAA-WS;0.22 μm微孔滤膜;EYELA旋转蒸发仪;日立高速冷冻离心机 HITACHI CF16RXⅡ;HPLC system:Agilent 1200 series,Agilent 6410 LC/MS/MS Agilent6410a 串联四级杆质谱仪,配有电喷雾离子源(ESI);ZORBAX SB-C18,150 mm×2.1 mm(i.d.),5 μm Agilent。
1.3试验部分
1.3.1标准溶液配制[9]准确称取10.00 g氯霉素,用乙腈溶解并定容至100 mL容量瓶,得到100 μg/mL氯霉素标准储备液;准确吸取 1 mL氯霉素标准储备液乙腈定容至100 mL,得到1 μg/mL氯霉素标准中间液;准确吸取1 mL氯霉素标准中间液,纯水定容50 mL,得到20 ng/mL氯霉素标准工作液。
准确吸取100 μg/mL氘代氯霉素内标标准储备液 100 μL乙腈定容至10 mL,得到1 μg/mL氘代氯霉素内标标准中间液 ;准确吸取1 mL氘代氯霉素内标标准中间液纯水定容50 mL,得到20 ng/mL氘代氯霉素标准工作液。
1.3.2样品前处理鱼配合饲料样品用IKA分析研磨机磨成细粉,准确称取5.00 g±0.001 g于50 mL具塞离心管中,加入20 ng/mL氘代氯霉素250 μL,加入15 mL乙酸乙酯,混匀,振摇15 min,4 000r/min离心8 min,取出上清,再用15 mL乙酸乙酯重新提取一次,合并上清,45 ℃旋转蒸发至干,5 mL水溶解,10 mL正己烷除脂两次,静止分层,取下层水相12 000 r/min 4 ℃冷冻离心后过0.22 μm水相有机相串联滤膜,得到样品用于液相串联质谱仪器测定。
1.3.3液质联用仪分析条件[10]
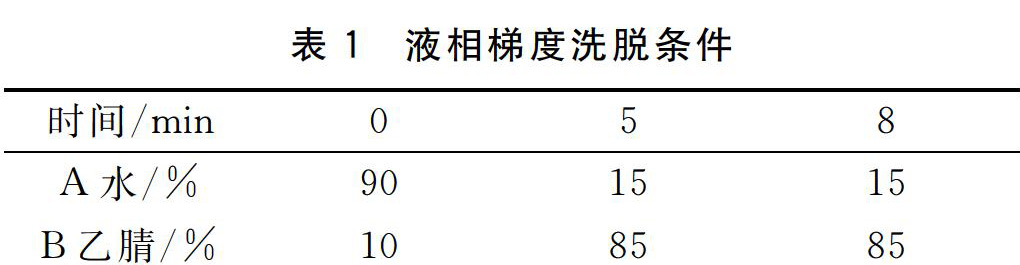
1.3.3.1色谱条件 色谱柱ZORBAX SB-C18,150 mm×2.1 mm(i.d.),5 μm Agilent,进样量为20 μL;柱温30 ℃;流动相为A去离子水、B乙腈;梯度洗脱条件见表1。
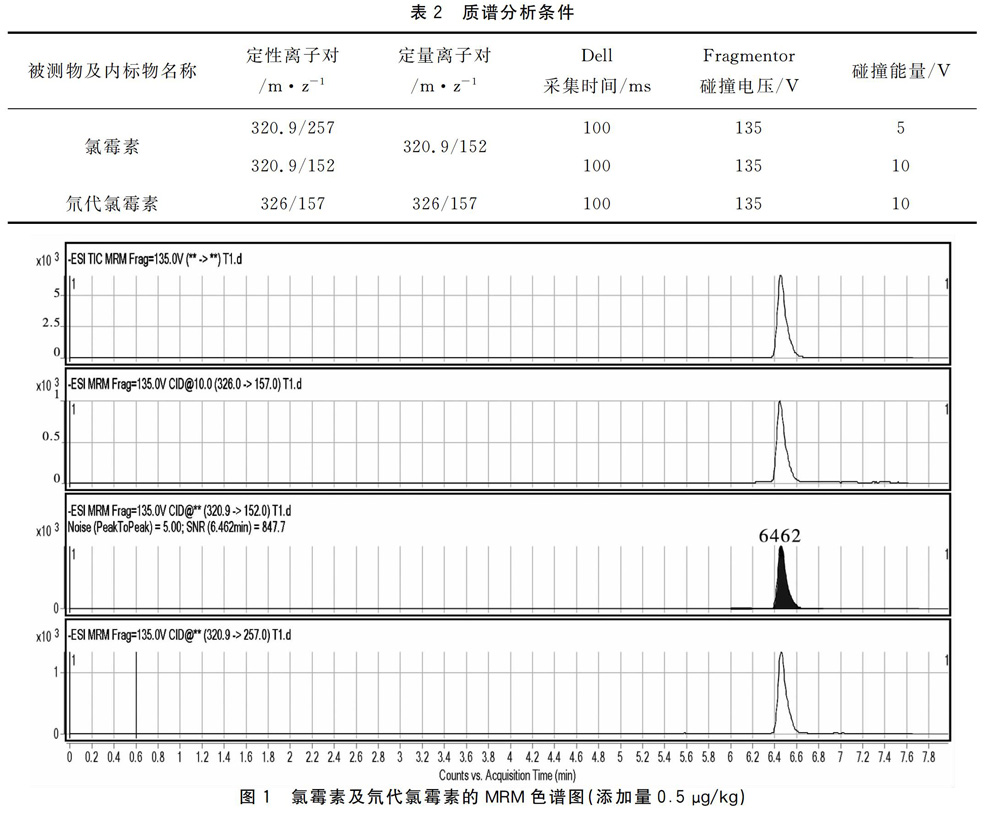
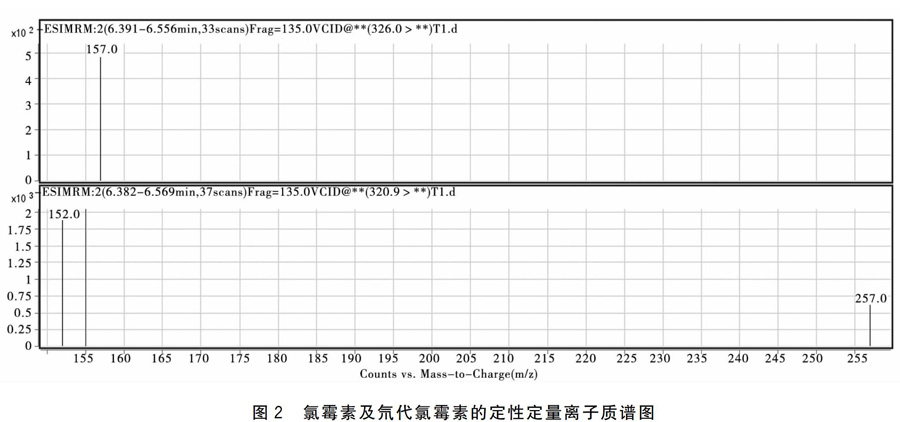
1.3.3.2质谱条件采用电喷雾离子源(ESI),负离子扫描,Capillary:4 000 V,多反应监测(MRM)方式检测,干燥气N2,干燥气温度350 ℃,雾化气压力35psi,优化质谱条件见表2,氯霉素及氘代氯霉素的MRM色谱图和其定性定量离子质谱图见图1、图2。
1.4线性范围、检出限和定量限
配制9个不同质量浓度的标准溶液,溶液中氯霉素为0.0、0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0 ng/mL,氘代氯霉素的质量浓度为1.0 ng/mL,测定峰面积,以质量浓度为横坐标,峰面积的比值(氯霉素峰面积/氘代氯霉素-D5面积)为纵坐标,绘制标准曲线。在空白配合饲料中添加氯霉素标准品以信噪比(S/N)≥3时的含量定为方法的检出限(LOD);以信噪比(S/N)≥10时的含量定为方法的检量限(LOQ)。
1.5回收率的测定
选取阴性鱼配合饲料样品,添加氯霉素标准品和内标,氯霉素标准品添加水平为0.1 μg/kg、0.3 μg/kg、1.0 μg/kg、5.0 μg/kg,氘代氯霉素 1.0 μg/kg,每个添加水平9次平行。
2试验结果
2.1线性范围、检出限和定量限
针对不同的添加浓度选择相应的浓度拟合成两条曲线,进行数据分析。针对添加浓度为0.1 μg/kg、0.3 μg/kg、1.0 μg/kg,选择CAP浓度为0.0 ng/mL、0.1 ng/mL、0.2 ng/mL、0.5 ng/mL、1.0 ng/mL、2.0 ng/mL拟合成一条标准曲线,曲线方程y=0.841 966x+0.011 336,R2=0.999 807 50。针对添加浓度为5.0 μg/kg,选择CAP浓度为0.0 ng/mL、0.1 ng/mL、1.0 ng/mL、2.0 ng/mL、5.0 ng/mL、10.0 ng/mL、20.0 ng/mL拟合成一条标准曲线,曲线方程y=0.902 543 x-0.007 240 3,R2=0.999 840 61。数据显示CAP在0.1~20.0 ng/mL范围内线性关系良好,R2>0.999。根据添加量为0.5 ng/mL的9个样品152定量离子的最低信噪比和计算公式3C/(S/N),计算理论方法检出限(LOD)为0.002 μg/kg,理论方法定量限为(LOQ)为0.006 μg/kg。
2.2回收率和精密度
针对不同添加量,其回收率和RSD见表3。
所有数据都满足GB/T 27404-2008[11]以及GB/T 21108-2007[4]对回收率和精密度的所有要求。
2.3实际样品的检测
利用该方法对12个鱼配合饲料样品进行检测,均为未检出。
3讨论
3.1前处理方法的优化
GB/T 21108-2007方法中包括提取—液-液分配净化—浓缩—溶解—SPE柱净化—浓缩—溶解,步骤繁琐,导致回收率偏低,不确定度增加,且效率降低。而本实验方法只包括提取—浓缩—溶解—除脂四个简单步骤,整个过程几乎无损耗,大大提高了回收率,降低了不确定度,并且缩短了检测时间,提高了检测效率。
3.2杂质峰的去除及除脂方法优化
本实验还尝试将乙酸乙酯提取后的上清液直接进行液相串联质谱检测,检测结果有杂峰干扰,于是浓缩后加入10 mL正己烷除脂,结果证明杂峰已去除,但是样品本身还残留有鱼饲料的黄色,正己烷再次除脂一次,样品已经变成清亮白色,液相串联质谱检测得到单一目的峰,峰形尖锐,无杂峰或拖尾现象。见图1。
3.3方法检出限和定量限
虽然根据计算得到方法检出限(LOD)为0.002 μg/kg,相比于GB/T 201108-2007方法的最低检测浓度5 μg/kg缩小了2 500倍,但它只是理论值,若将0.002 μg/kg添加到饲料中,采用这种方法检测在回收率和精密度方面是否符合要求将有待于进一步的实验进行验证。但是本实验的最低添加量0.1 μg/kg在回收率和精密度方面都符合国家标准要求,并且相比于GB/T 201108-2007方法的最低检测浓度缩小了50倍。
4结语
本文研究了一种相对于GB/T 21108-2007前处理步骤简单的方法测定鱼配合饲料,采用内标法定量,省略了液-液分配净化—浓缩—溶解—SPE柱净化步骤,相应地降低了不确定度,同时提高了检测效率。
参考文献:
[1] DB 34/T 1361—2011,饲料中氯霉素的测定—气象色谱质谱法[S]. 安徽省质量技术监督局,2011
[2] 刘红云,蔡海莹.饲料中氯霉素气相色谱-质谱检测方法的研究[J].兽药与饲料添加剂,2008,13(6):25-27
[3] 王丙涛.气质联用检测饲料中氯霉素的方法研究[J].现代畜牧兽医.2007(5):62-64
[4] GB/T 21108-2007,饲料中氯霉素的测定 高效液相色谱串联质谱法[S].北京:中国标准出版社,2007
[5] 吕飞,周宇,余优军,等.LC-MS/MS测定饲料中的氯霉素残留量两种不同前处理方法的比较[J].粮食与饲料工业,2012(8):61-64
[6] 魏云计,冯民.高效液相色谱-质谱法测定配合饲料中氯霉素残留量的研究[J].饲料博览,2013(4):5-8
[7] 贾涛.酶联免疫法检测饲料中氯霉素的探讨[J].饲料研究,2009(9):39-40
[8] 贾涛.酶联免疫法检测饲料中氯霉素的方法研究[J].饲料与畜牧,2013(8):43-46
[9] GB/T 20756-2006,可食性动物肌肉、肝脏、和水产品中氯霉素、甲风砜霉素和氟苯尼考残留量的测定 液相色谱-串联质谱法[S]. 北京:中国标准出版社,2007
[10] 薄尔琳,郑怀东,刘学光.同位素稀释液相色谱-串联质谱法快速测定海参中氯霉素[J].中国渔业质量与标准,2013,3(4):36-41
[11] GB/T 27404-2008,实验室质量控制规范 食品理化检测[S]. 北京:中国标准出版社,2008
(收稿日期:2015-06-15)

