微流控芯片上高电导率介质中聚苯乙烯微球的动电分离
宋宁宁 张昊 李金波 甄军晖 高健
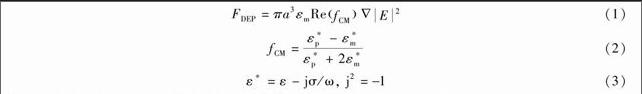

摘 要 采用三层夹心式、三平行微电极设计制作了聚二甲基硅氧烷 (Polydimethylsiloxane,PDMS)/玻璃微流控芯片,通过交流电对在微流控芯片中的高电导率溶液施加电场,达到不同尺寸聚苯乙烯(Polystyrene, PS)微球分离的目的;探讨了微球定向运动的动电学原理。结果表明,在电压为14 V,频率为100 kHz时,直径为10和25 μm的PS微球分离效率最好;在电压为10 V,频率为2 MHz时,直径为5和25 μm的PS微球分离效率最好;对于直径分别为5、10和25 μm的3种PS微球分离,在电压为11 V,频率为1 MHz时,可以达到大球和另外两种尺寸较小微球的快速有效分离, 分离效率均可达90%以上。结果表明,相邻电极中间位置层流区域的形成,对微球分离起到关键作用。
关键词 微流控芯片; 动电技术; 高电导率; 聚苯乙烯微球
1 引 言
交流电场通过微电极作用在微流体或带电微粒子上,使它们产生多种动电特性【1~3】,除介电泳(Dielectrophoresis, DEP)【4,5】外,还包括电泳(Electrophoresis, EP)【6,7】、电渗(Electroosmosis, EO)【8,9】、电热流(AC electrothermal flow, ACEF)【10,11】等。动电作用是操纵微尺度目标的最有效的方法之一,前人对动电力操控微纳尺度生物目标的研究主要集中在低电导率溶液中的介电泳力【12~14】。然而大多数生理体液的电导率较高(~1 S/m),常需要对样品进行预处理,调节电导率至较低水平(~0.01 S/m)。这样做有可能造成目标细胞的损失或稀释,降低检测灵敏度;同时也难以发挥其它动电作用的特点,限制了方法的使用范围。在高电导率介质中研究多种动电力对不同尺寸微目标的作用规律,对于最终实现实际生物样品的高效动电操纵具有重要意义。由介电泳受力方程可知【2,15】:
其中,a为粒子半径,εm为流体介质的介电常数,Re(fCM) 为CM因子的实部,E为电场强度,εp为粒子的介电常数,σ为电导率,ω为电场频率。
Re(fCM)是决定DEP力大小的因素之一,它表示在不同频率的电场下粒子和悬浮溶液的介电特性。当Re(fCM)>0时,微粒的极化作用大于溶液极化作用,从而使微粒聚集在电场的极大值处(靠近电极区域),这样的现象称为正介电泳现象;反之,为负介电泳现象【16,17】。由方程(2)和(3)可知,当溶液电导率>100 mS/m时,Re(fCM)为负值【15】,因此,高电导率介质中主要表现为负介电泳。此外,研究发现,在高电导率溶液中,多种动电力同时存在且共同发挥作用。一般认为,ACEF是一种远程作用力,可夹带离电极较远处的微粒;而EP、DEP是近程作用力,对于电极附近的微粒作用比较强【18,19】。理论上,上述动电特性在不同溶液中以及对不同种类微粒的作用效果都有差异【3】。利用这些差异,可实现对不同尺寸微目标的有效分离和捕获。
目前,还未见针对高电导率溶液中分离不同尺寸微粒的系统研究。由于单分散聚苯乙烯(Polystyrene, PS)微球的密度以及多种尺寸规格均与细胞接近,可作为不同种类、不同大小的细胞替代物或模拟物。本研究采用多种尺寸的单分散PS微球为研究对象,在流体静态条件下系统研究了DEP、EP与ACEF相结合的混合动电技术分离多尺寸微球的电场条件和动电学原理,为实际样品的分离捕获提供理论基础。实验在高电导率条件下进行,常用的Au-Cr微电极难以适应高电导率环境,在实验条件下容易被电解脱落,使用改进的 Ti-Au-Ti 三层夹心式微电极【18,19】,能够在高电导率溶液中以及实验条件下(<20 V, AC)长期稳定工作。聚二甲基硅氧烷 (Polydimethylsiloxane,PDMS)基的微流控芯片则具有制备方便\,牢固耐用等优点。将PS微球均匀分散在10×TAE缓冲溶液 (~1.59 S/m)中,以PDMS/玻璃微流控芯片为操作平台,利用混合动电作用实现不同尺寸PS微球的分离。
2 实验部分
2.1 仪器与试剂
XD-101倒置显微镜(南京江南永新光学有限公司);EC300 CCD(济南强胜光电仪器有限公司);SDG1020函数波形发生器(深圳鼎阳科技有限公司);PDC-32G等离子清洗仪(美国 Harrick Plasma公司)。单分散PS微球(5、10和25 μm, Micromod, GER);TAE缓冲溶液(美国Sigma公司)。
2.2 微流控芯片的制备
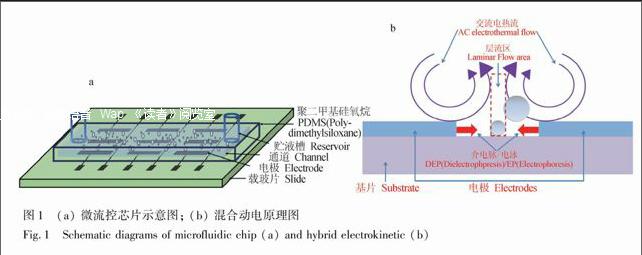
利用平版印刷术和电子束物理气相沉积法(EB-PVD)在载玻片上制备了三层夹心式(Ti-Au-Ti)微电极。其尺寸为:电极长度2.5 mm,上下电极宽度100 μm,中心电极宽度50 μm,Ti-Au-Ti层均为30 nm,相邻电极间隙宽度为125 μm。将制备好微通道(宽度为500 μm)的PDMS 基片与沉积好微电极的玻璃基片表面进行等离子清洗,然后迅速粘合,即制成PDMS/玻璃微流控芯片(图1a)。
3 结果与讨论
3.1 芯片上的微球分离
如前所述,高电导率溶液中Re(fCM)<0,各尺寸微球均受到负介电泳力作用,被推向场强较弱的区域;电热流则会导致流体在电极上方做环状流动【20】;实验还发现,施加一定的直流偏压后,微球的移动速度增大,这说明混合动电中存在EP,且EP可以增强混合动电的作用效果。因此,ACEF、DEP和EP同时存在且共同发挥作用。施加电场后,在电极附近的5和10 μm微球被ACEF、DEP和EP共同推至远离电极区域。由图1b可见,相邻的一对平行电极上方均有ACEF作用引起的流体流动,且方向相反;而在相邻电极的中间位置则存在一个ACEF相对较弱甚至无作用的层流区域(一定电压范围内,图1b中虚线框所示)。5和10 μm微球进入该区域后,因尺寸较小,易停留在该区域内,无法被ACEF夹带出去,同时它们也会受到来自另一方电极的ACEF、DEP和EP的作用,3种动电力协同作用使它们在电极间隙中心线区域达到受力平衡而聚集在该区域(图2c和2f)。相同条件下,在电极附近的25 μm微球也受ACEF、DEP和EP共同作用被推离电极。但因其尺寸较大,不易停留在层流区域内,在离电极较远处的25 μm微球被远程作用力ACEF夹带逐渐向中心电极靠近。当微球进入到近程作用力DEP、EP主要作用区域后,因受到DEP, EP的推离电极的力逐渐增强,微球速度逐渐减慢,最终DEP, EP与ACEF达到力平衡,将25 μm微球捕获在中心电极的中心线上(图2c和2f,因电极遮挡故不可见)。对预先混合的10和25 μm微球进行分离, 图2a~2c显示,在施加电场15 s后,基本可以实现两种微球的分离。同样,通过对预先混合的5、10和25 μm的3种微球进行分离实验可以得到类似的结果(图2d~2f),仅需18 s左右即可达到分离。从图2可见,除个别25 μm微球沉底贴壁无法移动外,绝大多数微球均可定向移动,多次实验统计结果得出分离效率大于90%。图2 (a~c) 10和25 μm PS微球随时间变化运动图像。施加的电压是14 Vp-p,频率100 kHz,直流偏压为0.3 V DC;(d~f) 5, 10 和 25 μm PS微球随时间变化运动图像。施加的电压是11 Vp-p,频率1 MHz,直流偏压为1.0 V DC
Fig.2 (a-c) Time lapse images for visualizing the movement of 10 and 25 μm polystyrene microspheres. The applied voltage was 14 Vp-p at 100 kHz with 0.3 V DC offset; (d-f) Time lapse images for visualizing the movement of 5, 10 and 25 μm polystyrene microspheres. The applied voltage was 11 Vp-p at 1 MHz with 1.0 V DC offset
由于实验所讨论的3种动电力的大小均与微球尺寸有关(FDEP~a3, FACEF~1/a3, FEP~a),因此,多种动电协同操纵微球时,其尺寸差异是影响分离的重要因素。
3.2 频率的影响
考察了频率100 kHz~10 MHz对PS微球定向操控的影响。由方程(1)可知,频率直接影响微球受到的DEP力的大小。同样,频率也影响ACEF 的大小(FACEF~M(ω,T)), 在不同频率条件下微球受到的ACEF、DEP和EP的总的合力不同,合力越大,微球的速度就越大。因此,频率对微球的影响可以通过微球的运动速度来体现。对于10和25 μm微球的分离,以25 μm微球为例,对不同频率下的微球进行分析,由图3a可知,不同位置微球速度随频率的变化趋势是相同的;而对于同一位置的微球而言,在频率为100 kHz时速度最大, 即此时25 μm微球受到的合力最大。频率为100 kHz时,通道各处的25 μm微球运动到中间电极中心线附近的时间均相对最短,同样的分析也适用于溶液中的10 μm微球。
实验还观察到,微球运动速度过小,会导致距离中心电极较远的25 μm 微球在没有到达中心电极之前就达到受力平衡,停止在电极间隙部位,降低了分离效率。微球运动速度越大,即所受合力越大,距离中心电极较远的25 μm微球被捕获到中心电极上的越多,分离效率越高。以上结果说明,100 kHz是实现快速有效分离的最优条件。
图3b表明,频率为2 MHz时,5和25 μm微球分离效率最高;5, 10和25 μm微球在1 MHz时分离效率最高。以上结果表明,频率是不同尺寸微球分离的另一个重要因素。
3.3 电压的影响
考察了电压对PS微球分离效率的影响。对以上所述3组分离实验,选取了7~14 Vp-p系列电压进行研究。实验表明,PS微球的分离效率会随电压的增大而增大。这是因为电压增大,ACEF、DEP和EP均会增大(FACEF~E4, FDEP~E2, FEP~E),合力也变大,其作用范围就会扩大,距离中心电极较远的25 μm微球被运送到中心电极附近的数量增多。聚集到中心电极上的微球越多,分离效率越高。由3.2节可知,微球的运动速度体现了其所受到的合力大小,进而可说明微球的分离效率大小。由图4可见,10和25 μm微球分离的最佳电压值是14 V;而电压超过14 V后,10 μm微球会移向电极,不能实现分离。这是因为随着电压增大,ACEF作用范围也增大,3.1节提及的层流区域减小甚至消失,10 μm微球同样会被ACEF夹带到电极附近,导致10 μm微球的平衡位置发生变化而不能实现分离。同样的分析也适用于5 μm微球。实验表明,5和25 μm微球分离的最佳电压值是10 V;5、10和25 μm微球混合分离的最佳电压值是11 V。而3种微球分离所受电压稍高于两种微球的情况,则可认为是3种微球相互作用的结果。以上结果表明,电压是影响分离的又一重要因素。虽然电压越大,微球的分离效率越高,但存在最高电压极限,超过极限电压值,尺寸较小的微球所受平衡力的位置会发生变化,反而影响分离效果。综上可知,不同尺寸微球分离是多种动电力协同作用的结果。
4 结 论
在流体静态条件下,采用混合动电技术,在微流控芯片上实现了多种不同尺寸PS微球在高电导率溶液中的分离,探讨了微球定向运动的动电学原理。微球分离现象是DEP, EP和ACEF等动电力协同作用的结果。微球尺寸、频率和电压是影响不同尺寸微球分离的重要因素。尤其发现了在一定电场条件下,两个相邻电极的中间位置存在一个层流区域,这个区域是ACEF作用较小甚至作用不到的区域,其中的流体相对静止。因而尺寸较小的微球(<10 μm)可以停留在此而不易被ACEF夹带出去;而尺寸较大的微球(25 μm)由于超出此区域边界,易于被ACEF夹带出去, 向电极方向移动,从而实现不同尺寸的微球的分离,为实际样品的研究提供了理论基础。
References
1 Wong P K, Wang T H, Deval J H, Ho C M. Ieee-asme T. Mech., 2004, 9(2): 366-376
2 Sin M L Y, Shimabukuro Y, Wong P K. Nanotechnology, 2009, 20(16): 165701
3 Li D Q. Electrokinetics in microfluidics, Academic Press, 2004, Chapter 8
4 Hardt S, Schnfeld F. Microfluidic Technologies for Miniaturized Analysis Systems. Springer, 2007: 315-317
5 Sin M L Y, Gau V, Liao J C, Haake D A, Wong P K. J. Phys. Chem. C., 2009, 113: 6561-6565
6 Hardt S, Schnfeld F. Microfluidic Technologies for Miniaturized Analysis Systems. Springer, 2007: 393-395
7 Gao J, Yin X F, Fang Z L. Lab Chip, 2004, 4: 47-52
8 Sun Y, Lim C S, Liu A Q, Ayi T C, Yap P H. Sens. Actuators A, 2007, 133(2): 340-348
9 Takamura Y, Onoda H, Inokuchi H, Adachi S, Oki A, Horiike Y. Electrophoresis, 2003, 24: 185-192
10 Feldman H C, Sigurdson M, Meinhart C D. Lab Chip, 2007, 7: 1553-1559
11 Mandy L Y S, Vincent G, Joseph C L, Pak Kin W. J. Assoc. Lab. Autom., 2010, 15: 426-432
12 Li Y, Dalton C, Crabtree H J, Nilsson G, Kaleret K V I S. Lab Chip, 2007, 7(2): 239-248
13 Doh I, Cho Y H. Sens. Actuators A: Phys., 2005, 121(1): 59-65
14 Cheung K,Gawad S, Renaud P. Cytometry Part A, 2005, 65A(2): 124-132
15 Krishnan R, Sullivan B D, Mifflin R L,Esener S C, Heller M J. Electrophoresis, 2008, 29(9): 1765-1774
16 Lin R Z, Ho C T, Liu C H, Chang H Y. Biotechnol. J., 2006, 1(9): 949-957
17 XU Jing, ZHAO Zhan, FANG Zhen, LIU Yong-Hong, DU Li-Dong, GENG Dao-Qu. Chinese J. Anal. Chem., 2011, 39(3): 295-299
许 静,赵 湛,方 震,刘泳宏,杜利东,耿道渠. 分析化学,2011, 39(3): 295-299
18 Gao J, Sin M L Y, Liu T,Gau V, Liao J C, Wong P K. Lab Chip, 2011, 11(10): 1770-1775
19 Gao J, Riahi R, Sin M L Y, Zhang S, Wong P K. Analyst, 2012, 137(22): 5215-5221
20 Gonzalez A, Ramos A, Morgan H, Green N G, Castellanos A. J. Fluid Mech., 2006, 564: 415-433
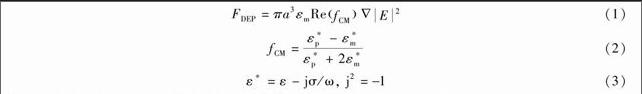


摘 要 采用三层夹心式、三平行微电极设计制作了聚二甲基硅氧烷 (Polydimethylsiloxane,PDMS)/玻璃微流控芯片,通过交流电对在微流控芯片中的高电导率溶液施加电场,达到不同尺寸聚苯乙烯(Polystyrene, PS)微球分离的目的;探讨了微球定向运动的动电学原理。结果表明,在电压为14 V,频率为100 kHz时,直径为10和25 μm的PS微球分离效率最好;在电压为10 V,频率为2 MHz时,直径为5和25 μm的PS微球分离效率最好;对于直径分别为5、10和25 μm的3种PS微球分离,在电压为11 V,频率为1 MHz时,可以达到大球和另外两种尺寸较小微球的快速有效分离, 分离效率均可达90%以上。结果表明,相邻电极中间位置层流区域的形成,对微球分离起到关键作用。
关键词 微流控芯片; 动电技术; 高电导率; 聚苯乙烯微球
1 引 言
交流电场通过微电极作用在微流体或带电微粒子上,使它们产生多种动电特性【1~3】,除介电泳(Dielectrophoresis, DEP)【4,5】外,还包括电泳(Electrophoresis, EP)【6,7】、电渗(Electroosmosis, EO)【8,9】、电热流(AC electrothermal flow, ACEF)【10,11】等。动电作用是操纵微尺度目标的最有效的方法之一,前人对动电力操控微纳尺度生物目标的研究主要集中在低电导率溶液中的介电泳力【12~14】。然而大多数生理体液的电导率较高(~1 S/m),常需要对样品进行预处理,调节电导率至较低水平(~0.01 S/m)。这样做有可能造成目标细胞的损失或稀释,降低检测灵敏度;同时也难以发挥其它动电作用的特点,限制了方法的使用范围。在高电导率介质中研究多种动电力对不同尺寸微目标的作用规律,对于最终实现实际生物样品的高效动电操纵具有重要意义。由介电泳受力方程可知【2,15】:
其中,a为粒子半径,εm为流体介质的介电常数,Re(fCM) 为CM因子的实部,E为电场强度,εp为粒子的介电常数,σ为电导率,ω为电场频率。
Re(fCM)是决定DEP力大小的因素之一,它表示在不同频率的电场下粒子和悬浮溶液的介电特性。当Re(fCM)>0时,微粒的极化作用大于溶液极化作用,从而使微粒聚集在电场的极大值处(靠近电极区域),这样的现象称为正介电泳现象;反之,为负介电泳现象【16,17】。由方程(2)和(3)可知,当溶液电导率>100 mS/m时,Re(fCM)为负值【15】,因此,高电导率介质中主要表现为负介电泳。此外,研究发现,在高电导率溶液中,多种动电力同时存在且共同发挥作用。一般认为,ACEF是一种远程作用力,可夹带离电极较远处的微粒;而EP、DEP是近程作用力,对于电极附近的微粒作用比较强【18,19】。理论上,上述动电特性在不同溶液中以及对不同种类微粒的作用效果都有差异【3】。利用这些差异,可实现对不同尺寸微目标的有效分离和捕获。
目前,还未见针对高电导率溶液中分离不同尺寸微粒的系统研究。由于单分散聚苯乙烯(Polystyrene, PS)微球的密度以及多种尺寸规格均与细胞接近,可作为不同种类、不同大小的细胞替代物或模拟物。本研究采用多种尺寸的单分散PS微球为研究对象,在流体静态条件下系统研究了DEP、EP与ACEF相结合的混合动电技术分离多尺寸微球的电场条件和动电学原理,为实际样品的分离捕获提供理论基础。实验在高电导率条件下进行,常用的Au-Cr微电极难以适应高电导率环境,在实验条件下容易被电解脱落,使用改进的 Ti-Au-Ti 三层夹心式微电极【18,19】,能够在高电导率溶液中以及实验条件下(<20 V, AC)长期稳定工作。聚二甲基硅氧烷 (Polydimethylsiloxane,PDMS)基的微流控芯片则具有制备方便\,牢固耐用等优点。将PS微球均匀分散在10×TAE缓冲溶液 (~1.59 S/m)中,以PDMS/玻璃微流控芯片为操作平台,利用混合动电作用实现不同尺寸PS微球的分离。
2 实验部分
2.1 仪器与试剂
XD-101倒置显微镜(南京江南永新光学有限公司);EC300 CCD(济南强胜光电仪器有限公司);SDG1020函数波形发生器(深圳鼎阳科技有限公司);PDC-32G等离子清洗仪(美国 Harrick Plasma公司)。单分散PS微球(5、10和25 μm, Micromod, GER);TAE缓冲溶液(美国Sigma公司)。
2.2 微流控芯片的制备
利用平版印刷术和电子束物理气相沉积法(EB-PVD)在载玻片上制备了三层夹心式(Ti-Au-Ti)微电极。其尺寸为:电极长度2.5 mm,上下电极宽度100 μm,中心电极宽度50 μm,Ti-Au-Ti层均为30 nm,相邻电极间隙宽度为125 μm。将制备好微通道(宽度为500 μm)的PDMS 基片与沉积好微电极的玻璃基片表面进行等离子清洗,然后迅速粘合,即制成PDMS/玻璃微流控芯片(图1a)。
3 结果与讨论
3.1 芯片上的微球分离
如前所述,高电导率溶液中Re(fCM)<0,各尺寸微球均受到负介电泳力作用,被推向场强较弱的区域;电热流则会导致流体在电极上方做环状流动【20】;实验还发现,施加一定的直流偏压后,微球的移动速度增大,这说明混合动电中存在EP,且EP可以增强混合动电的作用效果。因此,ACEF、DEP和EP同时存在且共同发挥作用。施加电场后,在电极附近的5和10 μm微球被ACEF、DEP和EP共同推至远离电极区域。由图1b可见,相邻的一对平行电极上方均有ACEF作用引起的流体流动,且方向相反;而在相邻电极的中间位置则存在一个ACEF相对较弱甚至无作用的层流区域(一定电压范围内,图1b中虚线框所示)。5和10 μm微球进入该区域后,因尺寸较小,易停留在该区域内,无法被ACEF夹带出去,同时它们也会受到来自另一方电极的ACEF、DEP和EP的作用,3种动电力协同作用使它们在电极间隙中心线区域达到受力平衡而聚集在该区域(图2c和2f)。相同条件下,在电极附近的25 μm微球也受ACEF、DEP和EP共同作用被推离电极。但因其尺寸较大,不易停留在层流区域内,在离电极较远处的25 μm微球被远程作用力ACEF夹带逐渐向中心电极靠近。当微球进入到近程作用力DEP、EP主要作用区域后,因受到DEP, EP的推离电极的力逐渐增强,微球速度逐渐减慢,最终DEP, EP与ACEF达到力平衡,将25 μm微球捕获在中心电极的中心线上(图2c和2f,因电极遮挡故不可见)。对预先混合的10和25 μm微球进行分离, 图2a~2c显示,在施加电场15 s后,基本可以实现两种微球的分离。同样,通过对预先混合的5、10和25 μm的3种微球进行分离实验可以得到类似的结果(图2d~2f),仅需18 s左右即可达到分离。从图2可见,除个别25 μm微球沉底贴壁无法移动外,绝大多数微球均可定向移动,多次实验统计结果得出分离效率大于90%。图2 (a~c) 10和25 μm PS微球随时间变化运动图像。施加的电压是14 Vp-p,频率100 kHz,直流偏压为0.3 V DC;(d~f) 5, 10 和 25 μm PS微球随时间变化运动图像。施加的电压是11 Vp-p,频率1 MHz,直流偏压为1.0 V DC
Fig.2 (a-c) Time lapse images for visualizing the movement of 10 and 25 μm polystyrene microspheres. The applied voltage was 14 Vp-p at 100 kHz with 0.3 V DC offset; (d-f) Time lapse images for visualizing the movement of 5, 10 and 25 μm polystyrene microspheres. The applied voltage was 11 Vp-p at 1 MHz with 1.0 V DC offset
由于实验所讨论的3种动电力的大小均与微球尺寸有关(FDEP~a3, FACEF~1/a3, FEP~a),因此,多种动电协同操纵微球时,其尺寸差异是影响分离的重要因素。
3.2 频率的影响
考察了频率100 kHz~10 MHz对PS微球定向操控的影响。由方程(1)可知,频率直接影响微球受到的DEP力的大小。同样,频率也影响ACEF 的大小(FACEF~M(ω,T)), 在不同频率条件下微球受到的ACEF、DEP和EP的总的合力不同,合力越大,微球的速度就越大。因此,频率对微球的影响可以通过微球的运动速度来体现。对于10和25 μm微球的分离,以25 μm微球为例,对不同频率下的微球进行分析,由图3a可知,不同位置微球速度随频率的变化趋势是相同的;而对于同一位置的微球而言,在频率为100 kHz时速度最大, 即此时25 μm微球受到的合力最大。频率为100 kHz时,通道各处的25 μm微球运动到中间电极中心线附近的时间均相对最短,同样的分析也适用于溶液中的10 μm微球。
实验还观察到,微球运动速度过小,会导致距离中心电极较远的25 μm 微球在没有到达中心电极之前就达到受力平衡,停止在电极间隙部位,降低了分离效率。微球运动速度越大,即所受合力越大,距离中心电极较远的25 μm微球被捕获到中心电极上的越多,分离效率越高。以上结果说明,100 kHz是实现快速有效分离的最优条件。
图3b表明,频率为2 MHz时,5和25 μm微球分离效率最高;5, 10和25 μm微球在1 MHz时分离效率最高。以上结果表明,频率是不同尺寸微球分离的另一个重要因素。
3.3 电压的影响
考察了电压对PS微球分离效率的影响。对以上所述3组分离实验,选取了7~14 Vp-p系列电压进行研究。实验表明,PS微球的分离效率会随电压的增大而增大。这是因为电压增大,ACEF、DEP和EP均会增大(FACEF~E4, FDEP~E2, FEP~E),合力也变大,其作用范围就会扩大,距离中心电极较远的25 μm微球被运送到中心电极附近的数量增多。聚集到中心电极上的微球越多,分离效率越高。由3.2节可知,微球的运动速度体现了其所受到的合力大小,进而可说明微球的分离效率大小。由图4可见,10和25 μm微球分离的最佳电压值是14 V;而电压超过14 V后,10 μm微球会移向电极,不能实现分离。这是因为随着电压增大,ACEF作用范围也增大,3.1节提及的层流区域减小甚至消失,10 μm微球同样会被ACEF夹带到电极附近,导致10 μm微球的平衡位置发生变化而不能实现分离。同样的分析也适用于5 μm微球。实验表明,5和25 μm微球分离的最佳电压值是10 V;5、10和25 μm微球混合分离的最佳电压值是11 V。而3种微球分离所受电压稍高于两种微球的情况,则可认为是3种微球相互作用的结果。以上结果表明,电压是影响分离的又一重要因素。虽然电压越大,微球的分离效率越高,但存在最高电压极限,超过极限电压值,尺寸较小的微球所受平衡力的位置会发生变化,反而影响分离效果。综上可知,不同尺寸微球分离是多种动电力协同作用的结果。
4 结 论
在流体静态条件下,采用混合动电技术,在微流控芯片上实现了多种不同尺寸PS微球在高电导率溶液中的分离,探讨了微球定向运动的动电学原理。微球分离现象是DEP, EP和ACEF等动电力协同作用的结果。微球尺寸、频率和电压是影响不同尺寸微球分离的重要因素。尤其发现了在一定电场条件下,两个相邻电极的中间位置存在一个层流区域,这个区域是ACEF作用较小甚至作用不到的区域,其中的流体相对静止。因而尺寸较小的微球(<10 μm)可以停留在此而不易被ACEF夹带出去;而尺寸较大的微球(25 μm)由于超出此区域边界,易于被ACEF夹带出去, 向电极方向移动,从而实现不同尺寸的微球的分离,为实际样品的研究提供了理论基础。
References
1 Wong P K, Wang T H, Deval J H, Ho C M. Ieee-asme T. Mech., 2004, 9(2): 366-376
2 Sin M L Y, Shimabukuro Y, Wong P K. Nanotechnology, 2009, 20(16): 165701
3 Li D Q. Electrokinetics in microfluidics, Academic Press, 2004, Chapter 8
4 Hardt S, Schnfeld F. Microfluidic Technologies for Miniaturized Analysis Systems. Springer, 2007: 315-317
5 Sin M L Y, Gau V, Liao J C, Haake D A, Wong P K. J. Phys. Chem. C., 2009, 113: 6561-6565
6 Hardt S, Schnfeld F. Microfluidic Technologies for Miniaturized Analysis Systems. Springer, 2007: 393-395
7 Gao J, Yin X F, Fang Z L. Lab Chip, 2004, 4: 47-52
8 Sun Y, Lim C S, Liu A Q, Ayi T C, Yap P H. Sens. Actuators A, 2007, 133(2): 340-348
9 Takamura Y, Onoda H, Inokuchi H, Adachi S, Oki A, Horiike Y. Electrophoresis, 2003, 24: 185-192
10 Feldman H C, Sigurdson M, Meinhart C D. Lab Chip, 2007, 7: 1553-1559
11 Mandy L Y S, Vincent G, Joseph C L, Pak Kin W. J. Assoc. Lab. Autom., 2010, 15: 426-432
12 Li Y, Dalton C, Crabtree H J, Nilsson G, Kaleret K V I S. Lab Chip, 2007, 7(2): 239-248
13 Doh I, Cho Y H. Sens. Actuators A: Phys., 2005, 121(1): 59-65
14 Cheung K,Gawad S, Renaud P. Cytometry Part A, 2005, 65A(2): 124-132
15 Krishnan R, Sullivan B D, Mifflin R L,Esener S C, Heller M J. Electrophoresis, 2008, 29(9): 1765-1774
16 Lin R Z, Ho C T, Liu C H, Chang H Y. Biotechnol. J., 2006, 1(9): 949-957
17 XU Jing, ZHAO Zhan, FANG Zhen, LIU Yong-Hong, DU Li-Dong, GENG Dao-Qu. Chinese J. Anal. Chem., 2011, 39(3): 295-299
许 静,赵 湛,方 震,刘泳宏,杜利东,耿道渠. 分析化学,2011, 39(3): 295-299
18 Gao J, Sin M L Y, Liu T,Gau V, Liao J C, Wong P K. Lab Chip, 2011, 11(10): 1770-1775
19 Gao J, Riahi R, Sin M L Y, Zhang S, Wong P K. Analyst, 2012, 137(22): 5215-5221
20 Gonzalez A, Ramos A, Morgan H, Green N G, Castellanos A. J. Fluid Mech., 2006, 564: 415-433

