大叶藻种子萌发与幼苗培育、种植方法的初步研究
张海鹏等
海草(Seagrasses)是生活于热带和温带海域浅水中的单子叶植物。目前全世界共发现有海草约 12 属 67 种,在中国共分布有 5 科 11 属 21 种海草[1]。大叶藻(Zostera marina L.)作为海草的一个典型代表,生于潮间带和潮下带的浅海中,通常形成广大的群落—海草床。
海草能完全生长于沉水环境,有很发达的根状茎,有稳定沉积物、稳定底泥、抵御风浪对近岸底质的侵蚀作用,同时海草的叶片可以捕捉悬浮物,改善水体透明度;海草是第一生产者,通过光合作用,吸收和同化营养物质,净化水质,加速生态系中的营养循环;海草床是高生产力区,是许多海洋动物重要的产卵场、栖息地、隐蔽场所,并是其直接食物来源。海草床巨大的生产力可与红树林相媲美,具有极大的固碳能力,与红树林和珊瑚礁被称为三大典型海洋生态系统。
海草种子一般都经历一个休眠期,既有生理、形态休眠又有物理休眠,在外界条件适宜时,种子才开始萌发。本研究旨在探寻切实可行的大规模海草苗种培育方式和栽培方法,本着遵循其自然生理规律原则,尽量模拟自然海域萌发环境开展本实验。所以本实验所选择种子均为已经历其生理形态休眠的自然过程,镜检已可透过种壳见到胚芽的种子为实验对象,选择对其打破休眠有关键作用且人为可控的温度、盐度及幼苗发育基质为实验处理条件。
1 材料与方法
1.1 实验用种子
实验用种子于2014 年6月采集于河北唐山海域。野外采集大叶藻种子时,只剪下带有成熟种子的生殖枝,运输时置于保温箱中并加冰。在实验室放于2 m3的玻璃钢水槽中暂养,使种子自然脱落,每天换水一次,将散落种子收集于另外水槽中。开始实验时,挑选成熟饱满的种子,先用 75%的酒精溶液浸泡 30 s,无菌海水冲洗3次。
由于自然海区采集的大叶藻种子其成熟程度差别很大,作为实验对象的种子均需经过镜检确认其成熟情况,使其相对同步,减少实验误差。
1.2 实验方法
1.2.1 盐度处理 共设定4个不同盐度的处理,各挑选 100粒消毒后种子,放入200 mL 烧杯中置于试验室,自然光照和水温,进行萌发实验。每天观察种子的萌发状况,统计萌发粒数,以胚根伸出种皮作为种子萌发的标志。每天换水 1 次,实验共进行10 d。
盐度处理分别是淡水(0‰)、海淡混合水(14‰)、海水(28‰)、卤水(40‰),以海水处理为对照组(CK)。
1.2.2 温度处理 设定3个不同温度处理,各挑选 100粒消毒后种子,放入200 mL 烧杯中,每天换水 1 次,进行萌发实验。每天观察种子的萌发状况,统计萌发粒数,以胚根伸出种皮作为种子萌发的标志。以自然水温和光照处理为对照组(CK)。
温度处理分别为:恒温培育箱中设定温度25 ℃,光照;恒温培育箱中设定温度6 ℃,光照;繁育车间内自然水温和光照。
1.2.3 幼苗培育基质 实验设4个处理:以可降解的天然材料黄麻网绳为夹苗绳,两端坠以沉子,放于实验水槽;以陶粒为基质物,与种子均匀混合后,放于实验水槽;以海沙为基质物,与种子均匀混合后,放于实验水槽;以黄泥为基质物,与种子均匀混合后,放于实验水槽。
每个处理均选用500粒成熟种子,为防止种子与基质物换水时堆积和流散,将其放入用可降解的天然材料黄麻网布做成的网袋中进行实验。培养期间,每天观察幼苗的存活和生长情况,每天换水 1 次,培养实验共70 d。培养结束后,计算种子成活率。
2 数据处理及分析
(1)萌发率(%)= 萌发的种子数/种子总数×100%;
(2)成苗率(%)=初始幼苗数/种子总数×100%;
(3)成活率(%)=存活的幼苗数/种子总数×100%;
(4)发芽指数(GI)=∑GtDt,其中,Dt 代表发芽日数;Gt 代表与 Dt 对应天数的萌发粒数。
采用Excel2007 对数据进行统计分析和绘图。对数据进行 ANOVA 分析,以百分数表示的数据先作平方根反正弦转换,然后再应用方差分析,以 P<0.05作为差异显著水平,P<0.01为差异极显著。
3 实验结果
3.1 盐度对大叶藻种子萌发的影响
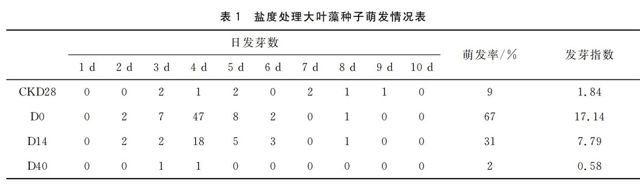
实验结果如表1、图2所示。经10 d快速萌发,对照组(CKD28)种子的萌发率为9%,发芽指数为1.84。
其它低盐处理组均对大叶藻种子的萌发有显著影响(P<0.05),且随着处理盐度降低,种子萌发率和发芽指数逐渐增高。其中淡水处理组(D0)种子萌发率是CK的7.4倍,发芽指数是 CK 的9.31倍;卤水处理组(D40)种子萌发率是CK的0.22倍,发芽指数是CK的0.31倍。
3.2 温度对大叶藻种子萌发的影响
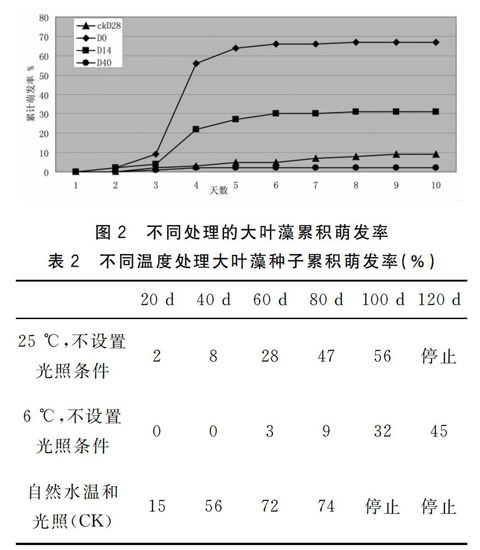
实验结果显示,自然水温和光照条件下的萌发率最高为74%,80 d时整个萌发过程基本结束;恒温25 ℃条件下萌发率为56%,100 d时整个萌发过程基本结束;恒温6 ℃条件下到100 d时萌发率为45%,萌发过程还未结束(见表2)。
3.3 幼苗培育基质
由于本实验为防止种子与基质物换水时堆积和流散,将其放入用可降解的天然材料黄麻网布做成的网袋中进行,所见苗种一定是顶破网布而出的健康苗种。
实验结果显示以陶粒为基质物的处理方法大叶藻种子成活率最高,为36.6%,黄泥不适合大叶藻种子生长(见表3)。
4 讨论
4.1 大叶藻种子的休眠与破除方法
现在的研究普遍认为大叶藻种子存在三种休眠类型,即生理休眠、形态休眠和环境休眠(物理休眠)[2]。生理休眠的种子具有发育完全的胚体,即使外界条件适宜但由于种皮障碍等原因也不能萌发,一般用低温层积处理来破除生理休眠;形态休眠指种子体胚的发育还不完全,种子中还存在萌发抑制物质,其胚体需要生长到一定水平后才能萌发,这类种子应在适宜环境条件下使胚体继续发育完全,抑制物质分解后才能萌发;环境休眠种子的萌发受环境因素的影响,一般用通过刺破种皮或者改变外界环境条件的方法来打破休眠。
目前破除海草种子休眠的方法有低盐处理、低温层积、划破种皮、变温处理、光处理、厌氧处理、激素处理、无机化学药剂处理、有机化学药物处理等多种方法。
4.2 大叶藻种子快速萌发方法的探讨
笔者认为“适宜的环境条件”即为在野外环境下种子萌发时的实际环境条件。本研究旨在探寻切实可行的大规模海草苗种培育方式和栽培方法,本着遵循其自然生理规律,尽量模拟自然海域萌发时的环境条件。根据我们的调查研究,唐山海域大叶藻草场离岸很近,受河水影响大,种子在自然环境下一般是在6月中旬开始成熟脱落,休眠70 d左右,于8月中下旬开始萌发。此时野外环境应该是水温开始下降、雨水较多、变温变光条件。大叶藻种子的发育很不同步,即使同一生殖枝的不同分枝上的种子的成熟度也差别很大。
4.2.1 低温层积 大叶藻种子休眠期短,应该是为了躲过夏季高温,而现有的低温层积时间较长(>90 d)无实际意义,可考虑短期的高温层积、高温处理。
4.2.2 药物处理 我们研究发现大叶藻种子同时存在形态休眠和生理休眠,二者同时进行,只有当胚体发育到一定程度且生理休眠解除后才能萌发,而且在种子休眠期间,外表有坚硬的种皮包裹保护,透水性极差,所以药物处理只能在休眠后期进行才能有效果,对种子的快速萌发效果影响不明显。
4.2.3 划破种皮 我们也做了划破种皮的实验,其结果显示划破种皮确实能使种子快速萌发,但幼苗成活率很低。划破种皮的方法操作复杂,且有可能划伤胚体,不适合大规模苗种培育。
4.2.4 水温、光照 我们试验2的结果显示在自然环境变温、变光的条件下大叶藻种子的萌发时间最短,且萌发率最高。
4.2.5 盐度 大叶藻种子在经过形态和生理休眠后,种皮也逐渐薄,透水性大大加强,此时对外界条件的变化比较敏感。当外界盐度下降时,由于渗透压的作用,种子加速吸水过程,可提高萌发速度。实验1结果显示在盐度为0的纯淡水环境下,大叶藻种子的萌发率最高,但在以后的培养中幼苗陆续死亡。低盐处理确实能使种子快速萌发,但其成活率也随之降低。
综上所述,如果进行大规模大叶藻种子快速萌发工作,首先种子在采集后先在育苗车间进行暂养(自然水温、盐度),使其完成形态休眠和生理休眠。暂养约一个月后,挑选镜检已可透过种壳见到胚芽的种子准备低盐处理来打破环境休眠使种子萌发。低盐处理选择盐度15‰左右,处理前种子用 75%的酒精溶液浸泡 30 s,无菌海水冲洗。在其萌发以后,逐步过渡至自然海水盐度,整个期间可不专门设置温度、光照条件。
4.3 大叶藻苗种培育、种植方法的探讨
在自然环境下,大叶藻主要以无性繁殖为主,种子的萌发率很低,不高于10%。利用自然海区采集的种子人工进行修复的方法,有操作成本低、不破坏原有海草场、保持遗传多样性、局部快速形成海草床,成为海草床修复技术的发展方向。
大叶藻种子萌发以后,其苗种的生长与底质环境和水环境有密切关系。自然海域的大叶藻场底质为泥沙性质。
实验3结果显示,模仿淡水观赏水草种植以陶粒为基质的大叶藻苗种成活率最高。这是由于陶粒间隙比较大,具备有良好的透水性及通气性,适于水草种子芽枝的抽出和伸展。反之,以黄泥为基质的效果却不好,不利于苗种培育。
如果在培育基质中添加基肥,或苗种培育期间加入适当液肥,效果应该会更好,这需要做进一步研究和实验。
虽然以陶粒为基质有利于大叶藻苗种生长,但由于比较松散,不利于大叶藻根系生长盘结成片,在自然海域潮汐和风浪作用下很容易堆积或冲散。为解决这个难题,可以将种子及基质均匀混合后放入用可降解的天然材料特制成的底铺层中,再进行培育或直接投放在自然海域。此方法在自然海域测试的效果很好,无需水下作业,又可卷起打包方便运输,节省人力物力消耗,简便易行适于大规模操作。
参考文献:
[1]范航清,石雅军,邱广龙.中国海草植物[M].北京:海洋出版社,2009
[2] Harrison PG. Mechanisms of seed dormancy in an annual population of Zostera marina (eelgrass) from the Netherlands. Canadian Journal of Botany, 1991, 69(9): 1972-1976
(收稿日期:2015-01-29;修回日期:2015-02-02)

