超高效合相色谱—质谱法快速检测工业油酸中5种常见的脂肪酸
林春花+范乃立+芮培欣+夏剑辉+廖维林+杨绍明
摘 要 采用超高效合相色谱-质谱(UPC2-MS)技术,建立了工业油酸中5种常见的脂肪酸(软脂酸、硬脂酸、油酸、亚油酸和亚麻酸)的快速检测方法。样品用正己烷溶解,采用超临界CO2-甲醇/乙腈(1∶1, V/V)梯度洗脱,经Acquity UPC2BEH 2-EP色谱柱(100 mm × 2.1 mm,1.7 μm)分离,通过质谱检测器在负离子电喷雾模式下对目标化合物进行分析,外标法定量。通过对UPC2-MS条件的优化,5种脂肪酸在3 min内实现有效分离,目标物在0.5~100 mg/L 范围内具有良好的线性(相关系数大于0.9985); ?在3个添加水平下,5种脂肪酸的回收率在89.3%~106.7%之间,相对标准偏差为0.8%~3.0%; 方法检出限(S/N≥3)为0.07~0.26 mg/L。实际样品分析结果表明,本方法不但简单快速,分离效果好,而且无需对脂肪酸样品进行衍生化,同时为UPC2在油脂类相关领域的研究与开发提供一种快速有效的检测方法。
关键词 超高效合相色谱-质谱法; 工业油酸; 未衍生化; 脂肪酸
1 引 言
工业油酸是一种重要的化工中间体,可用于生产脂肪酸甲酯、生物柴油等,市场需求较大[1]。它是以植物油脂、皂脚为原料,通过水解、精馏而得到的一种混合脂肪酸,主要含有5种脂肪酸,其中以油酸(C18∶1)、亚油酸(C18∶2)为主,还含有少量的软脂酸(C16∶0)、硬脂酸(C18∶0)和亚麻酸(C18∶3)等[2]。原料和生产方法的差异会造成工业油酸中5种脂肪酸含量的不同[2],而脂肪酸的不同比例将造成工业油酸的品类不同,因此建立快速、准确地检测这5种脂肪酸含量的方法是区分工业油酸品类的必然选择。
目前,对于脂肪酸的检测方法主要是气相色谱法[3~9]和液相色谱法[10,11]等,这些方法一般都要对样品进行脂肪酸衍生化的前处理[12]。近年来,也出现了采用超临界流体色谱法[13,14]、超高效液相色谱-蒸发光散射检测法[15]和快速气相色谱法[16,17]直接分析未衍生化脂肪酸的文献报道。但是,这些方法都有各自的不足之处。如衍生化不仅操作繁琐耗时,而且衍生化反应是否完全等因素直接影响产物的准确测定; 蒸发光散射检测器会降低分析的灵敏度,低浓度样品的分析受到一定的限制[7]; 气相色谱直接分析脂肪酸样品时,多次进样后高沸点物质的残留会大大降低色谱柱的使用寿命等; 超临界流体色谱法分析油脂类样品虽能得到更好的分离结果[18],但由于其对仪器的硬件要求非常高,使得该技术在很长的时间内没有得到长足的发展。
超高效合相色谱(Ultra-performance convergence chromatography, UPC2)技术是Waters公司于2012年8月新推出的一种分离技术[19,20]。该技术基于超临界流体色谱技术原理,其流动相以超临界CO2为主要组成,辅助少量的有机溶剂,具有粘度低、分子扩散快、分离效率高、绿色环保的优势。本研究利用超高效合相色谱-质谱技术建立了上述5种结构类似的脂肪酸的简便、快速检测方法,为工业油酸中5种重要的脂肪酸的快速分析以及UPC2技术的推广应用提供参考。
2 实验部分
2.1 仪器与试剂
Acquity UPC2系统(美国Waters 公司), 配Waters SQD 2 质谱检测器。Acquity UPC2BEH 2-EP 色谱柱(100 mm × 2.1 mm, 1.7 μm)、Acquity UPC2BEH 色谱柱(100 mm ×3 mm, 1.7 μm)、Acquity UPC2HSS C18 SB 色谱柱(100 mm × 2.1 mm, 1.8 μm)和Acquity UPC2CSHTM Fluoro-Phenyl Column 色谱柱(100 mm × 3 mm, 1.7 μm, 美国Waters公司)。TOLEDO AL204型电子天平(瑞士METTLER 公司)。PURELAB Ultra MK 2型超纯水仪(英国ELGA 公司)。可调式移液器(上海大龙公司)。
5种脂肪酸标准品:软脂酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)和亚麻酸(C18∶3)均购自Sigma Aldrich公司(纯度大于99%); 正己烷、甲醇和乙腈(色谱纯,德国Merck公司); 甲酸铵和醋酸铵(色谱纯,美国Agilent公司)。实验用水为超纯水。工业油酸(棉籽油酸、大豆油酸和菜籽油酸)均来源于湖北天门市诚鑫化工有限公司。
2.2 实验条件
2.2.1 色谱条件 ?采用 Acquity UPC2BEH 2-EP色谱柱; 系统背压为13.78 MPa; 色谱柱温度为
2.3 混合标准溶液的配制
分别准确称取0.05 g(精确至0.001 g)各种脂肪酸标样,用正己烷溶解并分别定容至50 mL,制备成1 g/L的单一标准品储备液; 再用正己烷制备成浓度为100 mg/L混合标准溶液,并稀释成系列标准工作溶液。
2.4 样品制备
准确称取0.01 g(精确至0.0001 g)工业油酸样品,用正己烷溶解并定容至10 mL,再稀释至100 mg/L,经有机膜过滤后直接进行UPC2系统分析。
3 结果与讨论
3.1 色谱柱的选择
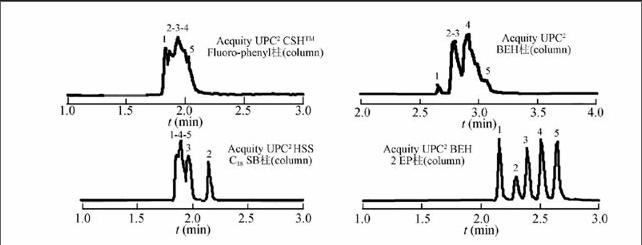
本实验测定的5种脂肪酸,具有结构类似、难于分离的特点; 另外,UPC2系统所使用的亚2 μm色谱柱涵盖了正相和反相色谱柱类别。本实验考察了4种固定相差异明显的色谱柱,分别为Acquity UPC2BEH,BEH 2-EP, HSS C18 SB以及CSHTM Fluoro-Phenyl。从实验结果(图2)可见,本实验条件下Acquity UPC2BEH 2-EP色谱柱能够更好地实现5种脂肪酸的有效分离。
3.2 流动相中助溶剂的选择
UPC2系统所使用的流动相主要是CO2,并以少量有机溶剂作为助溶剂进行分离; 不同类别的有机溶剂对目标物的分离也会产生一定影响。因本研究是UPC2系统接入MS检测器,因此助溶剂以甲醇和乙腈为主要研究对象。实验考察了3种有机溶剂(甲醇、乙腈、甲醇-乙腈(1∶1, ?V/V))对5种脂肪酸的分离影响。从图3可见,3种溶剂在本方法中对脂肪酸的洗脱能力为:甲醇﹥甲醇-乙腈(1∶1, V/V)﹥乙腈; 3种溶剂的选择性存在差异,其中甲醇-乙腈(1∶1, V/V)和乙腈分离效果相当,但乙腈保留时间相对较长。综合考虑洗脱能力和分离效果,本实验最终采用甲醇-乙腈(1∶1, V/V)为有机溶剂辅助流动相。
3.3 色谱柱温度和系统背压的选择
在UPC2方法开发中,色谱柱温度和系统背压可以作为两个重要的参数进行分离条件的优化。改变色谱柱温度和系统背压,就会显著改变以压缩的CO2为主的流动相的密度和性能,从而改变其洗脱能力和选择性。本实验考察了柱温(40,50和60 ℃)和系统背压(12.41,13.78和14.83 MPa)对分离的影响,从图4可见,随着柱温升高和背压降低,脂肪酸的保留值增加。当柱温为60 ℃时,C16∶0和C18∶3的峰形拖尾,展宽明显,而过高的背压易使UPC2系统压力过大。综合考虑分离效果与分析效率,最终确定柱温为50 ℃,系统背压为13.78 MPa。
3.4 MS中补偿溶剂的选择
在MS方法开发中,不同的补偿溶剂对目标物的离子化效率也会产生一定的影响。实验考察了3组不同的补偿溶剂甲醇(含1%水)、甲醇(含0.1%甲酸铵)、甲醇(含0.1%醋酸铵)和不同的流速(0.1, 0.2和0.3 mL/min)对5种脂肪酸分离的影响。在相同的梯度洗脱条件下,甲醇-1%水作为补偿溶剂,且流速为0.2 mL/min时,目标物离子化效果最好,色谱峰尖锐、对称响应灵敏度高,5种脂肪酸分离效果最好。
3.5 方法评价
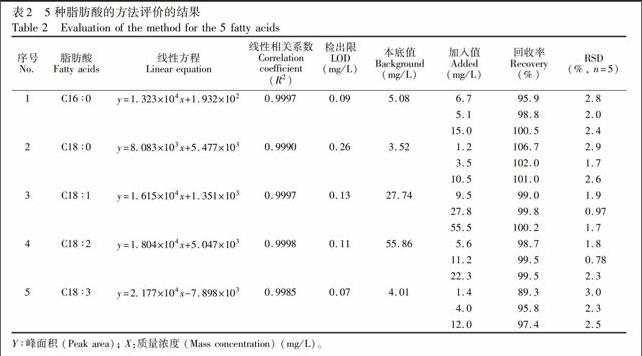
配制0.5, 5, 25, 50和100 mg/L的混合标准溶液,在优化的色谱条件下进行检测,以峰面积(Y)对质量浓度(x, mg/L)进行线性回归,得线性回归方程。向已知含量的工业油酸样品中分别添加5种成分的脂肪酸标准品,设置3个添加水平,每个水平重复测定5次,并计算加标回收率和精密度。按信噪比S/N≥3计算得到分析方法的检出限(LOD)。结果(表2)表明,5种脂肪酸在0.5~100 mg/L内线性关系良好(R2≥0.9985),3个加标水平的回收率为89.3%~106.7%,RSD为0.8%~3.0%,LOD为0.07~0.26 mg/L,可满足实际样品测定的需要。
3.6 实际样品分析
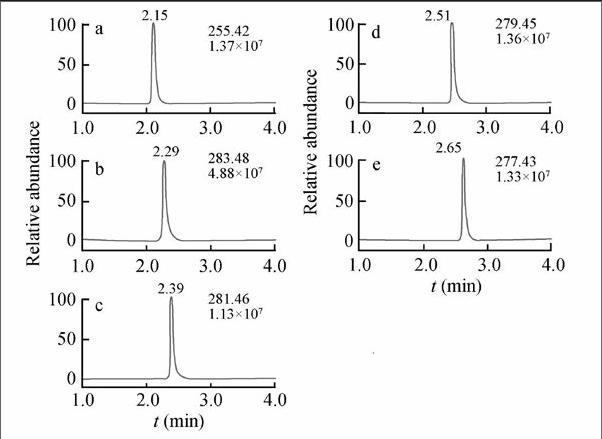
采用本方法对棉籽油酸、大豆油酸和菜籽油酸3种植物油样品进行检测,检测结果(表3)表明,3种工业油酸中5种脂肪酸的含量和比例不同。其中,棉籽油酸和大豆油酸以亚油酸为主,而菜籽油酸则是以油酸为主。但总体而言,以这3种植物油为原料所生产的工业油酸都是以油酸、亚油酸为主,且这两种脂肪酸总含量均大于80%。典型的样品色谱图如图5所示。
通过对色谱柱、色谱柱温度、系统背压和质谱等条件的优化和考察,建立了超高效合相色谱-质谱快速检测工业油酸中5种脂肪酸的分析方法。本方法能在3 min内实现5种脂肪酸的有效分离,采用CO2作主要流动相,实现了高分离度、高灵敏度、高分析速度、低成本的目标。
References
1
WEN Yan-Zhuan. Chemical Engineering & Equipment, 2010, (10): 39-41
温艳转. 化学工程与装备, ?2010(10): 39-41
2 LU Li-Zhu. ?Fine and Specialty Chemicals, 2007, 1(15): 24-28
陆蠡珠. 精细与专用化学品, 2007, 1(15): 24-28
3 HUI Rui-Hua, HOU Dong-Yan, LI Tie-Chun, ZHU Yong-Qiang, LIU Xiao-Yuan. ?Journal of Chinese Mass Spectrometry Society, 2005,26(2): 90-92
回瑞华, 候冬岩, 李铁纯, 朱永强, 刘晓媛. 质谱学报, 2005, 26(2): 90-92
4 WU Hui-Qing, HUANG Xiao-Lan, LIN Xiao-Shan, HUANG Fang, ZHU Zhi-Xin, MA Ye-Fen. ?Chinese J. Anal.Chem., 2007, 35(7): 998-1003
吴惠勤, 黄晓兰, 林晓珊, 黄 芳, 朱志鑫, 马叶芬. 分析化学, 2007, 35(7): 998-1003
5 XU Gui-Zhuan, LIANG Xin, SU Hui, ZHANG Bai-Liang. ?Journal of Anhui Agricultural Sciences, 2008, 36(28): 12090-12091
徐桂转, 梁 新, 苏 惠, 张百良. 安徽农业科学, 2008, 36(28): 12090-12091
6 Ghiaci M, Aghabarari B, Gil A. Gil. Fuel, 2011, 90(11): 3382-3389
7 ZENG Jian-Li, DU Ze-Xue, CHEN Yan-Feng. ?Petroleum Processing and Petrochemicals, 2012, 43(7): 104-110
曾建立, 杜泽学, 陈艳凤. 石油炼制与化工, 2012, 43(7): 104-110
8 LI Bin, QIU Li-Qun, SONG Shao-Fang,GAO Ai-Ying,ZHANG Hao. ?Chinese Journal of Analysis Laboratory, 2014, 33(5): 528-532
李 斌, 裘立群, 宋少芳, 高艾英, 张 昊. 分析试验室, 2014, 33(5): 528-532
9 Lall R K, Proctor A, Jain V P. ?Jain. J. Am. Oil Chem. Soc., 2009, 86: 309-314
10 ZHANG Da-Hua, LI Li-Xia. ?Cereals & Oils, 2007 (12): 41-43
张大华, 李丽霞. 粮食与油脂, 2007(12): 41-43
11 LI Kai-Xin, CHEN Li, YAN Zong-Cheng, WANG Hong-Lin. ?Journal of Instrumental Analysis, 2010, 29(1): 39-42
李凯欣, 陈 砺, 严宗诚, 王红林. 分析测试学报, 2010, 29(1): 39-42
12 SHE Zhu-Hua. ?Grain Processing, 2004(6): 64-66
佘珠花. 粮食加工, 2004(6): 64-66
13 Seorns F J, Ibaez E. ?Anal. Chim. Acta, 2002,465: 131-144
14 Francois I, Sandra P. ?J. Chromatogr. A, 2009, 1216: 4005-4012
15 LI Yi-Zhe, BAO Gui-Rong, WANG Hua. ?Chinese Journal of Chromatography, 2008, 26(4): 494-498
李一哲, 包桂蓉, 王 华. 色谱, 2008, 26(4): 494-498
16 MENG Zhe, WEN Da-Wei, LIAO Yi-Ping, LIU Hu-Wei. ?Chinese Journal of Chromatography, 2007, 25(2): 254-257
孟 哲, 文大为, 廖一平, 刘虎威. 色谱, 2007, 25(2): 254-257
17 Sanches-Silva A, Rodríguez-Bernaldo de Quirós A, López-Hernndez J, Paseiro-Losada P. J. Chromatogr. A, 2004, 1032: 7-15
18 Mossaba M M, Kramer J K G, Brenna J T, McDonald R E. ?Lipid Analysis and Lipidomics——New Techniques and Application, Champaign, Illinois, AOCS Press, 2006
19 XU Yong-Wei, SUN Qing-Long, HUANG Jing, TAN Xiao-Jie. ?Modern Instruments, 2012, 18(5): 45-48
徐永威, 孙庆龙, 黄 静, 谭晓杰. 现代仪器, 2012, 18(5): 45-48
20 LI Zhong-Hao, WU Shuai-Bin, LIU Shan-Shan, FAN Zi-Yan, YANG Fei, BIAN Zhao-Yang, TANG Gang-Ling, CHEN Zai-Gen, HU Qing-Yuan. ?Chinese J. Anal.Chem., 2013, 41(12): 1817-1824
李中皓, 吴帅宾, 刘珊珊, 范子彦, 杨飞, 边照阳, 唐纲岭, 陈再根, 胡清源. 分析化学, 2013, 41(12): 1817-1824
Rapid Detection of Five Common Fatty Acids ?in Industrial Oleic
Acid Based on Ultra Performance Convergence
Chromatography-Mass Spectrometry
LIN Chun-Hua1, FAN Nai-Li1, RUI Pei-Xin1, XIA Jian-Hui*1, LIAO Wei-Lin1, YANG Shao-Ming2
1(National Monosaccharide Chemical Synthesis Engineering Research Center, Nanchang 330027, China)
2(Department of Chemistry and Chemical Engineering, School of Basic Sciences,
East China Jiaotong University, Nanchang 330013, China)
Abstract A rapid method was developed for the determination of 5 common fatty acids, palmitic acid, stearic acid, oleic acid, linoleic acid and linolenic acid in industrial oleic acid based on ultra-performance convergence chromatography-mass spectrometry (UPC-MS). The sample was dissolved by n-hexane, followed by clean-up of extract using 0.22 μm organic phase filter. The fatty acids were separated in 3 min on the column of Acquity UPC2 BEH 2-EP by gradient elution with carbon dioxide and methanol/acetonitrile (1∶1, V/V) system, and finally detected by MS detector in ESI- ?mode. Through the optimization of UPC2-MS condition, the reasonable linearity was achieved for all the analytes over the range of 0.5-100 mg/L with the correlation coefficients (R2) greater than 0.9985. The recoveries for five fatty acids at three spiked levels were in the range from 89.3% to 106.67% with relative standard deviations of 0.8%-3.0%. The limits of detection for target compounds in the method ranged from 0.07 mg/L to 0.26 mg/L. The real sample analysis showed that this method was simple,fast and had a good separation effect. There was no need of derivatization for fatty acid samples. This work would provide a fast and effective detection method for UPC2 technology in oil related research field.
Keywords Ultra performance convergence chromatography-mass spectrometry; Industrial oleic acid; ?Underivatization; fatty acids
(Received 20 August 2014; accepted 15 October 2014)
This article is funded by the National Science and Technology Support Project(NO.2012BAE07B00)



摘 要 采用超高效合相色谱-质谱(UPC2-MS)技术,建立了工业油酸中5种常见的脂肪酸(软脂酸、硬脂酸、油酸、亚油酸和亚麻酸)的快速检测方法。样品用正己烷溶解,采用超临界CO2-甲醇/乙腈(1∶1, V/V)梯度洗脱,经Acquity UPC2BEH 2-EP色谱柱(100 mm × 2.1 mm,1.7 μm)分离,通过质谱检测器在负离子电喷雾模式下对目标化合物进行分析,外标法定量。通过对UPC2-MS条件的优化,5种脂肪酸在3 min内实现有效分离,目标物在0.5~100 mg/L 范围内具有良好的线性(相关系数大于0.9985); ?在3个添加水平下,5种脂肪酸的回收率在89.3%~106.7%之间,相对标准偏差为0.8%~3.0%; 方法检出限(S/N≥3)为0.07~0.26 mg/L。实际样品分析结果表明,本方法不但简单快速,分离效果好,而且无需对脂肪酸样品进行衍生化,同时为UPC2在油脂类相关领域的研究与开发提供一种快速有效的检测方法。
关键词 超高效合相色谱-质谱法; 工业油酸; 未衍生化; 脂肪酸
1 引 言
工业油酸是一种重要的化工中间体,可用于生产脂肪酸甲酯、生物柴油等,市场需求较大[1]。它是以植物油脂、皂脚为原料,通过水解、精馏而得到的一种混合脂肪酸,主要含有5种脂肪酸,其中以油酸(C18∶1)、亚油酸(C18∶2)为主,还含有少量的软脂酸(C16∶0)、硬脂酸(C18∶0)和亚麻酸(C18∶3)等[2]。原料和生产方法的差异会造成工业油酸中5种脂肪酸含量的不同[2],而脂肪酸的不同比例将造成工业油酸的品类不同,因此建立快速、准确地检测这5种脂肪酸含量的方法是区分工业油酸品类的必然选择。
目前,对于脂肪酸的检测方法主要是气相色谱法[3~9]和液相色谱法[10,11]等,这些方法一般都要对样品进行脂肪酸衍生化的前处理[12]。近年来,也出现了采用超临界流体色谱法[13,14]、超高效液相色谱-蒸发光散射检测法[15]和快速气相色谱法[16,17]直接分析未衍生化脂肪酸的文献报道。但是,这些方法都有各自的不足之处。如衍生化不仅操作繁琐耗时,而且衍生化反应是否完全等因素直接影响产物的准确测定; 蒸发光散射检测器会降低分析的灵敏度,低浓度样品的分析受到一定的限制[7]; 气相色谱直接分析脂肪酸样品时,多次进样后高沸点物质的残留会大大降低色谱柱的使用寿命等; 超临界流体色谱法分析油脂类样品虽能得到更好的分离结果[18],但由于其对仪器的硬件要求非常高,使得该技术在很长的时间内没有得到长足的发展。
超高效合相色谱(Ultra-performance convergence chromatography, UPC2)技术是Waters公司于2012年8月新推出的一种分离技术[19,20]。该技术基于超临界流体色谱技术原理,其流动相以超临界CO2为主要组成,辅助少量的有机溶剂,具有粘度低、分子扩散快、分离效率高、绿色环保的优势。本研究利用超高效合相色谱-质谱技术建立了上述5种结构类似的脂肪酸的简便、快速检测方法,为工业油酸中5种重要的脂肪酸的快速分析以及UPC2技术的推广应用提供参考。
2 实验部分
2.1 仪器与试剂
Acquity UPC2系统(美国Waters 公司), 配Waters SQD 2 质谱检测器。Acquity UPC2BEH 2-EP 色谱柱(100 mm × 2.1 mm, 1.7 μm)、Acquity UPC2BEH 色谱柱(100 mm ×3 mm, 1.7 μm)、Acquity UPC2HSS C18 SB 色谱柱(100 mm × 2.1 mm, 1.8 μm)和Acquity UPC2CSHTM Fluoro-Phenyl Column 色谱柱(100 mm × 3 mm, 1.7 μm, 美国Waters公司)。TOLEDO AL204型电子天平(瑞士METTLER 公司)。PURELAB Ultra MK 2型超纯水仪(英国ELGA 公司)。可调式移液器(上海大龙公司)。
5种脂肪酸标准品:软脂酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亚油酸(C18∶2)和亚麻酸(C18∶3)均购自Sigma Aldrich公司(纯度大于99%); 正己烷、甲醇和乙腈(色谱纯,德国Merck公司); 甲酸铵和醋酸铵(色谱纯,美国Agilent公司)。实验用水为超纯水。工业油酸(棉籽油酸、大豆油酸和菜籽油酸)均来源于湖北天门市诚鑫化工有限公司。
2.2 实验条件
2.2.1 色谱条件 ?采用 Acquity UPC2BEH 2-EP色谱柱; 系统背压为13.78 MPa; 色谱柱温度为
2.3 混合标准溶液的配制
分别准确称取0.05 g(精确至0.001 g)各种脂肪酸标样,用正己烷溶解并分别定容至50 mL,制备成1 g/L的单一标准品储备液; 再用正己烷制备成浓度为100 mg/L混合标准溶液,并稀释成系列标准工作溶液。
2.4 样品制备
准确称取0.01 g(精确至0.0001 g)工业油酸样品,用正己烷溶解并定容至10 mL,再稀释至100 mg/L,经有机膜过滤后直接进行UPC2系统分析。
3 结果与讨论
3.1 色谱柱的选择
本实验测定的5种脂肪酸,具有结构类似、难于分离的特点; 另外,UPC2系统所使用的亚2 μm色谱柱涵盖了正相和反相色谱柱类别。本实验考察了4种固定相差异明显的色谱柱,分别为Acquity UPC2BEH,BEH 2-EP, HSS C18 SB以及CSHTM Fluoro-Phenyl。从实验结果(图2)可见,本实验条件下Acquity UPC2BEH 2-EP色谱柱能够更好地实现5种脂肪酸的有效分离。
3.2 流动相中助溶剂的选择
UPC2系统所使用的流动相主要是CO2,并以少量有机溶剂作为助溶剂进行分离; 不同类别的有机溶剂对目标物的分离也会产生一定影响。因本研究是UPC2系统接入MS检测器,因此助溶剂以甲醇和乙腈为主要研究对象。实验考察了3种有机溶剂(甲醇、乙腈、甲醇-乙腈(1∶1, ?V/V))对5种脂肪酸的分离影响。从图3可见,3种溶剂在本方法中对脂肪酸的洗脱能力为:甲醇﹥甲醇-乙腈(1∶1, V/V)﹥乙腈; 3种溶剂的选择性存在差异,其中甲醇-乙腈(1∶1, V/V)和乙腈分离效果相当,但乙腈保留时间相对较长。综合考虑洗脱能力和分离效果,本实验最终采用甲醇-乙腈(1∶1, V/V)为有机溶剂辅助流动相。
3.3 色谱柱温度和系统背压的选择
在UPC2方法开发中,色谱柱温度和系统背压可以作为两个重要的参数进行分离条件的优化。改变色谱柱温度和系统背压,就会显著改变以压缩的CO2为主的流动相的密度和性能,从而改变其洗脱能力和选择性。本实验考察了柱温(40,50和60 ℃)和系统背压(12.41,13.78和14.83 MPa)对分离的影响,从图4可见,随着柱温升高和背压降低,脂肪酸的保留值增加。当柱温为60 ℃时,C16∶0和C18∶3的峰形拖尾,展宽明显,而过高的背压易使UPC2系统压力过大。综合考虑分离效果与分析效率,最终确定柱温为50 ℃,系统背压为13.78 MPa。
3.4 MS中补偿溶剂的选择
在MS方法开发中,不同的补偿溶剂对目标物的离子化效率也会产生一定的影响。实验考察了3组不同的补偿溶剂甲醇(含1%水)、甲醇(含0.1%甲酸铵)、甲醇(含0.1%醋酸铵)和不同的流速(0.1, 0.2和0.3 mL/min)对5种脂肪酸分离的影响。在相同的梯度洗脱条件下,甲醇-1%水作为补偿溶剂,且流速为0.2 mL/min时,目标物离子化效果最好,色谱峰尖锐、对称响应灵敏度高,5种脂肪酸分离效果最好。
3.5 方法评价
配制0.5, 5, 25, 50和100 mg/L的混合标准溶液,在优化的色谱条件下进行检测,以峰面积(Y)对质量浓度(x, mg/L)进行线性回归,得线性回归方程。向已知含量的工业油酸样品中分别添加5种成分的脂肪酸标准品,设置3个添加水平,每个水平重复测定5次,并计算加标回收率和精密度。按信噪比S/N≥3计算得到分析方法的检出限(LOD)。结果(表2)表明,5种脂肪酸在0.5~100 mg/L内线性关系良好(R2≥0.9985),3个加标水平的回收率为89.3%~106.7%,RSD为0.8%~3.0%,LOD为0.07~0.26 mg/L,可满足实际样品测定的需要。
3.6 实际样品分析
采用本方法对棉籽油酸、大豆油酸和菜籽油酸3种植物油样品进行检测,检测结果(表3)表明,3种工业油酸中5种脂肪酸的含量和比例不同。其中,棉籽油酸和大豆油酸以亚油酸为主,而菜籽油酸则是以油酸为主。但总体而言,以这3种植物油为原料所生产的工业油酸都是以油酸、亚油酸为主,且这两种脂肪酸总含量均大于80%。典型的样品色谱图如图5所示。
通过对色谱柱、色谱柱温度、系统背压和质谱等条件的优化和考察,建立了超高效合相色谱-质谱快速检测工业油酸中5种脂肪酸的分析方法。本方法能在3 min内实现5种脂肪酸的有效分离,采用CO2作主要流动相,实现了高分离度、高灵敏度、高分析速度、低成本的目标。
References
1
WEN Yan-Zhuan. Chemical Engineering & Equipment, 2010, (10): 39-41
温艳转. 化学工程与装备, ?2010(10): 39-41
2 LU Li-Zhu. ?Fine and Specialty Chemicals, 2007, 1(15): 24-28
陆蠡珠. 精细与专用化学品, 2007, 1(15): 24-28
3 HUI Rui-Hua, HOU Dong-Yan, LI Tie-Chun, ZHU Yong-Qiang, LIU Xiao-Yuan. ?Journal of Chinese Mass Spectrometry Society, 2005,26(2): 90-92
回瑞华, 候冬岩, 李铁纯, 朱永强, 刘晓媛. 质谱学报, 2005, 26(2): 90-92
4 WU Hui-Qing, HUANG Xiao-Lan, LIN Xiao-Shan, HUANG Fang, ZHU Zhi-Xin, MA Ye-Fen. ?Chinese J. Anal.Chem., 2007, 35(7): 998-1003
吴惠勤, 黄晓兰, 林晓珊, 黄 芳, 朱志鑫, 马叶芬. 分析化学, 2007, 35(7): 998-1003
5 XU Gui-Zhuan, LIANG Xin, SU Hui, ZHANG Bai-Liang. ?Journal of Anhui Agricultural Sciences, 2008, 36(28): 12090-12091
徐桂转, 梁 新, 苏 惠, 张百良. 安徽农业科学, 2008, 36(28): 12090-12091
6 Ghiaci M, Aghabarari B, Gil A. Gil. Fuel, 2011, 90(11): 3382-3389
7 ZENG Jian-Li, DU Ze-Xue, CHEN Yan-Feng. ?Petroleum Processing and Petrochemicals, 2012, 43(7): 104-110
曾建立, 杜泽学, 陈艳凤. 石油炼制与化工, 2012, 43(7): 104-110
8 LI Bin, QIU Li-Qun, SONG Shao-Fang,GAO Ai-Ying,ZHANG Hao. ?Chinese Journal of Analysis Laboratory, 2014, 33(5): 528-532
李 斌, 裘立群, 宋少芳, 高艾英, 张 昊. 分析试验室, 2014, 33(5): 528-532
9 Lall R K, Proctor A, Jain V P. ?Jain. J. Am. Oil Chem. Soc., 2009, 86: 309-314
10 ZHANG Da-Hua, LI Li-Xia. ?Cereals & Oils, 2007 (12): 41-43
张大华, 李丽霞. 粮食与油脂, 2007(12): 41-43
11 LI Kai-Xin, CHEN Li, YAN Zong-Cheng, WANG Hong-Lin. ?Journal of Instrumental Analysis, 2010, 29(1): 39-42
李凯欣, 陈 砺, 严宗诚, 王红林. 分析测试学报, 2010, 29(1): 39-42
12 SHE Zhu-Hua. ?Grain Processing, 2004(6): 64-66
佘珠花. 粮食加工, 2004(6): 64-66
13 Seorns F J, Ibaez E. ?Anal. Chim. Acta, 2002,465: 131-144
14 Francois I, Sandra P. ?J. Chromatogr. A, 2009, 1216: 4005-4012
15 LI Yi-Zhe, BAO Gui-Rong, WANG Hua. ?Chinese Journal of Chromatography, 2008, 26(4): 494-498
李一哲, 包桂蓉, 王 华. 色谱, 2008, 26(4): 494-498
16 MENG Zhe, WEN Da-Wei, LIAO Yi-Ping, LIU Hu-Wei. ?Chinese Journal of Chromatography, 2007, 25(2): 254-257
孟 哲, 文大为, 廖一平, 刘虎威. 色谱, 2007, 25(2): 254-257
17 Sanches-Silva A, Rodríguez-Bernaldo de Quirós A, López-Hernndez J, Paseiro-Losada P. J. Chromatogr. A, 2004, 1032: 7-15
18 Mossaba M M, Kramer J K G, Brenna J T, McDonald R E. ?Lipid Analysis and Lipidomics——New Techniques and Application, Champaign, Illinois, AOCS Press, 2006
19 XU Yong-Wei, SUN Qing-Long, HUANG Jing, TAN Xiao-Jie. ?Modern Instruments, 2012, 18(5): 45-48
徐永威, 孙庆龙, 黄 静, 谭晓杰. 现代仪器, 2012, 18(5): 45-48
20 LI Zhong-Hao, WU Shuai-Bin, LIU Shan-Shan, FAN Zi-Yan, YANG Fei, BIAN Zhao-Yang, TANG Gang-Ling, CHEN Zai-Gen, HU Qing-Yuan. ?Chinese J. Anal.Chem., 2013, 41(12): 1817-1824
李中皓, 吴帅宾, 刘珊珊, 范子彦, 杨飞, 边照阳, 唐纲岭, 陈再根, 胡清源. 分析化学, 2013, 41(12): 1817-1824
Rapid Detection of Five Common Fatty Acids ?in Industrial Oleic
Acid Based on Ultra Performance Convergence
Chromatography-Mass Spectrometry
LIN Chun-Hua1, FAN Nai-Li1, RUI Pei-Xin1, XIA Jian-Hui*1, LIAO Wei-Lin1, YANG Shao-Ming2
1(National Monosaccharide Chemical Synthesis Engineering Research Center, Nanchang 330027, China)
2(Department of Chemistry and Chemical Engineering, School of Basic Sciences,
East China Jiaotong University, Nanchang 330013, China)
Abstract A rapid method was developed for the determination of 5 common fatty acids, palmitic acid, stearic acid, oleic acid, linoleic acid and linolenic acid in industrial oleic acid based on ultra-performance convergence chromatography-mass spectrometry (UPC-MS). The sample was dissolved by n-hexane, followed by clean-up of extract using 0.22 μm organic phase filter. The fatty acids were separated in 3 min on the column of Acquity UPC2 BEH 2-EP by gradient elution with carbon dioxide and methanol/acetonitrile (1∶1, V/V) system, and finally detected by MS detector in ESI- ?mode. Through the optimization of UPC2-MS condition, the reasonable linearity was achieved for all the analytes over the range of 0.5-100 mg/L with the correlation coefficients (R2) greater than 0.9985. The recoveries for five fatty acids at three spiked levels were in the range from 89.3% to 106.67% with relative standard deviations of 0.8%-3.0%. The limits of detection for target compounds in the method ranged from 0.07 mg/L to 0.26 mg/L. The real sample analysis showed that this method was simple,fast and had a good separation effect. There was no need of derivatization for fatty acid samples. This work would provide a fast and effective detection method for UPC2 technology in oil related research field.
Keywords Ultra performance convergence chromatography-mass spectrometry; Industrial oleic acid; ?Underivatization; fatty acids
(Received 20 August 2014; accepted 15 October 2014)
This article is funded by the National Science and Technology Support Project(NO.2012BAE07B00)

