电针对大鼠脑局部缺血再灌流后c-fos、mRNA表达的影响
王 利 张学勤 张 勇 卢志达
(崇文区中医医院,北京100061;1首都医科大学附属北京同仁医院)
摘要采用Wistar大鼠,线栓法制作脑局部缺血再灌流动物模型,以原位杂交技术及苏木素-伊红(HE)染色方法,观察电针对缺血侧额叶、顶叶及海马各区内c-fos、mRNA表达并神经元组织形态学改变的影响。结果表明,电针能显著增强脑局部缺血再灌流后病灶侧额、顶叶皮层及海马各区c-fos、mRNA表达,并能减少缺血再灌流损伤后上述各脑区神经元的变性坏死。结果提示电针对脑局部缺血后受损神经元的保护作用可能与增强了c-fos、mRNA的表达有关。
主题词电针脑缺血/针灸疗法c-fos类/代谢RNA,信使/代谢再灌注损伤原癌基因蛋白质
c-fos基因是细胞内快反应基因,在神经系统缺血性损害时,呈一过性表达。目前,c-fos表达已被作为特定刺激下神经元功能活动的标志物。本实验研究采用更接近脑卒中临床实体的脑局部缺血再灌流动物模型,运用祖国医学的针刺方法,结合现代生物学的实验手段,旨在从分子生物学的角度为脑卒中后极早期的针刺治疗提供理论依据。
1材料与方法
1.1实验动物
选用健康雄性Wistar大鼠(由首都医科大学实验动物中心提供),体重200~250 g。动物麻醉采用3.5%水合氯醛,350 mg/kg腹腔注射。麻醉过程中以烤灯维持动物肛温在36.5~37.5 ℃。
1.2动物模型制备及分组
1.2.1模型制备采用改良线栓法制作大鼠可逆性左侧大脑中动脉(MCA)缺血再灌流动物模型。步骤如下:大鼠麻醉成功后,仰卧固定于手术平台上。颈部正中开窗,分离暴露左侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA)。于ECA近分叉处做一小切口,插入尼龙线至ICA内约17 mm,结扎固定。再灌流时拔出栓子。
1.2.2动物分组实验用大鼠随机分为4组,即:缺血再灌流组(n=5,缺血1 h+再灌注1 h);缺血再灌流+电针组(n=5,缺血1 h+再灌流1 h+电针0.5 h);假手术组(n=3,单纯分离血管);假手术+电针组(n=3,假手术+电针0.5 h)。
1.3针刺处理
1.3.1取穴依照大鼠经穴定位法,选取"百会"、"风府"2穴。
1.3.2刺法大鼠麻醉后,取腹卧位固定于手术平台上。"百会"穴以毫针向前斜刺2.5 mm,"风府"穴以毫针向后斜刺2.0 mm。针刺后以WQ-6F型电针仪给予电压为4.5 mV,间断频率15次/min,f1为6 Hz,f2为8 Hz两种频率交替的等幅疏密波电刺激。电针于左侧MCA闭塞后30 min开始,持续30 min。缺血再灌流组大鼠亦于同时相麻醉、固定,持续时间与缺血再灌流+电针组等长。
1.4c-fos、mRNA检测
1.4.1原位杂交于实验末麻醉动物,经心腔依次灌注0.9%生理盐水及以0.01 mol/L磷酸缓冲液生理盐水(PBS)配制的4%甲醛溶液。断头取脑,置于4%PBS甲醛溶液中固定48 h。将鼠脑自额极向后至枕极冠状切为A、B、C、D、E 5个等份;依次行酒精梯度脱水、二甲苯透明、浸蜡、包埋。取C、D脑片连续切片,片厚5 μm,贴附于预先涂有光学树脂胶(APFS)的载玻片上,用原位杂交技术进行染色。c-fos探针及链酶蛋白酶/辣根过氧化物酶(S-A/HRP)标记物抗体试剂盒均购于北京中山试剂公司。具体步骤严格按试剂盒说明书操作。阴性对照以羊血清代替c-fos探针。
1.4.2观察方法于C、D脑片连续切片中每隔6张取1张,共取10张;每张切片观察10个高倍视野(OLYMPUS BH-2型光学显微镜,×400倍),以测微尺计数c-fos、mRNA阳性细胞。
1.5HE染色
石蜡切片常规脱蜡、脱水,HE染色,光镜下观察。
1.6统计学处理
实验结果以均数±标准差(x±s)表示,以分组t检验进行显著性分析。数据处理采用SYSTAT软件包。
2结果
2.1神经元c-fos、mRNA表达
c-fos、mRNA表达阳性的神经细胞,胞核呈深棕色,胞浆不着色。假手术组与假手术+电针组在左侧各脑区内的c-fos、mRNA阳性细胞数均极少,两组间差异无显著性意义。与假手术组比较,缺血再灌流组与缺血再灌流+电针组左侧各观察脑区c-fos、mRNA阳性细胞数均极显著增加。两组均以额叶、顶叶皮层的Ⅱ~Ⅴ层神经细胞中表达更为强烈。与缺血再灌流组比较,电针组病灶侧各脑区c-fos、mRNA增加更为明显,尤以齿状回、额叶、顶叶皮层为著,海马CA1、CA4区神经细胞c-fos、mRNA阳性表达亦有显著增加(见表1)。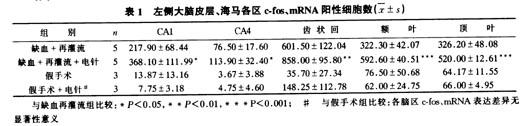
2.2组织形态学改变
石蜡切片HE染色后光镜下观察所见:假手术组与假手术+电针组皮层及海马各区内神经元形态正常。缺血再灌流组病灶侧额叶、顶叶皮质部分组织水肿,多数神经元胞浆红染,胞核呈不规则形固缩、深染,神经细胞变性、坏死明显;在海马及齿状回各区内亦可见部分神经细胞胞浆红染,胞核固缩,细胞变性、坏死。电针组病灶侧皮层仅见少量神经细胞胞浆红染,细胞肿胀,核固缩,但其数量明显少于缺血再灌流组;海马及齿状回内极少神经细胞有轻度萎缩,胞浆红染。
3讨论
c-fos基因是即早基因(immediate-early genes,IEGs)家族的一员。近年来的研究表明,在正常情况下,c-fos基因参与细胞生长、繁殖分化、信号传递、学习与记忆等生理过程,在绝大多数细胞包括神经元中呈极低表达;病理情况下,c-fos基因的表达及调控变化与多种疾病的发生和发展有关。c-fos基因可被一过性脑缺血所诱导,虽然在细胞对缺血的反应中,c-fos的作用机制尚未被完全阐明,但c-fos可以改变许多基因的表达,提示它可作为存活机制的一部分,参与针对损害的遗传信息的产生。c-fos作为核内第3信使分子,通过特殊靶基因的表达,能将细胞外短期的刺激信号转换为长时间的细胞功能改变,从而对细胞分化和可塑性起重要作用。缺血后神经元网络受到破坏,特殊基因表达的改变,特别是能引导上调其它基因的c-fos等IEGs的表达改变,使神经元达到特定的可塑性,以整合缺血后的神经元网络,使被破坏的神经元网络得以重建,恢复正常功能。脑缺血后诱导c-fos、mRNA表达的影响因素很多,其中之一是脑血流量。许多大鼠MCA闭塞模型实验表明,c-fos、mRNA在缺血中心呈低表达或不表达,而在缺血半暗带和远离缺血区未受损的神经细胞内呈一过性高表达。在这两类不同区域中,IEGs在神经元中的表达标志着神经元将存活。由此说明,在缺血区内能幸免于缺血损害的细胞存在c-fos诱导与表达,而一定量的局部脑血流则是产生表达的必要条件。
本研究采用原位杂交技术观察了Wistar大鼠脑局部缺血1 h继以再灌流1 h病灶侧额叶、顶叶、海马各区内c-fos、mRNA的表达及电针对其产生的影响。结果表明,假手术及假手术+电针组大鼠各脑区的c-fos、mRNA表达水平低下。缺血再灌流组病灶侧大脑额叶、顶叶皮层的Ⅱ~Ⅴ层神经细胞及海马齿状回各部位均有大量c-fos、mRNA表达,电针处理组病灶侧各相应脑区内c-fos、mRNA的表达呈显著性增加(见表1)。该结果与文献报告相一致。光镜下组织形态学观察所见,电针处理后病灶侧上述各脑区的神经元变性坏死数目较之缺血再灌流组明显减少,程度亦减轻,提示电针处理对缺血神经元有良好的保护作用。由于针刺可以使缺血局部的血管阻力下降,增加脑缺血部位的血流量,从而使c-fos、mRNA的表达增加,受损神经元得到保护,减轻了脑缺血再灌流后的神经元损伤。影响c-fos、mRNA在脑缺血后诱导表达的因素还有(1)N-甲基-D-天冬氨酸(NMDA)受体的激活,(2)细胞内Ca++的增多,(3)扩展性抑制等。针刺的作用是否还涉及上述方面,尚需进一步研究以证实。近年来的一些实验研究表明,电针疗法对脑缺血再灌流损伤确有保护作用,可以改善脑缺血再灌流后神经系统的功能障碍,减轻脑水肿及缺血后神经元损伤,促进神经细胞功能的恢复。本研究结果提示,电针对脑局部缺血再灌流所造成的神经元损伤具有保护作用,其作用机制可能与电针增加c-fos、mRNA表达有关。
本研究所选用的穴位"百会"及"风府"均为督脉之穴。依据祖国医学的理论,治疗中风选取督脉经穴,主要在于督脉总督一身之阳脉,为"阳脉之海";督脉上行至风府,入于脑,故和脑有密切的关系。针刺督脉可以振奋周身之阳气,疏通经络、健脑补髓、醒脑开窍,从而达到治疗之目的。
(收稿日期:1999-04-22,齐淑兰发稿)
(崇文区中医医院,北京100061;1首都医科大学附属北京同仁医院)
摘要采用Wistar大鼠,线栓法制作脑局部缺血再灌流动物模型,以原位杂交技术及苏木素-伊红(HE)染色方法,观察电针对缺血侧额叶、顶叶及海马各区内c-fos、mRNA表达并神经元组织形态学改变的影响。结果表明,电针能显著增强脑局部缺血再灌流后病灶侧额、顶叶皮层及海马各区c-fos、mRNA表达,并能减少缺血再灌流损伤后上述各脑区神经元的变性坏死。结果提示电针对脑局部缺血后受损神经元的保护作用可能与增强了c-fos、mRNA的表达有关。
主题词电针脑缺血/针灸疗法c-fos类/代谢RNA,信使/代谢再灌注损伤原癌基因蛋白质
c-fos基因是细胞内快反应基因,在神经系统缺血性损害时,呈一过性表达。目前,c-fos表达已被作为特定刺激下神经元功能活动的标志物。本实验研究采用更接近脑卒中临床实体的脑局部缺血再灌流动物模型,运用祖国医学的针刺方法,结合现代生物学的实验手段,旨在从分子生物学的角度为脑卒中后极早期的针刺治疗提供理论依据。
1材料与方法
1.1实验动物
选用健康雄性Wistar大鼠(由首都医科大学实验动物中心提供),体重200~250 g。动物麻醉采用3.5%水合氯醛,350 mg/kg腹腔注射。麻醉过程中以烤灯维持动物肛温在36.5~37.5 ℃。
1.2动物模型制备及分组
1.2.1模型制备采用改良线栓法制作大鼠可逆性左侧大脑中动脉(MCA)缺血再灌流动物模型。步骤如下:大鼠麻醉成功后,仰卧固定于手术平台上。颈部正中开窗,分离暴露左侧颈总动脉(CCA)、颈外动脉(ECA)及颈内动脉(ICA)。于ECA近分叉处做一小切口,插入尼龙线至ICA内约17 mm,结扎固定。再灌流时拔出栓子。
1.2.2动物分组实验用大鼠随机分为4组,即:缺血再灌流组(n=5,缺血1 h+再灌注1 h);缺血再灌流+电针组(n=5,缺血1 h+再灌流1 h+电针0.5 h);假手术组(n=3,单纯分离血管);假手术+电针组(n=3,假手术+电针0.5 h)。
1.3针刺处理
1.3.1取穴依照大鼠经穴定位法,选取"百会"、"风府"2穴。
1.3.2刺法大鼠麻醉后,取腹卧位固定于手术平台上。"百会"穴以毫针向前斜刺2.5 mm,"风府"穴以毫针向后斜刺2.0 mm。针刺后以WQ-6F型电针仪给予电压为4.5 mV,间断频率15次/min,f1为6 Hz,f2为8 Hz两种频率交替的等幅疏密波电刺激。电针于左侧MCA闭塞后30 min开始,持续30 min。缺血再灌流组大鼠亦于同时相麻醉、固定,持续时间与缺血再灌流+电针组等长。
1.4c-fos、mRNA检测
1.4.1原位杂交于实验末麻醉动物,经心腔依次灌注0.9%生理盐水及以0.01 mol/L磷酸缓冲液生理盐水(PBS)配制的4%甲醛溶液。断头取脑,置于4%PBS甲醛溶液中固定48 h。将鼠脑自额极向后至枕极冠状切为A、B、C、D、E 5个等份;依次行酒精梯度脱水、二甲苯透明、浸蜡、包埋。取C、D脑片连续切片,片厚5 μm,贴附于预先涂有光学树脂胶(APFS)的载玻片上,用原位杂交技术进行染色。c-fos探针及链酶蛋白酶/辣根过氧化物酶(S-A/HRP)标记物抗体试剂盒均购于北京中山试剂公司。具体步骤严格按试剂盒说明书操作。阴性对照以羊血清代替c-fos探针。
1.4.2观察方法于C、D脑片连续切片中每隔6张取1张,共取10张;每张切片观察10个高倍视野(OLYMPUS BH-2型光学显微镜,×400倍),以测微尺计数c-fos、mRNA阳性细胞。
1.5HE染色
石蜡切片常规脱蜡、脱水,HE染色,光镜下观察。
1.6统计学处理
实验结果以均数±标准差(x±s)表示,以分组t检验进行显著性分析。数据处理采用SYSTAT软件包。
2结果
2.1神经元c-fos、mRNA表达
c-fos、mRNA表达阳性的神经细胞,胞核呈深棕色,胞浆不着色。假手术组与假手术+电针组在左侧各脑区内的c-fos、mRNA阳性细胞数均极少,两组间差异无显著性意义。与假手术组比较,缺血再灌流组与缺血再灌流+电针组左侧各观察脑区c-fos、mRNA阳性细胞数均极显著增加。两组均以额叶、顶叶皮层的Ⅱ~Ⅴ层神经细胞中表达更为强烈。与缺血再灌流组比较,电针组病灶侧各脑区c-fos、mRNA增加更为明显,尤以齿状回、额叶、顶叶皮层为著,海马CA1、CA4区神经细胞c-fos、mRNA阳性表达亦有显著增加(见表1)。

2.2组织形态学改变
石蜡切片HE染色后光镜下观察所见:假手术组与假手术+电针组皮层及海马各区内神经元形态正常。缺血再灌流组病灶侧额叶、顶叶皮质部分组织水肿,多数神经元胞浆红染,胞核呈不规则形固缩、深染,神经细胞变性、坏死明显;在海马及齿状回各区内亦可见部分神经细胞胞浆红染,胞核固缩,细胞变性、坏死。电针组病灶侧皮层仅见少量神经细胞胞浆红染,细胞肿胀,核固缩,但其数量明显少于缺血再灌流组;海马及齿状回内极少神经细胞有轻度萎缩,胞浆红染。
3讨论
c-fos基因是即早基因(immediate-early genes,IEGs)家族的一员。近年来的研究表明,在正常情况下,c-fos基因参与细胞生长、繁殖分化、信号传递、学习与记忆等生理过程,在绝大多数细胞包括神经元中呈极低表达;病理情况下,c-fos基因的表达及调控变化与多种疾病的发生和发展有关。c-fos基因可被一过性脑缺血所诱导,虽然在细胞对缺血的反应中,c-fos的作用机制尚未被完全阐明,但c-fos可以改变许多基因的表达,提示它可作为存活机制的一部分,参与针对损害的遗传信息的产生。c-fos作为核内第3信使分子,通过特殊靶基因的表达,能将细胞外短期的刺激信号转换为长时间的细胞功能改变,从而对细胞分化和可塑性起重要作用。缺血后神经元网络受到破坏,特殊基因表达的改变,特别是能引导上调其它基因的c-fos等IEGs的表达改变,使神经元达到特定的可塑性,以整合缺血后的神经元网络,使被破坏的神经元网络得以重建,恢复正常功能。脑缺血后诱导c-fos、mRNA表达的影响因素很多,其中之一是脑血流量。许多大鼠MCA闭塞模型实验表明,c-fos、mRNA在缺血中心呈低表达或不表达,而在缺血半暗带和远离缺血区未受损的神经细胞内呈一过性高表达。在这两类不同区域中,IEGs在神经元中的表达标志着神经元将存活。由此说明,在缺血区内能幸免于缺血损害的细胞存在c-fos诱导与表达,而一定量的局部脑血流则是产生表达的必要条件。
本研究采用原位杂交技术观察了Wistar大鼠脑局部缺血1 h继以再灌流1 h病灶侧额叶、顶叶、海马各区内c-fos、mRNA的表达及电针对其产生的影响。结果表明,假手术及假手术+电针组大鼠各脑区的c-fos、mRNA表达水平低下。缺血再灌流组病灶侧大脑额叶、顶叶皮层的Ⅱ~Ⅴ层神经细胞及海马齿状回各部位均有大量c-fos、mRNA表达,电针处理组病灶侧各相应脑区内c-fos、mRNA的表达呈显著性增加(见表1)。该结果与文献报告相一致。光镜下组织形态学观察所见,电针处理后病灶侧上述各脑区的神经元变性坏死数目较之缺血再灌流组明显减少,程度亦减轻,提示电针处理对缺血神经元有良好的保护作用。由于针刺可以使缺血局部的血管阻力下降,增加脑缺血部位的血流量,从而使c-fos、mRNA的表达增加,受损神经元得到保护,减轻了脑缺血再灌流后的神经元损伤。影响c-fos、mRNA在脑缺血后诱导表达的因素还有(1)N-甲基-D-天冬氨酸(NMDA)受体的激活,(2)细胞内Ca++的增多,(3)扩展性抑制等。针刺的作用是否还涉及上述方面,尚需进一步研究以证实。近年来的一些实验研究表明,电针疗法对脑缺血再灌流损伤确有保护作用,可以改善脑缺血再灌流后神经系统的功能障碍,减轻脑水肿及缺血后神经元损伤,促进神经细胞功能的恢复。本研究结果提示,电针对脑局部缺血再灌流所造成的神经元损伤具有保护作用,其作用机制可能与电针增加c-fos、mRNA表达有关。
本研究所选用的穴位"百会"及"风府"均为督脉之穴。依据祖国医学的理论,治疗中风选取督脉经穴,主要在于督脉总督一身之阳脉,为"阳脉之海";督脉上行至风府,入于脑,故和脑有密切的关系。针刺督脉可以振奋周身之阳气,疏通经络、健脑补髓、醒脑开窍,从而达到治疗之目的。
(收稿日期:1999-04-22,齐淑兰发稿)

