观赏地被植物百里香快繁优化研究
任俞新 张德罡

摘要:以当年生幼嫩茎段为外植体,进行百里香优化快繁再生体系试验。结果表明,百里香茎切段较理想的灭菌方法为75 %酒精浸泡30 s,转入饱和漂白粉上清液浸泡300 s。适合不定芽诱导的培养基为MS+2.0 mg/L 6-BA + 0.3 mg/L NAA+ 0.3 mg/L GA3,诱导率达95.25%,平均芽数10.8个。较佳的不定芽增殖培养基为MS+1.0 mg/L 6-BA+0.2 mg/L IBA+0.4 mg/L GA3,增殖倍数为15.11,平均苗高为4.61 cm。理想的生根培養基为1/2MS+0.2 mg/L IBA +0.1 mg/L IAA,生根率为100%,平均生根数10.03条,生根试管苗移栽20 d后成活率达95%。
关键词:百里香;优化快繁;诱导;培养; 成活率
中图分类号:S682? ? ? ? 文献标志码:A? ? ? ? ?文章编号:1001-1463(2020)08-0039-05
doi:10.3969/j.issn.1001-1463.2020.08.010
Abstract:The effects of different ratio of attapulgite (PAL) and LC-S01 on soil heavy metal passivation and reduce crop absorption were studied. The results showed that PAL could effectively increase the yield of Tartary buckwheat at 4 500.0 kg/hm2, which was 20.4% more than the control. When lC-SO1 was applied with 1 500.0 kg/hm2 + attapulgite 3 000.0 kg/hm2, the uptake of heavy metals in Tartary buckwheat roots, stems and grains decreased to different degrees, and the uptake of Cu, Zn, Cd and Pb in grains decreased by 23.5%, 23.3%, 43.9% and 61.0%, respectively, which had a positive effect on remediation of heavy metal pollution.
Key words:Attapulgite;Soil remediation conditioner;Heavy metals;Cultivated land;Buckwheat; Passivation
百里香(Thymus mongolicus Ronn)别名地椒、千里香、地姜,属唇形科半灌木。植株矮小,高5~20 cm。匍匐茎平卧,末端多为开花枝。密生多数平行直立茎,当年生枝紫色,老枝灰色。叶小近无柄,长椭圆形或长方条形,全缘,有侧脉2~3对,具透明腺点,腺点都可分泌浓郁的香气。花有红、粉红、淡紫、粉白等多种色彩,小花密集枝端成圆头状花序,花具短梗,花冠二唇型,二强雄蕊外露[1 ]。种子极小,无胚乳或少胚乳。4 — 5月为盛花期,6 — 9月常有星星小花点缀绿叶间,许多年份 9 — 10月还有1次盛花期。百里香在欧美各国均有分布,我国天然分布于内蒙古、甘肃、陕西、青海、宁夏、新疆、山西、北京、辽宁、吉林、黑龙江等地,为北方乡土植物,适应性强,抗寒抗旱耐高温。其根系发达,母株根长超过匍匐茎, 细根如网,又有匍匐茎随处生根,在十分干旱的流沙阳坡风化砂岩上均可正常生长,但在条件稍好土壤中生长更好。喜光也稍耐荫,但不耐潮湿。
百里香花色艳丽,香气怡人,茎匐叶密,如蔓地绿毯,是西北地区园林绿化的良好材料,可用于营造大面积观赏性草坪、芳香疗养功能性草坪、护坡草坪、花坛、花镜等,还可用于盆栽装饰阳台和屋顶。百里香也是典型的药用植物,具有解表祛风,行气止痛,止咳,降压之功效[2 - 3 ]。百里香整株具有芳香气味,可作为香料蔬菜、蜜源植物。
百里香在观赏、药用和食用方面的应用已引起了人们的广泛关注,但其野生资源种群数量少,作为药源,近年来人为采挖较为严重。为有效保护野生资源,开展百里香的繁育工作势在必行,而采用扦插、压条等常规方式育苗远远不能满足生产的需要,因此开展百里香组织培养和快速繁殖具有十分重要的意义。我们以百里香幼嫩茎段为外植体,对各种诱导因子在不同培养水平上的培养诱导进行了试验,以获得其优化快繁的最佳效果。
1? ?材料和方法
1.1? ?材料
供试百里香采自甘肃省小陇山林区。
1.2? ?试验方法
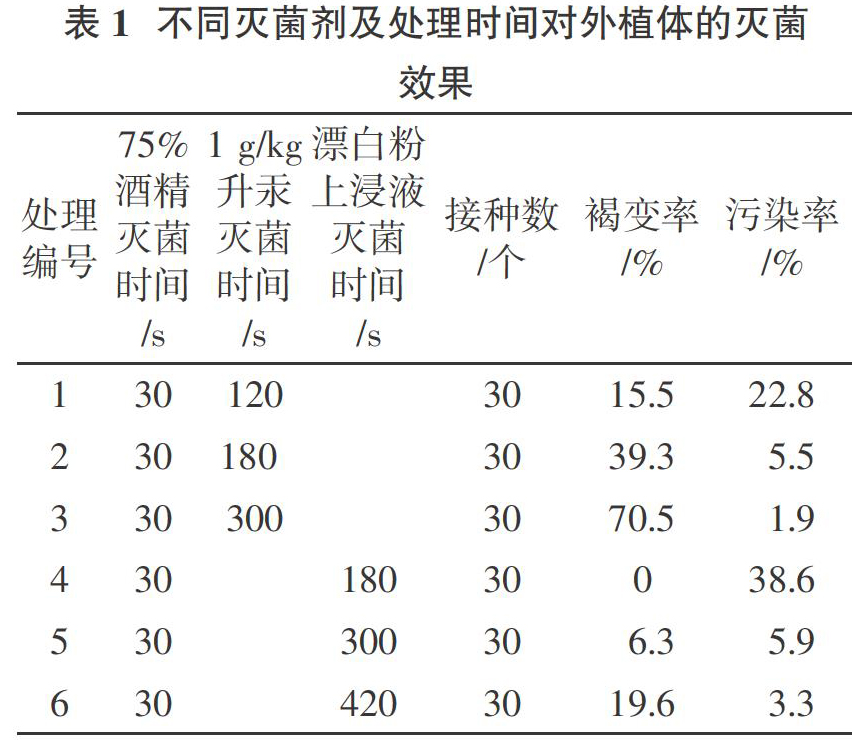
1.2.1? ?外植体材料的处理与接种? ?5月初选晴朗的上午采集当年生幼嫩茎立即运回实验室,剪去叶片,用清水将表面尘埃冲去,用5 g/kg的洗衣粉溶液浸泡5 min,用清水将表面的洗衣粉液冲洗干净。然后在超净工作台上切成长2~3 cm的茎段,放入广口瓶中。无菌条件下在广口瓶中先倒入75%酒精灭菌,摇动30 s,用无菌水冲洗3~5次,加入1 g/kg的升汞溶液分别灭菌120、180、300 s,或用饱和漂白粉上浸液分别灭菌180、300、420 s[4 ],然后用无菌水冲洗5~8次,将处理后的茎段取出放入铺有无菌滤纸的接种盘中备用。将消毒灭菌后的百里香茎段切去两端褐化部分,将剩余部分切割成长1.0~1.5 cm的茎段,接种到无激素的MS培养基上,共设6个处理,每处理10瓶,每瓶接种1块外植体,重复3次。接种14 d后检查污染率与褐变率。
1.2.2? ?培养条件? ?鉴于百里香组织培养过程中会出现较严重的玻璃化现象[5 ],在初代诱导和继代增殖培养基中均加蔗糖5%[5 ],生根培养阶段加入蔗糖3%[6 ],各培养基中均加8 g/L琼脂[5 ],pH 5.6~5.8。培养室温度为(22±2) ℃,诱导和继代培养阶段,光周期12 h/12 h (光/暗),生根阶段16 h/8 h(光/暗);光照强度约2 000 lx,有利于不定芽分化和生根[7 - 9 ]。
1.2.3? ?不定芽诱导? ? ?将初试培养所得无菌材料剪去粘有原培养基的底部,接种到不定芽诱导培养基中。以MS+0.3 mg/L GA3为基本培养基,采用6-BA与NAA两因素3水平(6-BA、IBA 各设计0.1、0.3、0.5 mg/L 3个浓度水平)随机设计,共9个处理,每处理10瓶,每瓶接种1个外植体,重复3次。培养30 d后观察诱导率和不定芽数。
1.2.4? ? 继代增殖培养? ? ?将初代诱导产生的不定芽分割成小芽或小段,转接到不同激素浓度配比的继代增殖培养基中,进行继续分化与增殖培养。试验选用内源激素6-BA和IBA促进不定芽的增殖和生长,6-BA、IBA 各设计0.1、0.3、0.5 mg/L 3个浓度水平,9个处理组合,每处理10瓶,每瓶接种5个初代不定芽,重复3次。每7 d观察记载生长情况1次,40 d后统计不定芽增殖倍数和生长情况。
1.2.5? ?生根培养? ?选取继代增殖培养所得无根芽苗,进行生根诱导试验。以1/2 MS为基本培养基,选用NAA、IBA和IAA等3种植物生长调节剂,NAA、IBA、IAA各设计0.1、0.2 mg/L 2个浓度水平,共6个处理组合,每处理10瓶,每瓶接种3个无根幼苗,重复3次。每7 d观察生根情况1次,30 d后统计生根率和平均生根数。
2? ?结果与分析
2.1? ?灭菌剂及处理时间对外植体灭菌效果的影响
结果表明:75 %酒精灭菌30 s + 饱和漂白粉上浸液灭菌300 s是百里香细嫩茎段外植体较理想的消毒灭菌组合,其褐变率(6.3%)和污染率(5.9 %)均相对较低(表1)。
2.2? ?生长调节剂配比对不定芽诱导的影响
经过消毒处理的嫩茎切段接种于分化培养基上进行培养,不定芽诱导的激素配比见表2。百里香芽苗分化和生长过程中会产生玻璃化现象,在各处理培养基中均加入GA 30.3 mg/L,以抑制玻璃化的产生[5 ]。结果(表2)表明,6-BA和NAA对不定芽的分化率和平均芽数有明显影响,且呈正相关。但当6-BA大于2.0 mg/L、NAA大于0.3 mg/L时平均芽数减少,分化时间推迟,不定芽节间变短。可见,MS+6-BA 2.0 mg/L+NAA 0.3 mg/L+GA3 0.3 mg/L为百里香最适合的从生芽分化培养基,分化率达95.25%,平均芽数10.8个(图1)。
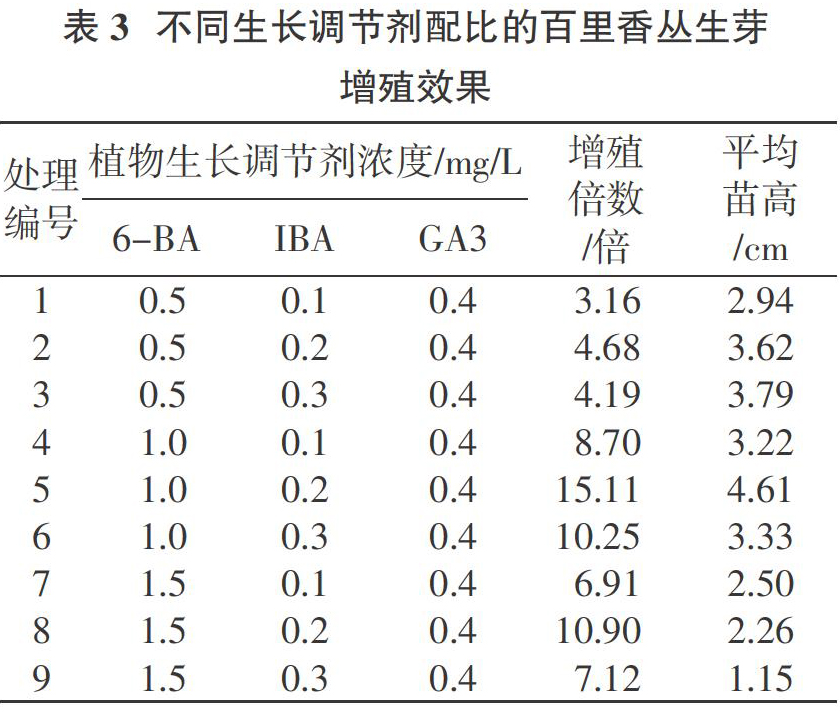
2.3? ?生长调节剂配比对丛生芽增殖的影响
将初代培养所得的簇生嫩茎切成长1.0~1.5 cm的小段,转入增殖培养基上培养28 d后增殖的结果因激素配比不同而异(表3)。增殖倍数随6-BA浓度的增高而增大,但浓度过高会影响芽苗的株高增长,且基部会出现玻璃化苗。综合分析试验结果,MS+1.0 mg/L 6-BA+0.2 mg/L IBA+0.4 mg/L GA3为百里香增殖培养较理想的培养基组合,增殖倍数相对较高,为15.11倍,平均株高为4.61 cm(图2)。
2.4? ?不同生长调节剂配比对丛生芽苗生根的影响
将丛生芽苗增殖培养继代后转入生根培养基中培养30 d后的统计结果(表4)表明,NAA、IBA和IAA均影响芽苗的生根,但IBA和IAA组合更适合于百里香的生根培养,1/2MS+0.2 mg/L IBA+0.1 mg/L IAA 培养基上的生根率为100%,平均生根数10.03条(图3),明显高于其他处理。将生根试管苗移栽,20 d后成活率达95%。
3? ?结论与讨论
在组培快繁试验中,外植体的选择和灭菌是整个试验顺利进行的基础。试验表明,以百里香当年生幼嫩茎段为外植体时,75%酒精灭菌30 s+饱和漂白粉上浸液灭菌300 s为最佳消毒灭菌组合,其褐变率和污染率都相对较低,分别为6.3%和5.9%。6-BA与NAA对百里香不定芽诱导具有明显影响。当培养基中6-BA浓度为2.0 mg/L、NAA浓度为0.3 mg/L时,分化率高达95.25 %,平均芽数10.8个。初代诱导试验筛选的最佳培养基是MS+2.0 mg/L 6-BA + 0.3 mg/L NAA + 0.3 mg/L GA3(加入0.3 mg/L GA3可有效抑制芽苗玻璃化的产生)。增殖培养较理想的培养基组合是MS + 1.0 mg/L 6-BA + 0.2 mg/L IBA + 0.4 mg/L GA3,增殖倍数相对较高,为15.11倍,平均株高为4.61 cm。百里香丛生芽苗生根培养的理想培养基为1/2 MS + 0.2 mg/L IBA + 0.1 mg/L IAA,其生根率為100 %,平均生根数10.03条,再生后的完整植株苗形美观,色泽深绿,移栽后生长良好,移栽20 d后成活率达95%。
参考文献:
[1] 中国科学院植物研究所.? 中国高等植物图鉴:第三册[M].? 北京:科学出版社,1983.
[2] 员? ?铭,吕国华. 百里香应用价值研究[J].? 安徽农学通报,2007(1):25.
[3] 张? ?继,田玉汝,刘忠旺,等.? 百里香属植物研究进展[J].? 北方园艺,2010(1):15.
[4] 任继文,雷? ?颖,李晓玲.? 款冬叶柄愈伤组织培养与再生体系建立[J].? 中国中药杂志,2017(20):42.
[5] 雷? ?颖.? 百里香组织培养过程中玻璃化问题的研究[J].? 中国野生植物资源,2015(1):34.
[6] 刘? ?敏.? 花卉组织培养与工厂化生产[M].? 北京:地质出版社,2002.
[7] 沙月娥,欧阳乐军,彭? ?舒.? 桉树胚状体再生与遗传转化的研究进展[J].? 植物生理学报,2012,48(4):325-332.
[8] 裴怀弟,林玉红,李淑洁,等.? 兰州百合组培小鳞茎诱导技术研究[J].? 甘肃农业科技,2019(7):29-32.
[9] 王春华,孙世海,郭? ?茹,等.? ZT浓度对4个蓝莓品种茎段初代培养的影响[J].? 甘肃农业科技,2019(8):4-7.
(本文责编:郑立龙)

