石河子地区秋葵黄萎病病原菌的鉴定
孙璘 王成成 李国英 李番 焦瑞莲 任毓忠


摘要:对出现维管束变色、植株矮化且叶片变黄的秋葵植株茎秆应用组织分离法进行分离、纯化,获得单孢菌株。用孢子悬浮液接种水培秋葵幼苗进行致病性测定,并通过形态学观察及分子生物学对病原菌进行鉴定。结果表明,供试秋葵菌株的菌落特征,分生孢子、分生孢子梗和微菌核形态均与大丽轮枝菌(Verticillium dahliae)一致;经分子生物学鉴定,供试菌株的ITS-ACT基因序列与大丽轮枝菌(V.dahliae,登录号:HQ206859和HQ206856,HQ206975和HQ206966)相似性达99.5%以上。因此,将引起石河子地区秋葵黄萎病的病原菌鉴定为大丽轮枝菌(Verticillium dahliae),且非落叶型和落叶型菌系均能侵染秋葵。
关键词:秋葵;黄萎病;多基因联合;病原鉴定;石河子
中图分类号:S649? ? ? ?文献标志码:A? ? ? ? 文章编号:1001-1463(2020)08-0022-06
doi:10.3969/j.issn.1001-1463.2020.08.006
Abstract:The stems of okra plants with discolored vascular bundles, dwarfized plants and yellowing leaves were isolated and purified by tissue separation to obtain monospora strains. Pathogenicity of isolations was tested with spore suspension inoculating water culture okra seedling, and the pathogen was identified based on morphological characteristics and sequence analysis of rDNA-ITS region and actin gene. The results showed that the colony morphology, conidia, conidiophore and microsclerotium of the strains were consistent with Verticillium dahliae. The ITS-ACT gene sequence of the tested strains showed 99.5% sequence similarity with V.dahliae(accession numbers:HQ206859 and HQ206856, HQ206975 and HQ206966). Therefore, the pathogen of Verticillium Wilt of Okra was identified as Verticillium dahliae, non-deciduous and deciduous type strains can infect okra in Shihezi area.
Key words:Okra;Verticillium wilt;Polygenic association;Pathogen identification;Shihezi
秋葵是一种锦葵科(Malvaceae)植物,富含维生素、矿物质以及蛋白质。种子含有大量的铁、锰、钾等元素,可提取蛋白质和油脂,榨油食用。秋葵嫩果具有大量维生素,是一种高档绿色蔬菜。经常食用秋葵有助于滋阴补阳,健肠胃[1 - 4 ]。由于秋葵的食用价值很高,全国各地都开始大量种植和引种,但随着种植区域和种植面积的不断扩张,秋葵病害发生日益严重。2017年,石河子部分区域种植的秋葵全株系统性发病,下部叶片显症后再向中上部叶片发展,叶肉变黄后整片萎蔫干枯。剖开植株茎秆,发现维管束明显变色,严重时会造成植株枯死。关于秋葵黄萎病,早在1918年Carpenter等[5 ]对发生症状进行了描述。1997年在我国也进行了发病规律和防治方法的系统研究[6 ]。为准确鉴定病原菌种类,我们以形态学鉴定和分子生物学鉴定为切入点,以期鉴定该病的病原菌及其致病类型,为病害防治提供参考依据。
1? ?材料与方法
1.1? ?病样采集及分离纯化
2017、2018年病害发生期的7 — 8月,于石河子大学农学院试验站、石河子总场等地采集发病明显的病株。将病株茎秆表皮剥离后切成长0.5 cm的小段,用1 g/kg的升汞溶液浸泡30 s,再用无菌水冲洗3次,置无菌滤纸上吸干多余液体。如为新鲜采集的病样,茎秆表面用75%酒精消毒后剥去表皮,用灭菌剪刀直接将茎秆剪成长0.5 cm的小段。将病样茎秆置于马铃薯葡萄糖琼脂培养基(PDA)上,置25 ℃恒温培养箱黑暗培养。当其长出白色菌丝时按照常规方法进行单孢纯化[7 ]。菌株置于PDA斜面保存于4 ℃冰箱。
1.2? ?致病性测定
1.2.1? ? 水培苗准备? ? 致病性测定采用水培苗孢子悬浮液接种法。将市购秋葵种子用75%酒精浸泡消毒10 min,用无菌水冲洗干净后播种在灭菌锯末中,置于25 ℃光照培養箱中催芽,幼苗真叶展平后拔出转移至水培盒中,将水培盒加水放入25 ℃光照培养箱光暗12 h交替培育。幼苗露出真叶后,将培养盒中的水换为青岛海博生物有限公司生产的MS营养液(不含琼脂和蔗糖),继续培育待用。
1.2.2? ? 孢子悬浮液制备及接种? ? 将供试菌株在PDA平板上活化后接入察氏(Czapek)液体培养基中,25 ℃、3.33 r/s振荡培养7 d左右,双层纱布过滤,收集纱布上的菌丝用作基因组DNA提取,滤液用作配制致病性测定孢子悬浮液。滤液经133.33 r/s离心沉淀后,用无菌水配制成浓度1×107 CFU/mL的孢子悬浮液。待秋葵幼苗水培至2片真叶后,对根部用配制好的孢子悬浮液浸泡接种12 h后倒掉孢子悬浮液,将幼苗重新放入水培液中培养。每个菌株接种3盒幼苗(每盒12株),用无菌水培做对照。10 d后调查发病情况,每隔3 d调查1次,40 d后结束,对病株重新进行病菌分离。
1.3? ?病原鉴定
1.3.1? ? 形态学鉴定? ? 供试菌株活化后接种于PDA平板,25 ℃培养7 d后在菌落边缘倾斜插入灭菌盖玻片4~5片,继续培养3~5 d后记录各菌株在PDA平板上菌落形态及微菌核产生情况,观察和测量分生孢子、分生孢子梗和微菌核的形态、大小及产生方式等[8 ]。
1.3.2? ? 分子生物学的鉴定? ? 选取3个供试菌株,分别收集其菌丝后用Biospin真菌基因组DNA提取试剂盒进行DNA提取,选用真核生物rDNA通用引物ITS1/ITS4、肌动蛋白引物ACT-512F/ACT-783R(引物序列见表1)进行PCR扩展,反应体系及条件参照岳永亮[9 ]的方法进行。产物经1%琼脂糖凝胶电泳检测后,送上海生工生物工程(上海)股份有限公司进行测序,将所测得的序列进行BLAST比对,查找Gen Bank已登录的相似序列来进行同源性分析,构建序列系统发育树。
1.3.3? ? 病菌不同致病类型检测? ? 用V. dahliae落叶型特异性引物INTD2f/INTD2r[10 ]和非落叶型引物INTND2f/INTND2r[11 ](引物序列见表1)对供试菌株进行致病类型检测,PCR扩增反应体系及条件参照魏春芝[12 ]。产物经1%琼脂糖凝胶电泳检测。
2? ?结果与分析
2.1? ?田间症状
在石河子地区,秋葵黄萎病多在7月上中旬出现症状,八月上旬发病最为明显。症状先从下部叶片开始,逐渐向上扩展。发病初期,叶脉周围的叶肉组织逐渐失绿变黄,附近主脉变褐色,后周围支脉也随之变褐,变褐叶脉在叶片上形成褐色树枝状(图1 A)。部分叶片表现为叶缘出现褪绿,后形成坏死斑。进一步扩展后,发病叶片整个逐渐变黄,边缘上卷(图1 B),干枯脱落,严重时整个植株落成光杆,植株干枯死亡(图1 C)。剖开发病植株茎秆,维管束组织变褐,甚至整个髓部变褐(图1 D),造成秋葵不能结实甚至大面积枯死。
2.2? ?致病性测定
接种后20 d左右,幼苗植株自下而上开始出现症状,即接种株先自下部叶片开始主脉逐渐褪绿变黄,周围叶肉随之褪绿,边界不明显(图1E)。随后病斑快速扩展,致整个叶片卷曲并迅速枯死,整株萎蔫死亡(图1 F)。剖开病株的茎秆,维管束明显变褐(图1H),与田间病害的症状表现基本一致。对照植株生长健壮(图1G),维管束也无明显变色现象(图1I)。对发病植株进行再分离,所得菌落特征与供试菌株表现一致。
2.3? ?形态学鉴别
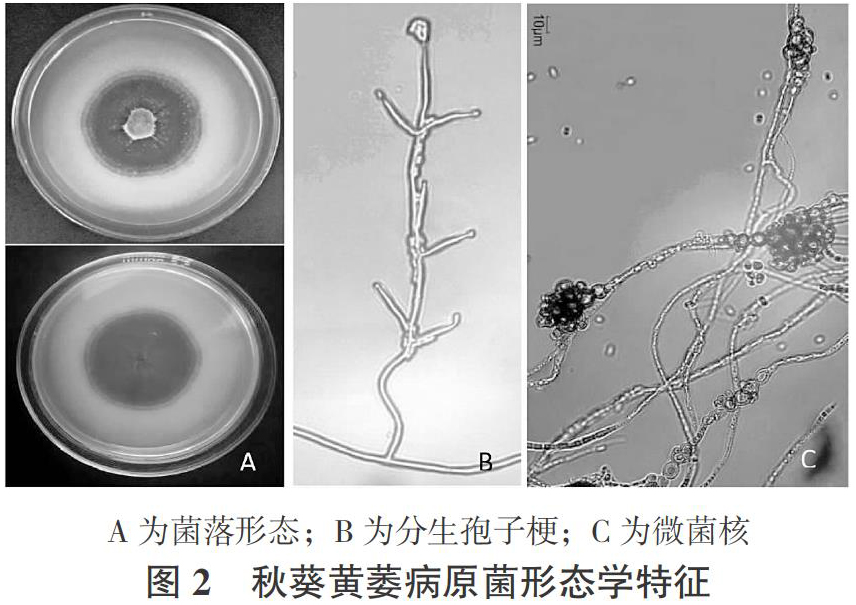
供试菌株在PDA培养基(马铃薯葡萄糖琼脂培养基)上的菌落近圆形,气生菌丝不发达,菌落外缘为白色透明的菌丝,中心有黑色的微菌核产生(图2 A)。经显微观察,菌株分生孢子梗多为1个顶枝小梗和1~3层轮生小梗,每层有2~4个分枝(图2 B)。顶枝小梗长度26.3~77.7 μm(平均49.9 μm),轮枝小梗长度15.7~52.1 μm(平均26.23 μm),轮层间距33.1~47.3 μm(平均43.6 μm)。分生孢子卵形、椭圆形,无色透明,大小为(4.4~8.0) μm×(2.1~4.1) μm。微菌核念珠状、长椭圆形,或近球形,形态大小差异较大,一般35.1 m~108.9? μm(平均60.9 μm)×(25.5~82.7) μm(平均35.3 μm)(图2 C)。供试菌株的培养特性及形态特征与文献报道的大丽轮枝菌(Verticillium dahliae)一致。
2.4? ?分子生物学鉴定
选取菌株XJok1、XJok3、XJok4,应用真菌通用引物ITS1/ITS4进行rDNA-ITS PCR扩增,获得大小为540 bp的DNA片段。利用NCBI进行Blast同源性比对,供试的3个菌株ITS区序列与来自西班牙棉花和美国茄子上的V. dahliae(登录号HQ206859和HQ206856)序列同源性达99.81%。供试3个菌株肌动蛋白基因(ACT-512F/ACT-783R)PCR扩增的产物大小为200 bp左右,与来自上述寄主同一分离物序列(登录号HQ206975和HQ206966)的同源性99.5%以上。将以上2个基因联合建立系统发育树,结果显示,供试菌株分别与来自中国棉花、美国茄子、韩国马铃薯、匈牙利臭椿以及中国萝卜上的大丽轮枝菌(V. dahliae)分离物处于同一个分支上,与轮枝菌属(Verticillium)的其他种的亲缘关系相对较远。结合病菌形态特征和系统发育分析,将引起石河子地区秋葵黄萎病的病原确定为大丽轮枝菌(Verticillium dahliae)(图3)。
2.5? ?病菌致病类型的检测
用大丽轮枝菌(V. dahliae)落叶型特异性引物INTD2f/INTD2r和非落叶型引物INTND2f/INTND2r对供试菌株进行致病类型检测的结果(图4)显示,供试菌株XJok1和XJok4利用落叶型特异性引物扩增出462 bp目标条带,而利用非落叶型特异性引物,菌株XJok2和XJok3扩增出约824 bp目标条带,阴性对照都没有条带出现。表明在石河子地区,大丽轮枝菌落叶型菌株和非落叶性型菌株均可引起秋葵黄萎病。
3? ?小结与讨论
经田间观察,秋葵黄萎病症状表现为叶肉组织首先失绿坏死,后周围支脉变褐,呈典型的“花西瓜皮状”,严重时叶片干枯脱落甚至整株死亡。病株维管束组织变褐,甚至整个髓部变褐。经分离純化鉴定,病菌分生孢子梗多为1个顶枝小梗和1~3层轮生小梗,每层有2~4个分枝,轮层间距33.1~47.3 μm(平均43.6 μm)。分生孢子单胞、卵形或椭圆形,无色透明,大小为(4.4~8)μm×(2.1~4.1) μm。产生的微菌核黑色,念珠状、长椭圆形或近球形,(35.1~108.9)μm(平均60.9 μm)×(25.5~82.7) μm(平均35.3 μm)。供试菌株ITS区和与肌动蛋白基因(ACT)序列与已报道的大丽轮枝菌(V. dahliae)同源性均高于99.5%。通过落叶型和非落叶型特异性引物PCR检测表明,菌株XJok1和XJok4为落叶型黄萎病菌,XJok2和XJok3为非落叶型黄萎病菌。结合形态学观察与ITS-ACT建立的多基因联合系统发育树分析,确定引起新疆秋葵黄萎病的病原菌为大丽轮枝菌(V. dahliae),且落叶型和非落叶型菌系都能感染秋葵。秋葵黄萎病的发生,主要与新疆棉花黄萎病土壤传病存在密切相关,应尽量避开棉花或茄子前茬,以减少黄萎病的发生和危害。
大丽轮枝菌(V. dahliae)是一种致病力强、变异性大而快的土传维管束真菌病害。到目前为止,由大丽轮枝菌引起的各种植物黄萎病已被多个国家报道,在中国主要危害棉花、茄子、大白菜、马铃薯等[13 - 15 ]。新疆秋葵黄萎病的来源主要与棉花黄萎病的普遍发生有关。我们在博乐、阿拉尔等地所见,秋葵黄萎病均发生在棉花黄萎病的重病田,且新疆棉花黄萎病的主要病原也是大丽轮枝菌(V. dahliae),病田土壤中的微菌核也是侵染秋葵的主要侵染来源。
由大丽轮枝菌引起的棉花黄萎病是新疆棉花上危害最严重的病害之一。另外,该病原菌还可以侵染绿豆、红花、榆树和苘麻等多种植物[16 ]。由于大丽轮枝菌基因组中存在大量的转座子以及基因重组现象,导致其产生不同的生理小种,使之对寄主产生抗性[17 - 18 ]。我们通过分子生物学鉴定出落叶型黄萎病和非落叶型黄萎病,这一结果同样表明黄萎病原菌中存在着不同的致病类型。关于黄萎病的防治,生产上主要以抗病品种的选育和种植为主,农艺措施主要是以改茬轮作、加强田间管理为主。
参考文献:
[1] 龚? ?霄,姜永超,周? ?伟,等.? 黄秋葵研究进展及其应用[J].? 食品工业科技,2018,39(23):329-333.
[2] 朱新明,韩晓梅,何军红,等.? 8个秋葵品种在酒泉市日光温室的引种观察初报[J].? 甘肃农业科技,2016(8):29-31.
[3]? 郎小芸.? 武威市沿沙绿洲灌区黄秋葵保护地高效栽培技术[J].? 甘肃农业科技,2015(12):83-85.
[4] 潘? ?东,陶玉祥.? 黄秋葵杂交种生产技术[J].? 甘肃农业科技,2015(10):86-88.
[5] CARPENTER C W.? Wilt diseases of okra and the Verticillium-wilt problem[J].? Journal of Agricultural Research.? 1918(12):529-546.
[6] 房德纯,蒋玉文.? 蔬菜病虫害防治彩色图说[M].? 北京:中国农业出版社,1996.
[7] 方中达.? 植病研究方法[M].? 北京:农业出版社,1979.
[8] 韩宏伟,刘培源,吉丽丽,等.? 新疆北部棉区棉花黄萎病菌病原种群致病性分化及变异[J].? 植物保护学报,2011,38(2):121-126.
[9] 岳永亮,任毓忠,张? ?莉,等.? 新疆榆树黄萎病病原菌鉴定[J].? 植物保護,2016,42(2):251-253.
[10] MERCADO-BLANCO J,RODR?魱GUEZ-JURADO D,P?魪REZ-ART?魪S E,et al. Detection of the defoliating pathotype of Verticillium dahliae infected olive plants by nested PCR[J].? European Journal of Plant Pathology,2002,108(1):1-13.
[11] MERCADO-BLANCO J,RODR?魱GUEZ-JURADO D,P?魪REZ-ART?魪S E,et al. Detection of the nondefoliating pathotype of Verticillium dahliae in infected olive plants by nested PCR[J].? Plant Pathology,2001,50(5):609-619.
[12] 魏春芝,刘朝霞,武贵元,等.? 山东部分地区棉花黄萎病菌的致病类型及毒性分析[J].? 山东农业科学,2015(12):80-84.
[13] YAN W X ,SHI Y X ,CHAI A L ,et al. Verticillium wilt of okra caused by Verticillium dahliae Kleb. In China[J].? Mycobiology,2018,46(3):1-6.
[14] 黄仲生.? 茄子黄萎病病原菌鉴定及防治研究[J].? 吉林蔬菜,1997(6):15.
[15] 王丽丽,蔡? ?超,罗? ?明,等.? 马铃薯黄萎病研究现状[J].? 生物安全学报,2017,26(1):30-38.
[16] 王成成.? 几种植物黄萎病病原鉴定、致病性分化和棉花不同生育期感病性研究[D].? 石河子:石河子大学,2017.
[17] AMYOTTE S G,TAN XIAOPING,PENNERMAN K,et al. Transposable elements in phytopathogenic Verticillium spp.:insights into genome evolution and inter-and intra-specific diversification[J].? BMC Genomics.? 2012,13(16):314
[18] 谢成建.? 大丽轮枝菌致病及微菌核形成相关基因研究进展[J].? 生物技术通报,2018,34(4):51-59.
(本文责编:陈? ? 伟)

