一种改进的大麦根尖染色体压片法及其应用
李淑洁

摘要:以大麦根尖为实验材料,采用改良的苯酚品红为染色液,在《遗传学实验》的基础上探索适宜的预处理时间、解离时间和染色时间,省略了纤维素酶和果胶酶处理步骤,形成了一套快速、简单的大麦根尖压片方法,该方法获得的染色体图像清晰,便于计数,可用于大麦倍性鉴定和染色体变异方面的研究。
关键词:大麦;根尖染色体;压片方法
中图分类号:S563.2;S182? ?文献标志码:A? ?文章编号:1001-1463(2020)05-0032-04
doi:10.3969/j.issn.1001-1463.2020.05.009
An Improved Squash Technique of Barely Root-tip and
Its Application
LI Shujie
(Institute of Biotechnology, Gansu Academy of Agricultural Science, Lanzhou Gansu 730070, China)
Abstract:In this study, barley root as experimental materials, the use of modified phenol fuchsine dye, on the basis of the genetics experiment, to explore suitable pretreatment time, dissociation time and dyeing time, cellulase and pectinase processing step is omitted, formed a set of barley root tablet method is rapid, simple, the method of chromosome image is clear, easy to count, can be used in barley ploidy identification and chromosome mutation research.
Key words:Barely( Hordeum vulgare);Chromosome number counting;Slide technique
大麥是世界上第四大作物,兼啤用、饲用、食用于一身,是我国的重要农作物之一。甘肃省是我国重要的优质啤酒大麦生产基地之一,大麦产量占全国总量的1/3[1 ]。采用多代自交选育自交系的常规育种方法周期长、成本高,通常需要自交6~8 代,至少需要3 a以上时间。通过单倍体技术可将自交系选育时间缩短为1~2 a,大大加快育种进程;而且双单倍体系(DH 系)完全纯合,系内变异来源于基因与环境互作,因而可以通过多点试验代替多年试验,更快速、更准确和更可靠的评价双单倍体系,提高育种效率[2 ]。双单倍体育种应用的关键是如何获得大量的单倍体植株。自从1973年Clapham大麦花药培养取得成功后[3 ],花药/小孢子培养、球茎大麦法获得大麦单倍体的方法被相继采用,并取得显著效果。
染色体倍性鉴定是大麦双单倍体育种的关键内容之一,常用的植物染色体倍性鉴定采用气孔保卫细胞叶绿体计数法、流式细胞仪鉴定法和分生组织压片染色体计数法[4 - 12 ],其中根尖染色体压片是植物倍性鉴定的最准确方法[13 ]。笔者以大麦根尖为实验材料,在遗传学实验的基础上,探索出了一种简单、快速的大麦根尖染色体压片技术,为大麦倍性鉴定和染色体变异研究奠定基础。
1? ?材料与方法
1.1? ?材料
实验材料为成熟的大麦(Hordeum vulgare,2 n=14)种子。
1.2? ?方法
1.2.1? ? 预处理? ? 取大麦种子浸种6 h以上,于20 ℃在滤纸上发芽,待根长1 cm左右时剪下根尖。根尖的预处理分以下4个方式:① 冰水混合物中处理16 h;② 0.002M 8-羟基喹啉溶液4 ℃处理2 h;③ 0.002M 8-羟基喹啉溶液4 ℃处理4 h;④ 0.002M 8-羟基喹啉溶液4 ℃处理6 h。预处理结束后蒸馏水淋洗数次。
1.2.2? ? 固定? ? 预处理结束后的根尖材料用卡诺式固定液(冰醋酸、无水乙醇体积比1∶3)固定14~24 h,保存于70%酒精中备用。
1.2.3? ? 解离? ? 固定的材料用蒸馏水冲洗数次,放入1.0 mol/L HCl溶液中,在60 ℃下解离5、10、15、20 min,以便胞间层的果胶类物质解体,使细胞易于分散,便于压片。解离结束后用蒸馏水淋洗数次。
1.2.4? ? 染色? ? 用改良苯酚品红染色液染色10 min。
1.2.5? ? 压片? ? 切取已染色的根尖分生组织约1.5 mm,盖上盖玻片,在盖玻片上方用手指轻压材料,吸水纸吸干多余染色液,再用铅笔的橡皮头垂直轻敲,使细胞分散。
1.2.6? ? 镜检? ? 根据李懋学等[14 ]提出的标准,寻找30个以上染色体清晰的细胞,统计20倍目镜下各细胞的染色体数目。
2? ?结果与分析
2.1? ?不同预处理对大麦根尖染色体制片的影响
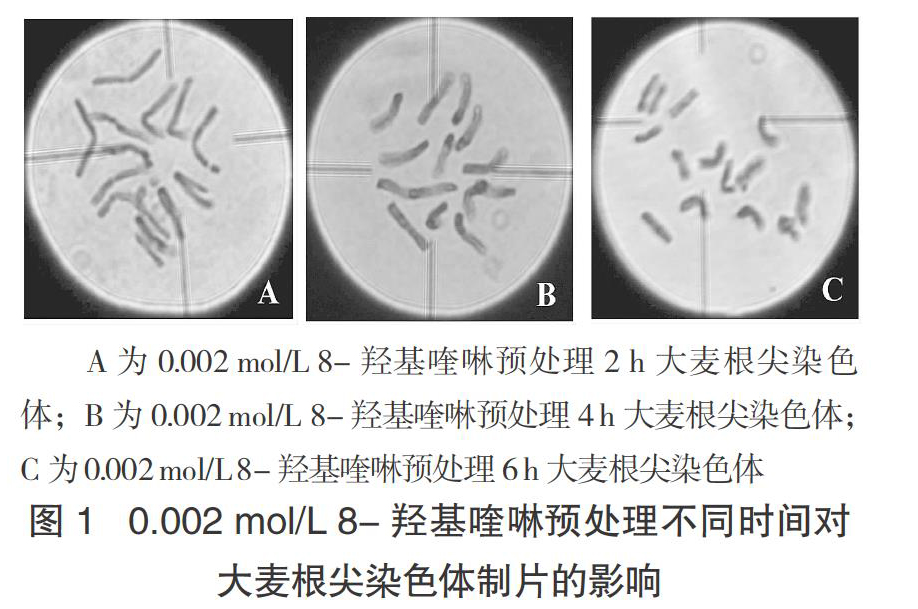
根尖浸入冰水混合物中处理16 h后制片观察,染色体长,且拖尾严重,不利于染色体计数。采用0.002 mol/L 8-羟基喹啉预处理2、4、6 h后,染色体随着处理时间的延长而缩短,无染色体拖尾,易于计数。0.002 mol/L 8-羟基喹啉处理2 h,染色体较长,染色体间分散不理想,易粘连(图1A);0.002 mol/L 8-羟基喹啉预处理4 h,染色体长度适中,染色体分散良好,基本无粘连(图1B);0.002 mol/L 8-羟基喹啉预处理6 h,染色体长度短,染色体间分散好,无粘连,但不适于观察染色体变异。可见大麦根尖预处理采用0.002 mol/L 8-羟基喹啉于4 ℃处理4 h为宜。
2.2? ?解离时间对大麦根尖染色体制片的影响
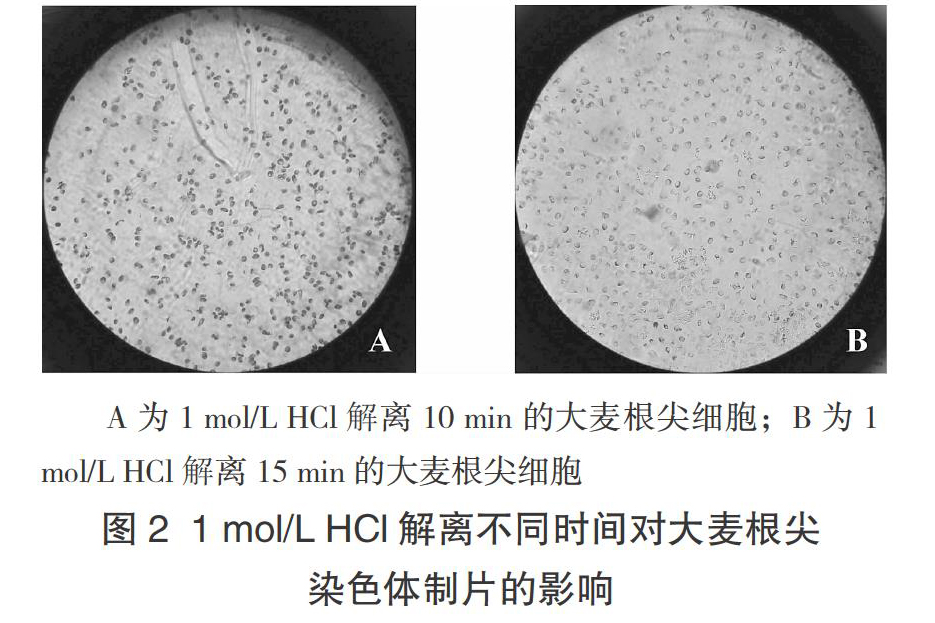
采用1 mol/L HCl 在60 ℃下酸解10 min处理效果较好,单个细胞之间分散好,不易粘连在一起,染色体染色较深,呈深红或紫红色,易于染色体的辨认(图2A)。1 mol/L HCl 在60 ℃下处理5 min,由于细胞解离不充分,细胞不易分散,往往造成许多细胞粘在一起(图略)。1 mol/L HCl 在60 ℃解离15 min和20 min,虽然解离很充分,单个细胞容易分散,但是染色体由于解离时间长,染色体不易被染色(图2B)。可见大麦根尖细胞解离时间10 min为宜。
3? ?球茎大麦法获得植株的根尖细胞染色体计数
李文泽、胡含[15 ]研究了栽培大麦×球茎大麦杂种后代的遗传学后认为,利用栽培大麦和球茎大麦杂交可以获得单倍体、二倍体及混倍体材料。采用改进的大麦染色体压片方法,我们也得到了相同结论。图3为栽培大麦和球茎大麦杂种后代的染色体压片,其中有单倍体(n=7,图3A)、二倍体(n=14,图3B)、混倍体(n=21,图3C;n=6,图3D;n=8,图3E;n=15,图3F)。
4? ?结论与讨论
根尖压片法进行染色体计数,取材是获得良好制片效果的基礎。笔者的试验发现,以大麦根尖为材料,不同个体在24 h内无固定重复出现的细胞分裂高峰时间,这与李瑜[16 ]、王吉明等[17 ] 报道不一致,推测这与实验材料的生长状态有关。处于一定生长时期、生长于大田或花盆的实验材料其细胞分裂与环境温度、光照密切相关,可能有一定的分裂高峰时间存在,但在滤纸上发芽的大麦材料处于恒定的环境(培养箱)中,没有发现其分裂高峰时间的存在。本研究将国外大麦根尖压片常用的冰水混合物处理16 h的预处理方法[3,18 ]与0.002 mol/L 8-羟基喹啉预处理2、4、6 h的效果进行了对比,发现8-羟基喹啉作为预处理试剂,将染色体缩短变直和累积中期染色体的效果优于冰水混合物。
酶解离是针对一些根尖较硬材料的染色体压片或具有小染色体的植物以核型分析和分带为目的时采用的方法,即结束材料的预处理和固定后,用纤维素酶和果胶酶消化细胞壁的纤维素和细胞间的果胶类物质,使染色体充分解离出来。陈瑞阳等[19 ]利用此方法对37科105种植物进行了试验,结果表明,除蕨类和裸子植物未能取得很好的结果外,其他大部分被试材料都取得了良好的结果。本实验材料大麦根尖较软,在以染色体计数为目的,不需要做核型分析时,采用“预处理-固定-解离-染色-压片”方法,可以获得染色体数目清晰的压片,同时可以节约成本和时间,提高工作效率。
再生株染色体倍性的快速、准确鉴定,是关乎到单倍体育种技术的有效利用以及植物细胞遗传学研究、创新种质分析等的重要问题。本研究在遗传学经典实验的基础上,省去了果胶酶和纤维素酶去除植物细胞壁步骤,通过研究预处理方法、解离时间获得了良好的染色体分散相,建立了一种快速、简单的大麦根尖染色体压片方法,大大提高了球茎大麦法获得的杂交后代的倍性鉴定效率。该方法鉴定的球茎大麦法后代植株的倍性已经得到了田间验证,同时也可用于大麦小孢子培养、花粉培养等获得的再生植株的倍性鉴定。
参考文献:
[1] 柳小宁,潘永东,包奇军,等.? 甘肃开发大麦麦绿素的思考[J].? 甘肃农业科技,2016 (10):67-70.
[2] 张正英,李世晓,杨万平,等.? 玉米单倍体化学加倍效果研究[J].? 甘肃农业科技, 2018(4):19-21.
[3] CLAPHAM D.? Haploid Hordeum plants from anthers in vitro [J].? Z. Pflanzenzuecht,1973,
69:142-155.
[4] 袁素霞,刘玉梅,方智远,等.? 甘蓝类蔬菜小孢子再生植株染色体倍性与气孔保卫细胞叶绿体数的相关性[J].? 中国农业科学,2009,
42(1):189-197.
[5] 张菊平,巩振辉,刘珂珂,等.? 辣椒染色体倍性水平的快速检测[J].? 西北农林科技大学学报(自然科学版),2007,35(8):121-124.
[6] 朱惠琴,张宪银,薛庆中.? 烟草染色体倍性快速鉴定方法[J].? 农业生物技术学报,2006,
14(2):255-258.
[7] 介智靖,闫晓红,方小平,等.? 甘蓝型油菜DH植株创建及其倍性的流式鉴定[J].? 中国油料作物学报,2010,32(3):349-353.
[8] 陈? ?斌,赵? ?泓,耿三省.? 辣椒花药培养再生株群体染色体倍性构成的多样性[J].? 华北农学报,2007,22(1):123-128.
[9] 方淑桂,陈文辉,曾小玲,等.? 不同熟性大白菜小孢子植株倍性变异及倍性鉴定方法[J].? 福建农业学报,2009,24(4):304-307.
[10] 齐丽娜,云锦凤,云? ?岚,等.? 二倍体和四倍体新麦草细胞学特性分析[J].? 中国草地学报,2010,32(3):4-9;27.
[11] 伊华林,王利芬,付春华. 柑桔體细胞杂种有性后代倍性鉴定分析[J].? 华中农业大学学报,2000,19(6):589-591.
[12] 伊华林,邓秀新.? 柑橘体细胞杂种有性后代的创造及杂种鉴定[J].? 实验生物学报,2005,
38(3):219-226.
[13] LI M X. Plant chromosome research technology[M].? Harbin:Harbin Northeast Forestry University Publishing House,1991.
[14] 李懋学,陈瑞阳.? 关于植物核型分析的标准化问题[J].? 武汉植物学研究,1995,3(4):297-302.
[15] 李文泽,胡? ?含.? 栽培大麦×球茎大麦杂种后代的遗传学研究[J].? 莱阳农学院学报,1995,12(2):79-83.
[16] 李? ?瑜.? 红芪种子质量标准及染色体核型分析的研究[D].? 兰州:甘肃农业大学,2010.
[17] 王吉明,贺? ?平,马双武,等.? 甜瓜野生近缘植物的染色体计数[J].? 北方园艺,2010(1):66-68.
[18] KASHA K J,KAO K N.? Genetic control of chromosome elimination during haploid formation in barley[J].? Genetics,1975,81:263-275.
[19] 陈瑞阳,宋文芹,李秀兰.? 植物染色体标本制备的去壁、低渗法及其在细胞遗传学中的意义[J].? 遗传学报,1982,9(2):151-159.
(本文责编:杨? ? 杰)

