多指标综合加权评分法优选丹参渗漉提取工艺研究
黄锐 蒲清荣 任桂林 赵剑 杨思进 白雪

摘要:目的 优选丹参乙醇渗漉提取的最佳工艺。方法 以丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I含量,干净膏收率为指标,采用单因素试验和正交试验考察乙醇用量、乙醇浓度、浸泡时间、渗漉速度对丹参渗漉提取工艺的影响。结果 最佳渗漉工艺为丹参粗粉(过3号筛)加入4倍量,95%乙醇,浸泡48h,渗漉速度为每分钟1 mL·min-1。结论 优选的渗漉提取工艺设计合理,可为提取丹参脂溶性成分提供参考。
关键词:丹参;渗漉提取;正交试验;丹参酮ⅡA;二氢丹参酮I;隐丹参酮;丹参酮I
中图分类号:R284.2 文献标志码:A 文章编号:1007-2349(2018)02-0069-04
Study on Optimization of Extraction Technology of Salvia Miltiorrhiza Percolation
by Multi-index Comprehensive Weighting Scoring Method
HUANG Rui, PU Qing-rong, REN Gui-lin, ZHAO Jian, YANG Si-jin, BAI Xue
(The Affiliated Chinese Medicine Hospital of Southwest Medical University, Luzhou 646000, China)
【Abstract】Objective: To optimize the best process of ethanol percolation extraction from Salvia miltiorrhiza. Methods: By taking clean cream yield, the content of tanshinoneⅡA, dihydrotanshinone I, cryptotanshinone and tanshinone as indexes, single factor test and orthogonal test were used to determine the effects of ethanol dosage, ethanol concentration, soaking time and percolation speed on the extraction process of Salvia miltiorrhiza. Results: The optimum percolation process was to add 4 times amount of Salvia miltiorrhiza middlings (sieve No.3) and the 95% of ethanol, and soak for 48 hours. The percolation speed was 1 mL·min-1 per minute. Conclusion: The optimal percolation extraction process is reasonable and can provide reference for the extraction of fat-soluble components of Salvia miltiorrhiza.
【Key words】Salviae miltiorrhizae, percolation extraction, orthogonal test, tanshinoneⅡA, dihydrotanshinone I, cryptotanshinone, tanshinone I
丹参为唇形科植物丹参Salvia miltiorhiza的干燥根及根茎,是临床心血管最常用的中药之一。具有活血祛瘀,通经止痛,清心除烦,凉血消痈之功效[1]。丹参所含有效成分有水溶性和脂溶性两大类,丹参脂溶性有效部位主要是以丹参酮I,丹参酮ⅡA,二氢丹参酮I,隐丹参酮,异丹参酮为代表的二萜蒽醌类成分,具有扩张血管,改善微循环,抗动脉粥样硬化[2],减轻缺氧引起的心肌损伤,促进心肌再生[3],抑制血小板凝集,降低全血和血浆黏度等[4]药理作用。相关文献报道[5-8],丹参醇提工艺相对比较简单,多以丹参酮ⅡA为单一评价指标。本研究采用乙醇作为溶剂,以脂溶性成分丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I,干浸膏收率作为考察指标,通过单因素试验和正交试验优选丹参的渗漉工艺,为提取丹参脂溶性成分提供依据。
1 仪器与试药
1.1 仪器 日本岛津高效液相色谱仪(LC-20AT泵、SPD20A检测器、CTO-10AS进样器、LcSolution色谱工作站);AUW120D电子天平(日本岛津);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);HH数显电热恒温水浴箱(江苏国胜实验仪器厂);JP全数字超声波发生器(武汉嘉鹏电子有限公司);BO-200T多功能粉碎机(永康铂欧五金厂);101-2AB电热鼓风干燥箱(杭州汇尔仪器服务有限公司)。
1.2 试药 甲醇为色谱纯(美国Fisher公司);无水乙醇,乙醇(95%)为分析纯(重庆川东化工集团有限公司);水为哇哈哈纯净水;对照品隐丹参酮(批号:110852-200806),丹参酮I(批号:110867-200406),丹参酮ⅡA(批号:110766-200619),均购自中国食品药品检定研究院。二氢丹参酮I(批号:140920),购自北京更新生物科技有限公司。丹参(批号:141020,购自泸州天植中药饮片有限公司,經西南医科大学附属中医医院制剂室赵剑主任中药师鉴定为唇形科植物丹参Savia miltiorrhiza Bge.的干燥根和根茎,符合中国药典2015年版一部该药材项下规定。)。
2 方法与结果
2.1 指标成分的含量测定
2.1.1 色谱条件 色谱柱Kromasil 100-5 C18柱(250 mm×4.6 mm,5 μm);流动相:以乙腈为流动相A,0.03%磷酸为流动相B,梯度洗脱(0-20min,20%A→60%A;20-120min,60%A→75%A)[9-10],流速1.0 mL/min,柱温40℃,检测波长270 nm,进样量10 μL。
2.1.2 混合对照品溶液的制备 精密称取二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA的对照品适量,置棕色容量瓶中,加甲醇制成浓度为30.0,71.4,43.2,111.8 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备 取试验工艺中渗漉液,用对应浓度的乙醇,定容至500 mL,摇匀,用0.45 μm微孔滤膜滤过,即得。
2.1.4 线性关系考察 取“2.1.2”项下混合对照品溶液0.5,1.0,2.0,3.0,4.0,5.0 mL分别于10 mL棕色容量瓶中,加甲醇定容,将上述6种混合溶液以及对照品混合溶液,取10 μL注入液相色谱仪,按照“2.1.1”项下色谱条件进行试验,记录峰面积。以对照品的浓度X(μg/mL)为横坐标,峰面积的积分值Y为纵坐标,绘制标准曲线,得二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA回归方程分别为:y=3.099×104x-3.303×103,y=6.120×104x-1.017×104,y=2.647×104x-8.523×104,y=5.805×104x-1.027×104;线性范围分别为1.5~30,3.57~71.4,2.16~43.2,5.59~111.8 μg/mL;RSD分别为:0.9995,0.9996,0.9999,0.9996;均呈良好的线性关系。
2.1.5 样品测定 取每个因素的样品2份,按照“2.1.3”项下制备供试品溶液。分别精密吸取混合对照品溶液10 μL,供试品溶液10 μL,按照“2.1.1”项下色谱条件进行测定。对照品,样品色谱图见图1。
2.2 综合评分 以二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA的含量、干净膏收率为 综合指标(overall desirability OD)进行直观分析和方差分析[11-13]。各指标综合评分方程:di=Yi/Ai(di为各指标的综合评分值;Yi为各试验中各指标的实测值;Ai为试验中各指标中相应的最大值)。因丹参酮ⅡA是丹参醇提部分中最主要的有效成分,二氢丹参酮I,隐丹参酮,丹参酮I为相对次要的有效成分,故分别记30,20,20,20%,干浸膏收率为辅助考察指标记10%。将每次试验的各指标成分的综合评分值,乘以加权系数后求和,按“综合评分=di(丹参酮ⅡA相对含量)×30%+di(丹参酮I)×20%+di(隐丹参酮)×20%+di(二氢丹参酮I)×20%+di(干浸膏收率)×10%”即为综合评分值。
2.3 干浸膏收率的测定 精密称取丹参药材48 g,加入一定浓度和体积的乙醇溶液进行渗漉,渗漉液定容至500 mL,精密量取50 mL渗漉液,减压浓缩至稠膏,置真空干燥箱中干燥,得到干浸膏,精密称定,计算干浸膏收率。干浸膏收率=W干*(500/50)/W。W干为干浸膏重量,W为丹参药材重量。
2.4 单因素试验 选取醇浓度、药材粗细度、提取方法3个影响因素对丹参酮提取率进行单因素考察。
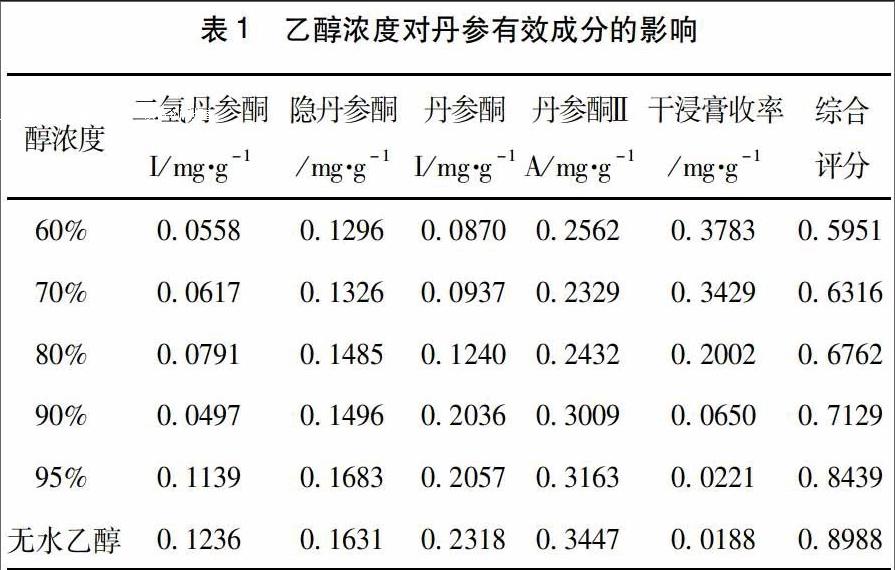
2.4.1 乙醇浓度考察 称取丹参药材48 g,分别以60,70,80,90,95%和无水乙醇作为提取溶剂,浸润24 h,溶剂用量8倍,渗漉流速2 mL/min,收集渗漉液。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:无水乙醇>95>90>80>70>60%,见表1。
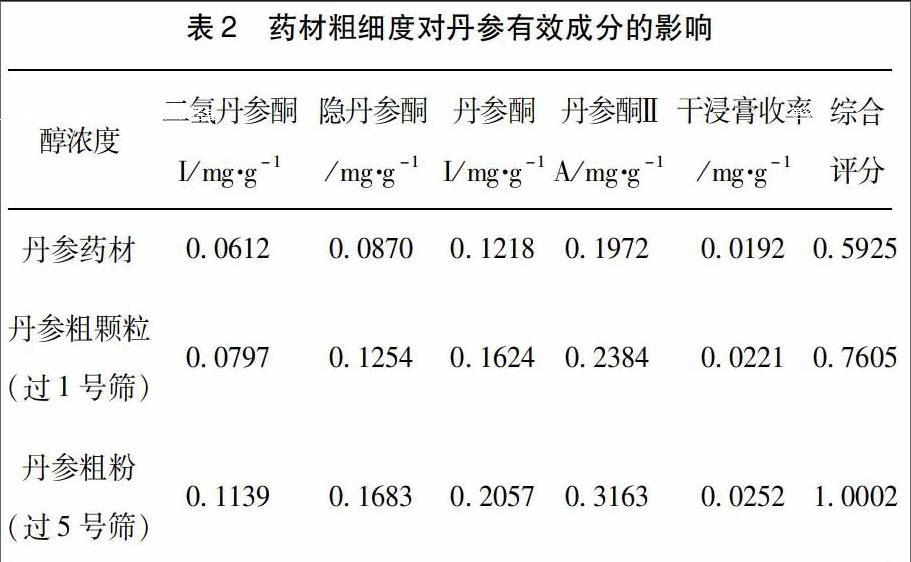
2.4.2 药材粗细度考察 称取丹参药材,丹参粗颗粒(过1号筛),丹参粗粉(过3号筛)各48 g,浸润24 h,溶剂用量8倍,渗漉流速2 mL/min,收集渗漉液。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:丹参粗粉(过5号筛)>丹参粗颗粒(过1号筛)>丹参药材,见表2。
2.4.3 提取方法考察 称取丹参药材48 g,分别以回流法,超声法,渗漉法作为提取方法,浸泡24h,溶剂容量8倍,进行相应提取,提取液定容至500 mL。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:回流法>渗漉法>超声法,各个指标成分值回流法和渗漉法相差不大,从实际生产考虑,渗漉法提取相对安全,利于生产,因此采用渗漉 法提取丹参脂溶性有效部位,見表3。
2.5 正交试验优化设计及结果 根据单因素试验的结果,将丹参药材粉粹成粗粉(过3号筛),精密称取18份,每份48 g,采用四因素三水平L9(34)正交试验,以丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I的量、干净膏收率为指标,对乙醇用量(A)、乙醇浓度(B)、浸泡时间(C)、渗漉速度(D)等条件进一步优化,试验设计和结果见表4、5,方差分析见表6。
表5表明,以丹参脂溶性有效部位和干浸膏收率的综合评分值为评价指标,4个因素对提取效果影响顺序为渗漉速度>乙醇浓度>浸泡时间>乙醇用量,最佳提取工艺为A1B1C3D1,即加入4倍量,乙醇浓度95%,浸泡48h,渗漉速度为每分钟1 mL·min-1。表6方差分析结果可知,渗漉速度具有显著性差异,其他因素对收膏率和丹参脂溶性有效部位提取的影响都不显著。
2.6 验证试验 称取同一批丹参粗粉(过3号筛),按综合评分法优选的最佳工艺A1B1C3D1进行试验,收膏率和丹参脂溶性有效部位的综合评分值分别为0.9031,0.9029,0.8925。结果表明,验证试验各指标性成分均处于较高水平,符合含丹参制剂的生产需要。
3 讨论
3.1 优选色谱条件 选取同时测定二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA4种丹参脂溶性成分的色谱条件,主要考察流动相:乙腈-0.02%磷酸溶液,乙腈-0.026%磷酸溶液,乙腈-0.03%磷酸溶液;梯度洗脱时间(0-20min,20%A→60%A,20-50min,60%A→80%A),(0-20min,20%A→60%A,20-80min,60%A→80%A),(0-20min,20%A→60%A,20-120min,60%A→80%A),(0-20min,20%A→60%A,20-120min,60%A→75%A);以及流速:0.8,0.9,1.0 mL/min。結果流动相A为乙腈-B为0.03%磷酸溶液,梯度洗脱(0-20min,20%A→60%A,20-120min,60%A→75%A),流速1.0 mL/min所得的色谱图隐丹参酮,丹参酮I的分离效果最佳。
3.2 优选提取因素 根据相关文献报道[6-8],丹参渗漉工艺大多以丹参酮ⅡA为指标进行工艺优化,优选出的乙醇浓度有90%,95%,与课题组进行乙醇浓度因素筛选的实验结果相符,乙醇浓度越高,脂溶性成分丹参酮类越多,根据实际生产需要,我们把乙醇浓度定为95%。以二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA4种丹参脂溶性成分的量及干浸膏收率为指标优选工艺,4倍乙醇用量有别于以往文献报道乙醇用量(10倍,12倍,16倍),可为提取丹参脂溶性成分节约成本。
3.3 样品处理 有效成分的测定收集渗漉液用相应溶剂定容后直接进样,避免了挥干乙醇后再加甲醇溶解定容其间的系统误差或温度对丹参酮类有效成分的破坏,增加了测定的准确性。
3.4 结论 课题组通过单因素试验及正交试验优化设计相结合,逐级优化提取条件,提出丹参渗漉的最佳工艺为丹参粗粉(过3号筛)加入4倍量,乙醇浓度95%,浸泡48h,渗漉速度为每分钟1 mL·min-1,可作为提取丹参脂溶性成分提供参考。
参考文献:
[1]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:76.
[2]张建永;王岚;梁日欣,等.基于网络药理学分析丹参山楂组分配伍抗动脉粥样硬化的作用机制研究[J].中国中药杂志,2016,41(23):4408-4415.
[3]李春霞,余洁,陆远富,等.丹参酮类心脑血管保护作用与机制的研究进展[J].中国新药与临床杂志,2016,35(8):542-546.
[4]王怡,高秀梅,邢永发,等.丹参酚酸B、丹参酮治疗心血管疾病的药理学研究进展[J].上海中医药杂志,2010,44(7):82-87.
[5]韩晓珂,刘汉清,张 明,等.渗漉法和回流法提取丹参药渣中脂溶性成分的比较研究[J].现代中药研究与实践,2009,23(1):61-63.
[6]李 威,杜文彬,张勇钢.正交设计优化丹参渗漉工艺[J].辽宁中医药大学学报,2007,9(5):164-165.
[7]刘少文.梯度渗漉法提取丹参有效成分的工艺[J].中国医药指南,2012,10(10):36-37.
[8]凃乾,邢燕玲,陈科力,等.丹参醇提工艺研究及对丹参中水溶性成分的影响[J].时珍国医国药,2015,26(3):623-625.
[9]程沛,韩东岐,胡伟慧,等.高效液相色谱法同时测定丹参中10种水溶性和4 种脂溶性成分的含量[J].药物分析杂志,2015,35(6):991-996.
[10]尉广飞,李翠,刘谦,等.丹参根部直径与其活性成分含有量间的相关性研究[J].中成药,2015,37(8):1780-1784.
[11]蒲清荣,黄锐,赵剑,等.多指标综合评分法优选丹参饮口服液助悬工艺[J].中国医院药学杂志,2013,33(12):14-18.
[12]王雪,焦连庆,于敏,等.多指标综合加权评分法优选五味子与丹参混合醇提工艺研究[J].中草药,2015,46(7):998-1001.
[13]袁 佳,李页瑞,陈 勇,等.多指标正交设计优选丹参水提液醇沉工艺[J].中国医药工业杂志社,2010,41(11):826-829.



摘要:目的 优选丹参乙醇渗漉提取的最佳工艺。方法 以丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I含量,干净膏收率为指标,采用单因素试验和正交试验考察乙醇用量、乙醇浓度、浸泡时间、渗漉速度对丹参渗漉提取工艺的影响。结果 最佳渗漉工艺为丹参粗粉(过3号筛)加入4倍量,95%乙醇,浸泡48h,渗漉速度为每分钟1 mL·min-1。结论 优选的渗漉提取工艺设计合理,可为提取丹参脂溶性成分提供参考。
关键词:丹参;渗漉提取;正交试验;丹参酮ⅡA;二氢丹参酮I;隐丹参酮;丹参酮I
中图分类号:R284.2 文献标志码:A 文章编号:1007-2349(2018)02-0069-04
Study on Optimization of Extraction Technology of Salvia Miltiorrhiza Percolation
by Multi-index Comprehensive Weighting Scoring Method
HUANG Rui, PU Qing-rong, REN Gui-lin, ZHAO Jian, YANG Si-jin, BAI Xue
(The Affiliated Chinese Medicine Hospital of Southwest Medical University, Luzhou 646000, China)
【Abstract】Objective: To optimize the best process of ethanol percolation extraction from Salvia miltiorrhiza. Methods: By taking clean cream yield, the content of tanshinoneⅡA, dihydrotanshinone I, cryptotanshinone and tanshinone as indexes, single factor test and orthogonal test were used to determine the effects of ethanol dosage, ethanol concentration, soaking time and percolation speed on the extraction process of Salvia miltiorrhiza. Results: The optimum percolation process was to add 4 times amount of Salvia miltiorrhiza middlings (sieve No.3) and the 95% of ethanol, and soak for 48 hours. The percolation speed was 1 mL·min-1 per minute. Conclusion: The optimal percolation extraction process is reasonable and can provide reference for the extraction of fat-soluble components of Salvia miltiorrhiza.
【Key words】Salviae miltiorrhizae, percolation extraction, orthogonal test, tanshinoneⅡA, dihydrotanshinone I, cryptotanshinone, tanshinone I
丹参为唇形科植物丹参Salvia miltiorhiza的干燥根及根茎,是临床心血管最常用的中药之一。具有活血祛瘀,通经止痛,清心除烦,凉血消痈之功效[1]。丹参所含有效成分有水溶性和脂溶性两大类,丹参脂溶性有效部位主要是以丹参酮I,丹参酮ⅡA,二氢丹参酮I,隐丹参酮,异丹参酮为代表的二萜蒽醌类成分,具有扩张血管,改善微循环,抗动脉粥样硬化[2],减轻缺氧引起的心肌损伤,促进心肌再生[3],抑制血小板凝集,降低全血和血浆黏度等[4]药理作用。相关文献报道[5-8],丹参醇提工艺相对比较简单,多以丹参酮ⅡA为单一评价指标。本研究采用乙醇作为溶剂,以脂溶性成分丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I,干浸膏收率作为考察指标,通过单因素试验和正交试验优选丹参的渗漉工艺,为提取丹参脂溶性成分提供依据。
1 仪器与试药
1.1 仪器 日本岛津高效液相色谱仪(LC-20AT泵、SPD20A检测器、CTO-10AS进样器、LcSolution色谱工作站);AUW120D电子天平(日本岛津);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);HH数显电热恒温水浴箱(江苏国胜实验仪器厂);JP全数字超声波发生器(武汉嘉鹏电子有限公司);BO-200T多功能粉碎机(永康铂欧五金厂);101-2AB电热鼓风干燥箱(杭州汇尔仪器服务有限公司)。
1.2 试药 甲醇为色谱纯(美国Fisher公司);无水乙醇,乙醇(95%)为分析纯(重庆川东化工集团有限公司);水为哇哈哈纯净水;对照品隐丹参酮(批号:110852-200806),丹参酮I(批号:110867-200406),丹参酮ⅡA(批号:110766-200619),均购自中国食品药品检定研究院。二氢丹参酮I(批号:140920),购自北京更新生物科技有限公司。丹参(批号:141020,购自泸州天植中药饮片有限公司,經西南医科大学附属中医医院制剂室赵剑主任中药师鉴定为唇形科植物丹参Savia miltiorrhiza Bge.的干燥根和根茎,符合中国药典2015年版一部该药材项下规定。)。
2 方法与结果
2.1 指标成分的含量测定
2.1.1 色谱条件 色谱柱Kromasil 100-5 C18柱(250 mm×4.6 mm,5 μm);流动相:以乙腈为流动相A,0.03%磷酸为流动相B,梯度洗脱(0-20min,20%A→60%A;20-120min,60%A→75%A)[9-10],流速1.0 mL/min,柱温40℃,检测波长270 nm,进样量10 μL。
2.1.2 混合对照品溶液的制备 精密称取二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA的对照品适量,置棕色容量瓶中,加甲醇制成浓度为30.0,71.4,43.2,111.8 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备 取试验工艺中渗漉液,用对应浓度的乙醇,定容至500 mL,摇匀,用0.45 μm微孔滤膜滤过,即得。
2.1.4 线性关系考察 取“2.1.2”项下混合对照品溶液0.5,1.0,2.0,3.0,4.0,5.0 mL分别于10 mL棕色容量瓶中,加甲醇定容,将上述6种混合溶液以及对照品混合溶液,取10 μL注入液相色谱仪,按照“2.1.1”项下色谱条件进行试验,记录峰面积。以对照品的浓度X(μg/mL)为横坐标,峰面积的积分值Y为纵坐标,绘制标准曲线,得二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA回归方程分别为:y=3.099×104x-3.303×103,y=6.120×104x-1.017×104,y=2.647×104x-8.523×104,y=5.805×104x-1.027×104;线性范围分别为1.5~30,3.57~71.4,2.16~43.2,5.59~111.8 μg/mL;RSD分别为:0.9995,0.9996,0.9999,0.9996;均呈良好的线性关系。
2.1.5 样品测定 取每个因素的样品2份,按照“2.1.3”项下制备供试品溶液。分别精密吸取混合对照品溶液10 μL,供试品溶液10 μL,按照“2.1.1”项下色谱条件进行测定。对照品,样品色谱图见图1。
2.2 综合评分 以二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA的含量、干净膏收率为 综合指标(overall desirability OD)进行直观分析和方差分析[11-13]。各指标综合评分方程:di=Yi/Ai(di为各指标的综合评分值;Yi为各试验中各指标的实测值;Ai为试验中各指标中相应的最大值)。因丹参酮ⅡA是丹参醇提部分中最主要的有效成分,二氢丹参酮I,隐丹参酮,丹参酮I为相对次要的有效成分,故分别记30,20,20,20%,干浸膏收率为辅助考察指标记10%。将每次试验的各指标成分的综合评分值,乘以加权系数后求和,按“综合评分=di(丹参酮ⅡA相对含量)×30%+di(丹参酮I)×20%+di(隐丹参酮)×20%+di(二氢丹参酮I)×20%+di(干浸膏收率)×10%”即为综合评分值。
2.3 干浸膏收率的测定 精密称取丹参药材48 g,加入一定浓度和体积的乙醇溶液进行渗漉,渗漉液定容至500 mL,精密量取50 mL渗漉液,减压浓缩至稠膏,置真空干燥箱中干燥,得到干浸膏,精密称定,计算干浸膏收率。干浸膏收率=W干*(500/50)/W。W干为干浸膏重量,W为丹参药材重量。
2.4 单因素试验 选取醇浓度、药材粗细度、提取方法3个影响因素对丹参酮提取率进行单因素考察。
2.4.1 乙醇浓度考察 称取丹参药材48 g,分别以60,70,80,90,95%和无水乙醇作为提取溶剂,浸润24 h,溶剂用量8倍,渗漉流速2 mL/min,收集渗漉液。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:无水乙醇>95>90>80>70>60%,见表1。
2.4.2 药材粗细度考察 称取丹参药材,丹参粗颗粒(过1号筛),丹参粗粉(过3号筛)各48 g,浸润24 h,溶剂用量8倍,渗漉流速2 mL/min,收集渗漉液。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:丹参粗粉(过5号筛)>丹参粗颗粒(过1号筛)>丹参药材,见表2。
2.4.3 提取方法考察 称取丹参药材48 g,分别以回流法,超声法,渗漉法作为提取方法,浸泡24h,溶剂容量8倍,进行相应提取,提取液定容至500 mL。按2.3项下方法测定干净膏收率。按2.1项下方法测定各指标成分含量,计算各指标成分相对含量及综合评分。结果综合评分值:回流法>渗漉法>超声法,各个指标成分值回流法和渗漉法相差不大,从实际生产考虑,渗漉法提取相对安全,利于生产,因此采用渗漉 法提取丹参脂溶性有效部位,見表3。
2.5 正交试验优化设计及结果 根据单因素试验的结果,将丹参药材粉粹成粗粉(过3号筛),精密称取18份,每份48 g,采用四因素三水平L9(34)正交试验,以丹参酮ⅡA,二氢丹参酮I,隐丹参酮,丹参酮I的量、干净膏收率为指标,对乙醇用量(A)、乙醇浓度(B)、浸泡时间(C)、渗漉速度(D)等条件进一步优化,试验设计和结果见表4、5,方差分析见表6。
表5表明,以丹参脂溶性有效部位和干浸膏收率的综合评分值为评价指标,4个因素对提取效果影响顺序为渗漉速度>乙醇浓度>浸泡时间>乙醇用量,最佳提取工艺为A1B1C3D1,即加入4倍量,乙醇浓度95%,浸泡48h,渗漉速度为每分钟1 mL·min-1。表6方差分析结果可知,渗漉速度具有显著性差异,其他因素对收膏率和丹参脂溶性有效部位提取的影响都不显著。
2.6 验证试验 称取同一批丹参粗粉(过3号筛),按综合评分法优选的最佳工艺A1B1C3D1进行试验,收膏率和丹参脂溶性有效部位的综合评分值分别为0.9031,0.9029,0.8925。结果表明,验证试验各指标性成分均处于较高水平,符合含丹参制剂的生产需要。
3 讨论
3.1 优选色谱条件 选取同时测定二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA4种丹参脂溶性成分的色谱条件,主要考察流动相:乙腈-0.02%磷酸溶液,乙腈-0.026%磷酸溶液,乙腈-0.03%磷酸溶液;梯度洗脱时间(0-20min,20%A→60%A,20-50min,60%A→80%A),(0-20min,20%A→60%A,20-80min,60%A→80%A),(0-20min,20%A→60%A,20-120min,60%A→80%A),(0-20min,20%A→60%A,20-120min,60%A→75%A);以及流速:0.8,0.9,1.0 mL/min。結果流动相A为乙腈-B为0.03%磷酸溶液,梯度洗脱(0-20min,20%A→60%A,20-120min,60%A→75%A),流速1.0 mL/min所得的色谱图隐丹参酮,丹参酮I的分离效果最佳。
3.2 优选提取因素 根据相关文献报道[6-8],丹参渗漉工艺大多以丹参酮ⅡA为指标进行工艺优化,优选出的乙醇浓度有90%,95%,与课题组进行乙醇浓度因素筛选的实验结果相符,乙醇浓度越高,脂溶性成分丹参酮类越多,根据实际生产需要,我们把乙醇浓度定为95%。以二氢丹参酮I,隐丹参酮,丹参酮I,丹参酮ⅡA4种丹参脂溶性成分的量及干浸膏收率为指标优选工艺,4倍乙醇用量有别于以往文献报道乙醇用量(10倍,12倍,16倍),可为提取丹参脂溶性成分节约成本。
3.3 样品处理 有效成分的测定收集渗漉液用相应溶剂定容后直接进样,避免了挥干乙醇后再加甲醇溶解定容其间的系统误差或温度对丹参酮类有效成分的破坏,增加了测定的准确性。
3.4 结论 课题组通过单因素试验及正交试验优化设计相结合,逐级优化提取条件,提出丹参渗漉的最佳工艺为丹参粗粉(过3号筛)加入4倍量,乙醇浓度95%,浸泡48h,渗漉速度为每分钟1 mL·min-1,可作为提取丹参脂溶性成分提供参考。
参考文献:
[1]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:76.
[2]张建永;王岚;梁日欣,等.基于网络药理学分析丹参山楂组分配伍抗动脉粥样硬化的作用机制研究[J].中国中药杂志,2016,41(23):4408-4415.
[3]李春霞,余洁,陆远富,等.丹参酮类心脑血管保护作用与机制的研究进展[J].中国新药与临床杂志,2016,35(8):542-546.
[4]王怡,高秀梅,邢永发,等.丹参酚酸B、丹参酮治疗心血管疾病的药理学研究进展[J].上海中医药杂志,2010,44(7):82-87.
[5]韩晓珂,刘汉清,张 明,等.渗漉法和回流法提取丹参药渣中脂溶性成分的比较研究[J].现代中药研究与实践,2009,23(1):61-63.
[6]李 威,杜文彬,张勇钢.正交设计优化丹参渗漉工艺[J].辽宁中医药大学学报,2007,9(5):164-165.
[7]刘少文.梯度渗漉法提取丹参有效成分的工艺[J].中国医药指南,2012,10(10):36-37.
[8]凃乾,邢燕玲,陈科力,等.丹参醇提工艺研究及对丹参中水溶性成分的影响[J].时珍国医国药,2015,26(3):623-625.
[9]程沛,韩东岐,胡伟慧,等.高效液相色谱法同时测定丹参中10种水溶性和4 种脂溶性成分的含量[J].药物分析杂志,2015,35(6):991-996.
[10]尉广飞,李翠,刘谦,等.丹参根部直径与其活性成分含有量间的相关性研究[J].中成药,2015,37(8):1780-1784.
[11]蒲清荣,黄锐,赵剑,等.多指标综合评分法优选丹参饮口服液助悬工艺[J].中国医院药学杂志,2013,33(12):14-18.
[12]王雪,焦连庆,于敏,等.多指标综合加权评分法优选五味子与丹参混合醇提工艺研究[J].中草药,2015,46(7):998-1001.
[13]袁 佳,李页瑞,陈 勇,等.多指标正交设计优选丹参水提液醇沉工艺[J].中国医药工业杂志社,2010,41(11):826-829.

