辣椒耐热基因的AFLP分析
何铁光等
摘 要:用辣椒耐热自交系A11和热敏自交系B22配置杂交组合,通过高温胁迫处理鉴定其F2代分离群体的耐热性。从123对Taq I/Ase I引物组合中筛选出6对多态性好的引物对F2代耐热、热敏植株进行AFLP分析,共扩增出约11 400条清晰条带,其中2条为稳定的差异,初步获得了2个与辣椒耐热性状相关的AFLP分子标记。研究有助于开展辣椒耐热基因的分子标记辅助选择工作,提高辣椒育种效率和水平,并为分离和克隆辣椒耐热相关功能基因奠定基础。
关键词:辣椒;耐热基因;AFLP分析
中图分类号:Q785;S641.3 文献标识码:A 文章编号:1001-3547(2014)04-0024-03
辣椒(Capsicum annuum L.)原产于中南美洲,属于茄科(Solanaceac)辣椒属(Capsicum)。辣椒是重要蔬菜作物,在世界各地广泛栽培,因其营养丰富、富含维生素C等营养物质而深受人们喜爱[1]。我国是世界辣椒种植面积最大的国家,国内的种植面积仅次于大白菜,属于第二大蔬菜作物。近年来,辣椒在华南地区也有了较大的种植面积,但广西、海南等省份地处热带、亚热带地区,四季高温多雨,对辣椒的生长发育造成了极大的影响,当气温高于35℃时,辣椒开花及结实均受到了明显的影响,大大降低了辣椒的品质和产量。近10多a来,已有不少学者对高温胁迫下辣椒的植株形态、生理生化指标进行了研究,但从分子水平系统研究辣椒耐热特性的报道较少[2~6]。本研究以辣椒耐热高代自交系A11与辣椒热敏高代自交系B22杂交的F2代植株为材料,进行了耐高温胁迫后,选择耐热和热敏的植株进行AFLP分析,寻找与辣椒耐热性状相关的分子标记,为辣椒耐热相关功能基因的克隆分析及进行分子标记辅助育种提供基础。
1 材料与方法
1.1 试验材料
植物材料为辣椒耐热高代自交系A11与辣椒热敏高代自交系B22杂交的F2代植株,采用大棚栽培和人工气候箱盆栽方式种植。试验所需生化试剂、酶类购自南宁宏泰、Fermentas公司及New Englad公司。AFLP分析所用接头和引物由捷瑞公司合成,相关信息如下。
Ase I 接头序列:5'-TAGGTACGCAGTCTAC-3'; 5'-CTCGTAGACTGCGTACC-3';Ase I 预扩增引物序列:5'-CTCGTAGACTGCGTACCTAAT-3';Ase I 选择性扩增引物序列:5'-GACTGCGTACCTAATNNN-3', N 为A、T、C、G 碱基的任意一种。Taq I 接头序列:5'-GACGATGAGTCCTGAC-3';5'-CGGTCAGGACTCAT-3';Taq I 预扩增引物序列:5'-GACGATGAGTCCTGACCGA-3';Taq I 选择性扩增引物序列:5'-GATGAGTCCTGACCGANNN-3',N 为A、T、C、G 碱基的任意一种。
1.2 辣椒叶片总DNA的提取及酶切反应
利用改良SDS法小量提取F2代耐热及热敏辣椒植株叶片的总DNA,对所提取的总DNA分别进行抽提纯化和电泳检测。
利用限制性内切酶Taq I和Ase I对总DNA进行酶切反应,酶切产物回收纯化后备用。
1.3 接头退火及连接反应
Ase I接头和Taq I接头退火,然后与DNA双酶切反应产物于16℃连接过夜,连接产物保存于
-20℃冰箱备用。
1.4 AFLP 分析
①预扩增反应 分别以所有样品的连接产物为模板,用与Taq I接头、Ase I接头匹配的预扩增引物进行预扩增反应,反应程序是94℃ 5 min、94℃ 80 s、52℃ 60 s、72℃ 90 s,20个循环;72℃ 10 min。预扩增产物按需要进行不同倍数的稀释备用。
②选择性扩增 预扩增产物分别稀释成5倍、10倍、15倍和20倍的工作用液,筛选合适的扩增模板浓度。利用选择性扩增引物对A11、B22杂交F2代辣椒植株进行AFLP分析,94℃ 3 min;94℃ 80 s,65℃ 60 s,72℃ 90 s,每循环退火温度下降0.7℃,反应12个循环;然后94℃ 3 min;94℃ 80 s,56℃ 60 s,72℃ 90 s,23个循环;延伸72℃ 10 min。
③电泳检测 配制6%丙烯酰胺变性凝胶,电泳及银染参照王关林等[7]的方法。
2 结果与分析
2.1 辣椒叶片总DNA的提取
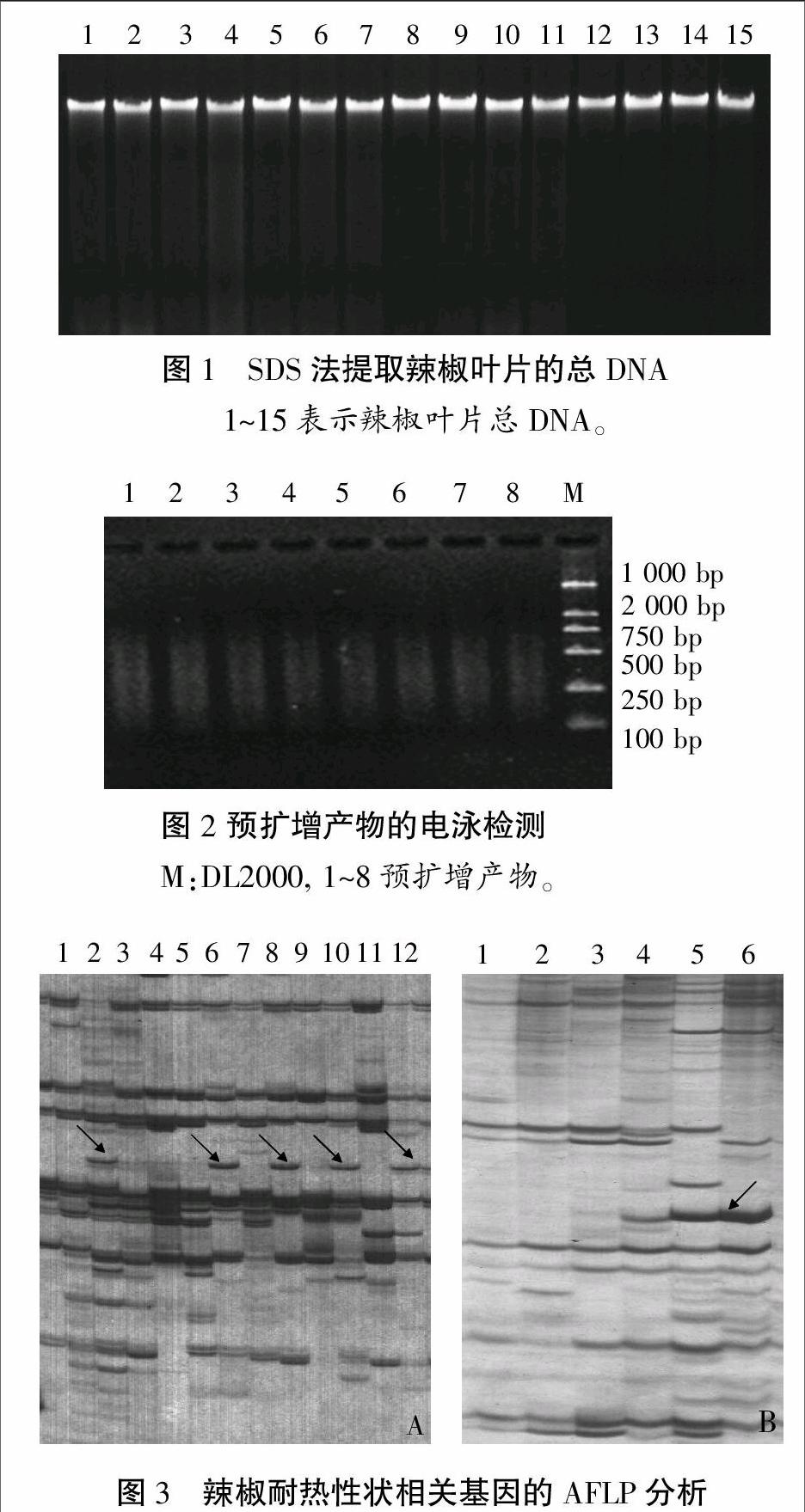
用SDS法从辣椒叶片中提取的总DNA的OD260/OD280比值在1.8左右,在1%的琼脂糖凝胶中样品带清楚、凝胶背景清晰(图1),经过RNase A处理和酚/氯仿抽提后适用于酶切、连接等试验。
2.2 AFLP反应体系的建立
在预扩增反应中,进行浓度测定,根据浓度的大小稀释10~20倍后用作AFLP预扩增的模板,进行预扩增条件优化研究。结果表明,以连接产物的10倍稀释液为模板,扩增20循环的效果最好,预扩增产物主要集中在100~750 bp(图2)。
选择性扩增以预扩增产物稀释15倍为模板,扩增约35个循环效果较好(包括降落PCR部分)。循环数少,获得的扩增产物浓度低,在变性聚丙烯酰胺凝胶中条带颜色较浅,通过延长显色时间可以增加条带的清晰度,但是也导致了凝胶背景增加;循环数过多时扩增产物的浓度过高和非特异条带增多,变性凝胶中模糊的弱条带增多,重复效果不稳定。
2.3 辣椒耐热基因的AFLP分析
本研究利用123对引物组合对辣椒耐热、热敏基因池进行了引物筛选,从中选择6对多态性较好的引物组合对辣椒F2代植株进行AFLP分析。聚丙烯酰胺变性凝胶电泳结果显示,每个样品的扩增条带多数在30~70条,获得11 400条稳定、清晰条带。其中A8T19和A12T15引物组合的扩增结果中,耐热辣椒品种中分别出现1条稳定的差异条带,推断该差异条带与辣椒耐热性状相关,至于确切关系还有待进一步分析验证。
3 讨论与结论
AFLP分析多态性丰富、灵敏度高、重复性好[8,9],在植物分子标记研究中应用广泛,但DNA模板的质量高低及银染操作水平均对其分析结果产生重要影响,尤其在银染中无水碳酸钠(Na2CO3)质量、漂洗操作及显色时间的控制对条带的清晰度和凝胶的背景的影响尤为突出[10]。
辣椒材料的高温胁迫试验结果的判定对利用AFLP技术分析辣椒耐热性状相关基因的结果有十分重要的影响。本研究的高温胁迫试验中,在42℃、相对湿度75%的条件下保持一定时间后,根据辣椒植株的形态特征去判定F2代植株的耐热性,主观的判定标准会对AFLP分析结果产生影响;如能结合分析高温胁迫下辣椒的生理生化指标,可以提高判定F2代植株的耐热、热敏性的准确性[11]。在AFLP分析中耐热、热敏辣椒材料之间的差异条带是否与耐热性状相关或连锁还需要进一步的回收克隆及进行功能分析来加以确定。
参考文献
[1] 顾晓慧.与辣椒抗根结线虫N基因紧密连锁的AFLP标记的开发[D].呼和浩特:内蒙古农业大学,2006.
[2] 金新文,沈征言.高温胁迫下三种蔬菜抗热性不同的品种间叶片蒸腾强度作用的比较[J].石河子大学学报:自然科学版,1997,1(3):195-198.
[3] 姚元干,石雪晖,杨建国,等.辣椒叶片耐热性生理生化指标探讨[J].湖南农业大学学报,1998,24(2):119-122.
[4] 贾志银,巩振辉,许红娟,等.高温胁迫对辣椒幼苗生长及生理性状的影响[J].北方园艺,2010(12):5-8.
[5] 姚元干,石雪晖,杨建国,等.辣椒耐热性与叶片质膜透性及几种生化物质含量的关系[J].湖南农业大学学报,2000,26(2):97-99.
[6] 徐小万,雷建军,罗少波,等.高温高湿对现蕾期辣椒不同品种抗氧化性差异研究[J].核农学报,2010,24(2):394-400.
[7] 王关林,张宏筠.植物基因工程[M].北京:科学出版社,2002.
[8] Kehoe D M, Villand P, Omerille S. DNA microarrays for studies of higher plants and other photosynthetic organisms[J]. Trends plant sci., 1999, 4(1): 38-41.
[9] Diachenko L B, Ledesma J, Chenchik A A, et al. Combining the technique of RNA fingerprinting and differential display to obtain differentially expressed mRNA[J]. Biochem Biophys Res Commun, 1996, 219(3): 824-828.
[10] 魏源文,邓智年,黄诚梅,等.乙烯利调控甘蔗基因的差异表达研究[J].南方农业学报,2011,42(1):6-10.
[11] 何铁光,董文斌,王爱勤,等.高温胁迫下辣椒生理生化响应机理初步探讨[J].西南农业学报,2013,26(2):541-544.

摘 要:用辣椒耐热自交系A11和热敏自交系B22配置杂交组合,通过高温胁迫处理鉴定其F2代分离群体的耐热性。从123对Taq I/Ase I引物组合中筛选出6对多态性好的引物对F2代耐热、热敏植株进行AFLP分析,共扩增出约11 400条清晰条带,其中2条为稳定的差异,初步获得了2个与辣椒耐热性状相关的AFLP分子标记。研究有助于开展辣椒耐热基因的分子标记辅助选择工作,提高辣椒育种效率和水平,并为分离和克隆辣椒耐热相关功能基因奠定基础。
关键词:辣椒;耐热基因;AFLP分析
中图分类号:Q785;S641.3 文献标识码:A 文章编号:1001-3547(2014)04-0024-03
辣椒(Capsicum annuum L.)原产于中南美洲,属于茄科(Solanaceac)辣椒属(Capsicum)。辣椒是重要蔬菜作物,在世界各地广泛栽培,因其营养丰富、富含维生素C等营养物质而深受人们喜爱[1]。我国是世界辣椒种植面积最大的国家,国内的种植面积仅次于大白菜,属于第二大蔬菜作物。近年来,辣椒在华南地区也有了较大的种植面积,但广西、海南等省份地处热带、亚热带地区,四季高温多雨,对辣椒的生长发育造成了极大的影响,当气温高于35℃时,辣椒开花及结实均受到了明显的影响,大大降低了辣椒的品质和产量。近10多a来,已有不少学者对高温胁迫下辣椒的植株形态、生理生化指标进行了研究,但从分子水平系统研究辣椒耐热特性的报道较少[2~6]。本研究以辣椒耐热高代自交系A11与辣椒热敏高代自交系B22杂交的F2代植株为材料,进行了耐高温胁迫后,选择耐热和热敏的植株进行AFLP分析,寻找与辣椒耐热性状相关的分子标记,为辣椒耐热相关功能基因的克隆分析及进行分子标记辅助育种提供基础。
1 材料与方法
1.1 试验材料
植物材料为辣椒耐热高代自交系A11与辣椒热敏高代自交系B22杂交的F2代植株,采用大棚栽培和人工气候箱盆栽方式种植。试验所需生化试剂、酶类购自南宁宏泰、Fermentas公司及New Englad公司。AFLP分析所用接头和引物由捷瑞公司合成,相关信息如下。
Ase I 接头序列:5'-TAGGTACGCAGTCTAC-3'; 5'-CTCGTAGACTGCGTACC-3';Ase I 预扩增引物序列:5'-CTCGTAGACTGCGTACCTAAT-3';Ase I 选择性扩增引物序列:5'-GACTGCGTACCTAATNNN-3', N 为A、T、C、G 碱基的任意一种。Taq I 接头序列:5'-GACGATGAGTCCTGAC-3';5'-CGGTCAGGACTCAT-3';Taq I 预扩增引物序列:5'-GACGATGAGTCCTGACCGA-3';Taq I 选择性扩增引物序列:5'-GATGAGTCCTGACCGANNN-3',N 为A、T、C、G 碱基的任意一种。
1.2 辣椒叶片总DNA的提取及酶切反应
利用改良SDS法小量提取F2代耐热及热敏辣椒植株叶片的总DNA,对所提取的总DNA分别进行抽提纯化和电泳检测。
利用限制性内切酶Taq I和Ase I对总DNA进行酶切反应,酶切产物回收纯化后备用。
1.3 接头退火及连接反应
Ase I接头和Taq I接头退火,然后与DNA双酶切反应产物于16℃连接过夜,连接产物保存于
-20℃冰箱备用。
1.4 AFLP 分析
①预扩增反应 分别以所有样品的连接产物为模板,用与Taq I接头、Ase I接头匹配的预扩增引物进行预扩增反应,反应程序是94℃ 5 min、94℃ 80 s、52℃ 60 s、72℃ 90 s,20个循环;72℃ 10 min。预扩增产物按需要进行不同倍数的稀释备用。
②选择性扩增 预扩增产物分别稀释成5倍、10倍、15倍和20倍的工作用液,筛选合适的扩增模板浓度。利用选择性扩增引物对A11、B22杂交F2代辣椒植株进行AFLP分析,94℃ 3 min;94℃ 80 s,65℃ 60 s,72℃ 90 s,每循环退火温度下降0.7℃,反应12个循环;然后94℃ 3 min;94℃ 80 s,56℃ 60 s,72℃ 90 s,23个循环;延伸72℃ 10 min。
③电泳检测 配制6%丙烯酰胺变性凝胶,电泳及银染参照王关林等[7]的方法。
2 结果与分析
2.1 辣椒叶片总DNA的提取
用SDS法从辣椒叶片中提取的总DNA的OD260/OD280比值在1.8左右,在1%的琼脂糖凝胶中样品带清楚、凝胶背景清晰(图1),经过RNase A处理和酚/氯仿抽提后适用于酶切、连接等试验。
2.2 AFLP反应体系的建立
在预扩增反应中,进行浓度测定,根据浓度的大小稀释10~20倍后用作AFLP预扩增的模板,进行预扩增条件优化研究。结果表明,以连接产物的10倍稀释液为模板,扩增20循环的效果最好,预扩增产物主要集中在100~750 bp(图2)。
选择性扩增以预扩增产物稀释15倍为模板,扩增约35个循环效果较好(包括降落PCR部分)。循环数少,获得的扩增产物浓度低,在变性聚丙烯酰胺凝胶中条带颜色较浅,通过延长显色时间可以增加条带的清晰度,但是也导致了凝胶背景增加;循环数过多时扩增产物的浓度过高和非特异条带增多,变性凝胶中模糊的弱条带增多,重复效果不稳定。
2.3 辣椒耐热基因的AFLP分析
本研究利用123对引物组合对辣椒耐热、热敏基因池进行了引物筛选,从中选择6对多态性较好的引物组合对辣椒F2代植株进行AFLP分析。聚丙烯酰胺变性凝胶电泳结果显示,每个样品的扩增条带多数在30~70条,获得11 400条稳定、清晰条带。其中A8T19和A12T15引物组合的扩增结果中,耐热辣椒品种中分别出现1条稳定的差异条带,推断该差异条带与辣椒耐热性状相关,至于确切关系还有待进一步分析验证。
3 讨论与结论
AFLP分析多态性丰富、灵敏度高、重复性好[8,9],在植物分子标记研究中应用广泛,但DNA模板的质量高低及银染操作水平均对其分析结果产生重要影响,尤其在银染中无水碳酸钠(Na2CO3)质量、漂洗操作及显色时间的控制对条带的清晰度和凝胶的背景的影响尤为突出[10]。
辣椒材料的高温胁迫试验结果的判定对利用AFLP技术分析辣椒耐热性状相关基因的结果有十分重要的影响。本研究的高温胁迫试验中,在42℃、相对湿度75%的条件下保持一定时间后,根据辣椒植株的形态特征去判定F2代植株的耐热性,主观的判定标准会对AFLP分析结果产生影响;如能结合分析高温胁迫下辣椒的生理生化指标,可以提高判定F2代植株的耐热、热敏性的准确性[11]。在AFLP分析中耐热、热敏辣椒材料之间的差异条带是否与耐热性状相关或连锁还需要进一步的回收克隆及进行功能分析来加以确定。
参考文献
[1] 顾晓慧.与辣椒抗根结线虫N基因紧密连锁的AFLP标记的开发[D].呼和浩特:内蒙古农业大学,2006.
[2] 金新文,沈征言.高温胁迫下三种蔬菜抗热性不同的品种间叶片蒸腾强度作用的比较[J].石河子大学学报:自然科学版,1997,1(3):195-198.
[3] 姚元干,石雪晖,杨建国,等.辣椒叶片耐热性生理生化指标探讨[J].湖南农业大学学报,1998,24(2):119-122.
[4] 贾志银,巩振辉,许红娟,等.高温胁迫对辣椒幼苗生长及生理性状的影响[J].北方园艺,2010(12):5-8.
[5] 姚元干,石雪晖,杨建国,等.辣椒耐热性与叶片质膜透性及几种生化物质含量的关系[J].湖南农业大学学报,2000,26(2):97-99.
[6] 徐小万,雷建军,罗少波,等.高温高湿对现蕾期辣椒不同品种抗氧化性差异研究[J].核农学报,2010,24(2):394-400.
[7] 王关林,张宏筠.植物基因工程[M].北京:科学出版社,2002.
[8] Kehoe D M, Villand P, Omerille S. DNA microarrays for studies of higher plants and other photosynthetic organisms[J]. Trends plant sci., 1999, 4(1): 38-41.
[9] Diachenko L B, Ledesma J, Chenchik A A, et al. Combining the technique of RNA fingerprinting and differential display to obtain differentially expressed mRNA[J]. Biochem Biophys Res Commun, 1996, 219(3): 824-828.
[10] 魏源文,邓智年,黄诚梅,等.乙烯利调控甘蔗基因的差异表达研究[J].南方农业学报,2011,42(1):6-10.
[11] 何铁光,董文斌,王爱勤,等.高温胁迫下辣椒生理生化响应机理初步探讨[J].西南农业学报,2013,26(2):541-544.

