任宏伟 孟寒寒 徐瑶 赵永丽 高婷


摘要?目的:對药用植物珊瑚菜Glehnia littoralis BAHD酰基转移酶(Acyltransferase,AT)基因序列进行生物信息学分析。方法:用茉莉酸甲酯(MeJA)处理珊瑚菜幼苗,用实时荧光定量PCR(RT-qPCR)方法检测GlAT候选基因的表达量,在已建立的珊瑚菜转录组数据中筛选出表达量较高且MeJA处理后上调表达的1条GlAT基因序列,对该基因cDNA序列进行全长克隆;根据所得的氨基酸序列进行蛋白质理化性质、二级结构、三级结构分析,利用MEGA 6.0构建该蛋白序列的NJ系统进化树。结果:GlAT的全长开放阅读框ORF(Open Reading Frame)为1 443 bp,编码480个氨基酸。该蛋白相对分子质量为52 844.14,等电点为6.92,为亲水性蛋白,属于转移酶超家族。珊瑚菜GlAT蛋白与同科植物胡萝卜Daucus carota subsp.sativus的AT蛋白亲缘关系最近。结论:首次获得珊瑚菜GlAT基因的ORF全长序列并进行了生物信息学分析,为进一步开展该基因的功能和遗传调控机制研究奠定了基础。
关键词?药用植物;珊瑚菜;转录组;酰基转移酶;基因筛选;克隆;生物信息学分析;次生代谢
Cloning and Bioinformatics Analysis of Acyltransferase Gene in Medicinal Plant Glehnia littoralis(GlAT)
REN Hongwei1, MENG Hanhan1,2, XU Yao1, ZHAO Yongli1, GAO Ting1
(1 Key Laboratory of Plant Biotechnology in Universities of Shandong Province, College of Life Sciences, Qingdao Agricultural University, Qingdao 266109, China 2 College of Life Sciences, Northeast Agricultural University, Harbin 150036, China)
Abstract?Objective:To analyze the BAHD acyltransferase (AT) gene sequence of medicinal plants, Glehnia littoralis from bioinformatics perspective.Methods:Glehnia littoralis seedlings was treated with methyl jasmonate (MeJA).The real-time fluorescent quantitative PCR (RT-qPCR) method was used to detect the gene expression.A GlAT gene sequence with high expression and up-regulated expression after MeJA treatment were screened from established transcriptome data of Glehnia littoralis.The cDNA sequence of the gene was cloned in full-length; the physical and chemical properties, secondary structure and tertiary structure of the protein were analyzed based on obtained amino acid sequence; and NJ phylogenetic tree based on AT proteins sequence was build using MEGA 6.0 software.Results:The full-length ORF of GlAT was 1 443 bp, encoding 480 amino acid residues.The relative molecular weight of the protein was 52 844.14, and the isoelectric point was 6.92.It was a hydrophilic protein and belonged to the transferase superfamily.GlAT protein of Glehnia littoralis was closely related to the AT protein of Daucus carota subsp.sativus.Conclusion:For the first time, the full-length ORF sequence of GlAT gene from G.littoralis was obtained and bioinformatics analysis was performed, which laid foundation for further research on the function and genetic regulatory mechanism of this gene.
Keywords?Medicinal plant; Glehnia littoralis; Transcriptome; Acyltransferase; Gene screening; Clone; Bioinformatics analysis; Secondary metabolism
中图分类号:R284文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.05.005
植物中存在大量次生代谢产物,次生代谢产物的合成一般涉及到氧化还原、脱羧、酰基化、羟基化等过程[1]。酰基化是植物次生代谢中一类重要反应,实验证明酰基化在植物生长发育以及次生代谢中均发挥重要作用[2],其可以增加植物细胞中化合物的积累,从而使植物抵御外界生物胁迫以及非生物胁迫。BAHD酰基转移酶超家族是植物中特有的一类蛋白,参与次生代谢产物合成和酰基化修饰,以酰基CoA作为底物,产生各种挥发性脂类、修饰后的花青素及与植物抵御外界胁迫相关的化合物。这些化合物与植物代谢相关,某些化合物还具备一定的药理活性[3-5]。如BAHD酰基转移酶超家族的蛋白参与长春花碱的生物合成及紫杉醇的生物合成[6-8]。
对目前已知的BAHD酰基转移酶超家族蛋白氨基酸序列进行比较,该家族蛋白氨基酸序列中都包含有2个保守结构域,位于催化活性中心的HXXXD氨基酸序列,以及位于C末端的DFGWG氨基酸保守序列。上述2个氨基酸保守序列中的一个或者多个氨基酸发生突变,都会导致酰基转移酶蛋白活性减弱。在拟南芥、水稻和杨树中发现BAHD成员分别为:64、119和94个。在烟草等植物中,BAHD家族成员的功能也被研究和鉴定[1,9-10]。Vinorine Synthase作为BAHD酰基转移酶家族蛋白成员之一,Ma等获得了Vinorine Synthase蛋白晶体,并对该蛋白晶体进行了结构解析:该蛋白为一球状蛋白,由2个结构域组成,2个结构域之间由Loop相连,HXXXD位于活性中心部位,活性中心位于2个蛋白结构域之间。DFGWG序列位于11~13β折叠区域,接近C端。推测DFGWG氨基酸序列可能对CoA结合口袋的完整性有重要影响[11-13]。
药用植物珊瑚菜Glehnia littoralis Fr.Schmidt ex Miq.属伞形科珊瑚菜属,该植物的干燥根称北沙参[14]Glehniae Radix,是我国传统中药材,为“补肺之要药”,有养阴清肺、益胃生津的功效[15]。珊瑚菜中含有香豆素、香豆素苷、聚炔、以及单萜、多元醇、脂肪酸等类型化合物等重要活性成分。这些重要活性成分已被证实具有镇痛、抗菌、平喘、抗过敏、抗病毒多种生物活性,已应用于临床[16-17]。然而,天然药材中次生代谢产物含量较低。应用现代生物技术调控珊瑚菜中重要次生代谢产物的生物合成能有效解决该问题。珊瑚菜中酰基转移酶研究未见报道,开展相关的研究具有一定科学价值。
本研究拟在前期转录组数据分析基础上,挖掘药用植物珊瑚菜的酰基转移酶(GlAT)候选基因。进而利用分子生物学手段对该基因的cDNA序列进行了克隆,获得了全长ORF序列并初步进行生物信息学分析。本研究有利于珊瑚菜次生代谢产物合成分子机制的解析,将为进一步研究珊瑚菜的分子育种和利用生物技术提高珊瑚菜品质奠定理论基础,具有重要的理论价值和良好的应用前景,对药用植物研究具有示范意义。
1?材料与试剂
1.1?植物材料
采集山东省莱阳市高格庄镇新鲜的三年生珊瑚菜,由青岛农业大学高婷副教授鉴定为伞形科珊瑚菜属珊瑚菜(Glehnia littoralis)。清洁后液氮速冻,置于-80 ℃冰箱保存备用。
1.2?试剂
DNA Marker(大连宝生物工程有限公司,生产批号:AJ91887A)、6×Loading Buffer(大连宝生物工程有限公司,生产批号:AI51553A);植物多糖多酚植物总RNA提取试剂盒(天根生化科技(北京)有限公司,生产批号:20180327);高保真酶产品PrimeSTARHS DNA Polymerase(宝日医生物技术(北京)有限公司,生产批号:AJ11396);PrimeScriptTMII 1st Strand cDNA Synthesis Kit cDNA反转录试剂盒(宝日医生物技术(北京)有限公司,生产批号:AJ60432A);TB GreenTMPremix Ex TaqTMII(Tli RNaseH Plus)荧光定量试剂盒(宝日医生物技术(北京)有限公司,生产批号:AJ61475A);TaKaRa MiniBEST Agarose Gel DNA Extraction Kit胶回收试剂盒(宝日医生物技术(北京)有限公司,生产批号:AJ81894A);pMDTM18-T Vector Cloning Kit试剂盒(宝日医生物技术(北京)有限公司,生产批号:AJ52169A)。
1.3?仪器
高温高压灭菌器(上海辅泽商贸有限公司,美国,型号:GI80TW/GI100TW);专业型分析天平(奥豪斯仪器(上海)有限公司,瑞士,型号:DV215CD);松下制冰机(北京世贸远东科学仪器有限公司,辽宁,型号:SIM-F140BDL);小型台式高速冷冻离心机(北京海天友诚科技有限公司,德国,型号:Centrifuge 5424R);超纯水机(默克化工技术(上海)有限公司,法国,型号:Milli-Q Integral);核酸琼脂糖水平电泳仪(北京金时速仪器设备经营部,国产,型号:DYCP-31CN);凝胶成像仪(北京宇艾奇电子科技有限公司,国产,型号:SQ-Tanon3500);实时荧光定量PCR仪(圣湘生物科技股份有限公司,美国,型號:Applied biosystems QuantStudio 5)。
2?方法
2.1?MeJA处理
取生长状况良好的珊瑚菜无菌苗,实验组与对照组各5株。用50%乙醇溶液作为溶剂配制200 μmol/LMeJA溶液,将该溶液均匀的涂抹在珊瑚菜无菌苗真叶的上下表皮,作为实验组材料,空白组仅用50%乙醇溶液涂抹真叶,其他处理方法与实验组保持一致。随后室温下黑暗避光处理16 h备用。
2.2?珊瑚菜真叶总RNA提取
将实验组与空白组的珊瑚菜材料每株选取1~2片真叶,置于液氮速冻,采用天根生化科技(北京)有限公司的植物多糖多酚植物总RNA提取试剂盒提取珊瑚菜真叶中的总RNA,采用宝日医生物技术(北京)有限公司的PrimeScriptTMII 1st Strand cDNA Synthesis Kit cDNA反转录试剂盒,对总RNA进行反转录,最终获得实验材料的cDNA。
2.3?荧光定量PCR
使用Primer-BLAST对GlAT的阅读框全长序列进行荧光定量PCR引物设计,引物序列为F:GAAGGGAAGGGGATGGAAGTG,R:GACTTGTCTTCGTACACTGGATTT。引物合成在生工生物工程(上海)股份有限公司完成。以珊瑚菜内源Actin为内参基因,以2.2合成的cDNA为模板,构建体系后置于荧光定量PCR仪中反应。定量程序第1步:95 ℃,30 s。第2步:95 ℃,5 s、54 ℃,30 s、72 ℃,30 s,40个循环。第3步:95 ℃,15 s;60 ℃,1 min;95 ℃,1 s。
2.4?珊瑚菜GlAT基因克隆及测序
基于筛选的转录组GlAT候选基因序列设计引物对该基因进行克隆,采用Primer5软件进行引物设计。引物序列:F:ATGCCTTCTTCCTCAGTTCATATC,R:TTACGATACATATTGCATGAACTCTG。反应体系包括:5×PrimeSTAR Buffer(Mg2+Plus)5 μL,dNTP Mixture(2.5 mmol/L each)2 μL,前引物0.5 μL,后引物0.5 μL,cDNA 1 μL,灭菌水15.5 μL,PrimeSTAR HS DNA Polymerase 0.5 μL。PCR程序为:98 ℃,10 s;53 ℃,5 s;72 ℃,90 s,35个循环,每个25 μL高保真酶PCR体系中加入0.25 μL LAtaq酶,72 ℃,20 min,加入Poly(A)尾。PCR产物经1%琼脂糖凝胶电泳检测后,利用琼脂糖凝胶DNA回收试剂盒回收目的条带。回收产物与pMD18-T载体16 ℃连接16 h后转化DH5α感受态细胞,在含有AMP抗性的LB固体培养基平板上进行培养,长出单菌落,菌液PCR初步验证后选取3个阳性克隆送至生工生物工程(上海)股份有限公司测序。
3?生物信息学分析
使用NCBI的ORFFinder和ConservedDomains在线网站分别进行ORF和保守结构域分析;使用ExPASy(https://web.expasy.org/protparam/)的Protscale及TMHMM Server在线网站分别分析蛋白亲疏水性并预测跨膜区。使用SOMPA在线网站进行蛋白二级结构分析(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)。使用SWISS-MODEL在线网站(https://swissmodel.expasy.org/)构建三维模型并用PyMOL软件对其进行分析;最后使用MEGA6.0软件构建NJ系统进化树。
4?结果与分析
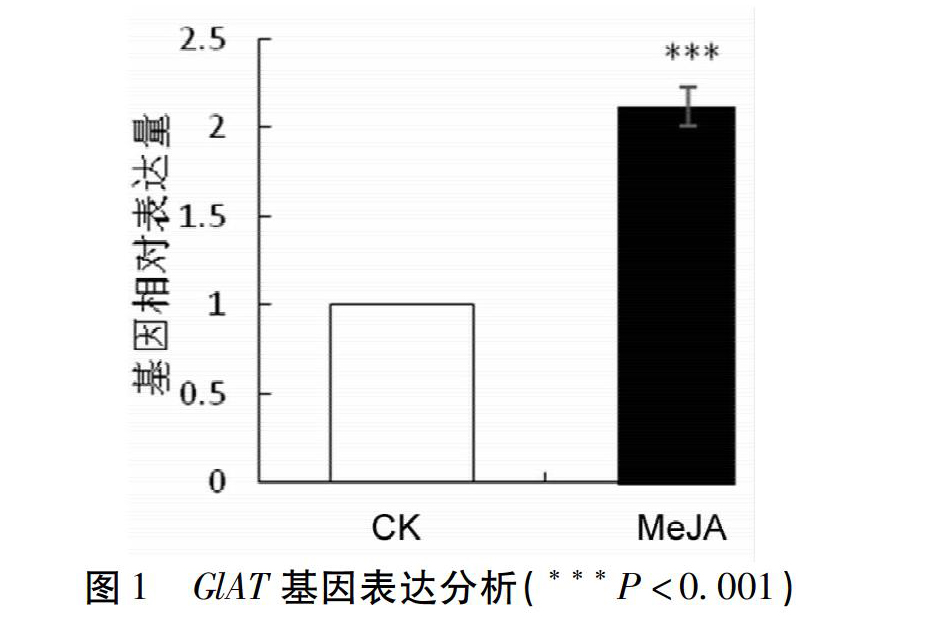
4.1?荧光定量PCR结果?根据转录组数据筛选出表达量较高的1条GlAT候选基因序列c71961_g1。见图1,MeJA处理后,该候选基因的表达量显著提升,表達量近乎为空白组的两2倍。已有研究表明,外施茉莉酸甲酯能够有效的刺激植物,促进香豆素等次生代谢产物的积累。因此,推测该GlAT候选基因参与了珊瑚菜的次生代谢。
4.2?珊瑚菜GlAT基因的扩增和序列分析
利用转录组的GlAT候选基因序列设计引物,以珊瑚菜cDNA为模板,进行克隆扩增,得到一条约1 400 bp的目的条带,见图2。将其回收纯化、测序、序列比对后得到该基因的全长ORF为1 443 bp,编码480个氨基酸,见图3。将上述AT蛋白序列与NCBI上植物的同源序列进行比对。结果表明,其与近源物种胡萝卜Daucus carota subsp.sativus(XP_017254085)BAHD酰基转移酶超家族的AT蛋白序列相似性为91.25%,确定克隆得到的为珊瑚菜AT基因的cDNA序列,将其命名为GlAT。
4.3?同源性分析及结构域预测?将GlAT蛋白序列与NCBI上部分植物的同源序列进行比对。结果表明,GlAT与胡萝卜Daucus carota subsp.sativus(XP_017254085)、葡萄Vitis vinifera(CAN62119、XP_002278801)的蛋白序列相似性分别为91.25%、70.33%。对GlAT蛋白保守结构域进行分析,结果表明该蛋白属于转移酶超家族(Transferase superfamily),见图4。且GlAT蛋白具有BAHD酰基转移酶超家族的2个保守结构域HXXXD及DFGWG氨基酸序列。
4.4?蛋白理化性质分析
对GlAT蛋白氨基酸序列进行分析:GlAT蛋白相对分子质量为52 844.14,等电点为6.92。使用ExPASy的Protscale在线工具预测GlAT蛋白亲疏水性,见图5。GlAT蛋白在第247个氨基酸位点,最低峰值是-2.133,在第281个氨基酸位点,最高峰值是1.878,总平均亲水性为-0.158。使用TMHMM Server在线工具对AT蛋白氨基酸序列进行分析,结果表明GlAT蛋白没有跨膜结构域。
4.5?拟南芥与珊瑚菜AT蛋白结构预测?预测的GlAT二级结构(图6)中有160个氨基酸参与形成了α-螺旋,占33.33%。82个氨基酸参与了延伸链的形成,占17.08%。24个氨基酸参与了β-转角的形成,占5%。214个氨基酸参与了无规卷曲的形成,占44.58%。GlAT主要结构为α-螺旋和无规卷曲,α-螺旋是最为稳定的蛋白质空间结构,其中α-螺旋的比例在30%以上,因此推测此蛋白相对稳定。将拟南芥(Arabidopsis thaliana)与珊瑚菜的(Glehnia littoralis)的AT基因蛋白二级结构以及相应的氨基酸数量进行比较,结果发现2个物种AT基因蛋白的二级结构及氨基酸数量均较为相似,见表1。
對珊瑚菜以及拟南芥AT蛋白进行三维建模,见图7A。以5kjt.1.A蛋白作为模体,相似性为26.39%,三维结构包括16个β-折叠、13个α-螺旋、28个无规则卷曲。见表2。预测GlAT蛋白三维结构包含了470个氨基酸,占编码氨基酸总数的97.92%;拟南芥AT蛋白以5kjt.1.A蛋白作为模体,相似性为28.09%,三维结构包括16个β-折叠、15个α-螺旋、30个无规则卷曲,见图7B。预测AT蛋白三维结构包含了459个氨基酸,占编码氨基酸总数的95.42%。以上数据表明,珊瑚菜与拟南芥AT蛋白模型中的二、三级结构十分接近,推测珊瑚菜与拟南芥AT蛋白在功能上可能存在一定的保守性,蛋白功能可能较为相似。
4.6?系统进化分析?从NCBI数据库选取代表性植物(含蔷薇科、槟榔科、禾本科、杨柳科、伞形科、菊科、茄科、十字花科、豆科植物)的AT蛋白序列,利用MEGA6.0软件构建系统进化树,见图8。结果表明,珊瑚菜与胡萝卜Daucus carota subsp.sativus的AT蛋白亲缘关系较近,而与野大豆Glycine soja、拟南芥Arabidopsis thaliana、月季为Rosa chinensis、玉米Zea mays等植物的AT蛋白亲缘关系较远,符合进化关系。
5?讨论
本研究利用珊瑚菜GlAT转录组序列对其所编码的序列进行了基因克隆及生物信息学分析,序列比对结果显示这个基因与胡萝卜的AT基因同源性最高为91%。保守结构与分析显示:GlAT蛋白属于转移酶超家族,具有该超家族的2个保守结构域HXXXD及DFGWG氨基酸序列。此外,MeJA处理后的定量分析结果显示,GlAT基因可能参与了珊瑚菜的次生代谢途径。本研究有利于珊瑚菜呋喃香豆素类生物合成分子机制的解析,将为进一步研究珊瑚菜的分子育种和利用生物技术提高呋喃香豆素产量奠定理论基础,具有重要的理论价值和良好的应用前景,对其他药用植物研究也具有示范意义。
David等人研究结果显示:拟南芥的AT蛋白是BAHD酰基转移酶超家族的成员之一,它能利用辅酶A硫酯催化形成一系列的次生代谢产物,拟南芥的AT突变体更容易受到盐度、渗透压和缺水胁迫条件的影响[18]。因此,AT基因对拟南芥的抗逆及次生代谢产物的累积具有十分重要的意义。通过本文二、三维结构预测结果显示:珊瑚菜和拟南芥的AT基因可能存在一定的同源性,推测它们的蛋白功能上可能存在一定相似性。珊瑚菜GlAT基因能否对珊瑚菜的抗逆起到关键的作用,能否产生更多的次生代谢产物,从而带来更多的经济价值,有待于对该基因功能的进一步的探索。此外,该此外,GlAT家族基因成员可能不止一个,其相互关系及具体功能有待开展。
参考文献
[1]刘雨雨,莫婷,王晓晖,等.植物来源BAHD酰基转移酶家族研究进展[J].中国中药杂志,2016,41(12):2175-2182.
[2]Yu X H,Gou J Y,Liu C J.BAHD superfamily of acyl-CoA dependent acyltransferases in Populus and Arabidopsis:bioinformatics and gene expression[J].Plant Molecular Biology,2009,70(4):421-442.
[3]D′Auria JC.Acyltransferases in plants:a good time to be BAHD[J].Current Opinion in Plant Biology,2006,9(3):331-340.
[4]Suzuki H,Sawada S,Watanabe K,et al.Identification and characterization of a novel anthocyanin malonyltransferase from scarlet sage(Salvia splendens)flowers:an enzyme that is phylogenetically separated from other anthocyanin acyltransferases[J].Plant Journal,2004,38(6):994-1003.
[5]Stpierre B,Luca V D.Chapter nine evolution of acyltransferase genes:origin and diversification of the BAHD superfamily of acyltransferases involved in secondary metabolism[J].Recent Advances in Phytochemistry,2000,34:285-315.
[6]Ciarkowska A,Ostrowski M,Jakubowska A.Acyltransferases involved in plant secondary metabolism:classification,structure,reaction mechanism[J].Postepy Biochemii,2015,61(1):69-78.
[7]Nevarez DM,Mengistu YA,Nawarathne IN,et al.An N-Aroyltransferase of the BAHD superfamily has broad aroyl CoA specificity in vitro with analogues of N-Dearoylpaclitaxel[J].Journal of the American Chemical Society,2009,131(16):5994-6002.
[8]St-Pierre B,Laflamme P,Alarco AM,et al.The terminal O-acetyltransferase involved in vindoline biosynthesis defines a new class of proteins responsible for coenzyme A-dependent acyltransfer[J].Plant Journal,2002,14(6):703-713.
[9]王梦姣.植物BAHD酰基转移酶家族研究进展[J].江西农业学报,2010,22(12):128-130.
[10]Zhang Z,Xu L.Arabidopsis BRASSINOSTEROID INACTIVATOR2 is a typical BAHD acyltransferase involved in brassinosteroid homeostasis[J].Journal of Experimental Botany,2018,69(8):1925-1941.
[11]D′Auria JC, Reichelt M, Luck K,et al.Identification and characterization of the BAHD acyltransferase malonyl CoA:Anthocyanidin 5-O-glucoside-6″-O-malonyltransferase(At5MAT)in Arabidopsis thaliana[J].Febs Letters,2007,581(5):872-878.
[12]Unno H,Ichimaida F,Suzuki H,et al.Structural and mutational studies of anthocyanin malonyltransferases establish the features of BAHD enzyme catalysis[J].Journal of Biological Chemistry,2007,282(21):15812-15822.
[13]Ma X,Koepke J,Panjikar S,et al.Crystal structure of vinorine synthase,the first representative of the BAHD superfamily[J].Journal of Biological Chemistry,2005,280(14):13576-13583.
[14]王愛兰,王贵琳,李维卫.濒危物种珊瑚菜遗传多样性的ISSR分析[J].西北植物学报,2015,35(8):1541-1546.
[15]朱兆荣,李玉强,刘娟,等.补骨脂总黄酮抗氧化作用研究[J].中国兽药杂志,2005,39(2):18-20.
[16]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:100.
[17]李祝,宋宝安.补骨脂素抗肿瘤机理及其应用研究进展[J].山地农业生物学报,2007,26(3):255-260.
[18]Panikashvili D,Shi JX,Schreiber L,et al.The Arabidopsis DCR encoding a soluble BAHD acyltransferase is required for cutin polyester formation and seed hydration properties[J].Plant Physiology,2009,151(4):1773-1789.
(2020-02-10收稿?责任编辑:徐颖)
- 工频螺杆空压机节能技术改造应用
- 2DMF-1型自走式地膜机的研制
- 旋转式圆环形土槽试验台设计
- 自走式亚麻脱粒翻铺机脱粒机构的设计及参数优化
- 林业育苗技术与造林方法的综合措施
- 党参的栽培与管理探究
- 如何提高水稻机械化插秧作业效率
- 农机工程在现代农业产业化发展对策的思考
- 辣椒栽培新技术及病虫害防治的探讨
- 无公害蔬菜基地建设和植保技术应用研究
- 林木种苗在林业可持续发展中的作用
- 深化供给侧改革 推动玉米产业创新升级
- 马铃薯高产种植技术研究
- 提高农业机械化水平 促进农业可持续发展
- 果树种植中病虫害防治策略概述
- 植树造林技术与森林养护措施探讨
- 加大农机工程投入 夯实农业发展基础
- 林业苗木病虫害机理与防治措施
- 精确农业理念对传统农机的影响及新机型应用展望
- 青稞生产发展现状、存在问题及建议
- 水稻高产种植技术要点分析
- 农机工程对农业节能节水的作用分析
- 水稻应用苗王360肥试验总结
- 现代农业循环经济的探讨
- 农机使用中的安全防范措施
- at-top-speed
- attorney
- attorneyatlaw
- attorneydom
- attorneygeneral
- attorney generals
- attorney-generalship
- attorneyism
- attorneys
- attorneys-at-law
- attorneys general
- attorneyships
- at/to the rear
- attract
- attractability, attractableness
- attractablenesses
- attract/attraction
- attracted
- attractedto
- attracters
- attracting
- attractingly
- attraction
- attractionally
- attractions
- 古代指某些为祸乱征兆的里巷歌谣
- 古代指正房两旁的房间
- 古代指王府
- 古代指男性奴隶
- 古代指百戏杂技艺人
- 古代指粮食作物
- 古代指给官府当差的小吏
- 古代指裤子
- 古代按名位分的礼仪等级
- 古代按规定应出的税米
- 古代授官的文凭
- 古代掌理音乐的官员或官署
- 古代掌管司法刑狱的官
- 古代掌管财政、赋税、贸易等事务的官署
- 古代掌管财赋会计的官署
- 古代掌管音乐的官吏
- 古代接受告密文件的器
- 古代接纳告密文书的器具
- 古代插在地上测日影的桩
- 古代收藏兵器的器具
- 古代攻击的战具
- 古代政府传递文书或差官换马暂住的地方
- 古代政府所行的酒类专卖制度
- 古代救火的一种器具
- 古代教授初学之所