袁仁智 唐鹏 雍志强


摘要 目的:运用网络药理学方法和技术研究牛膝治疗多囊卵巢综合征(PCOS)的主要活性成分、靶点、通路等药理学作用机制。方法:通过中药系统药理学分析平台(TCMSP)筛选出牛膝的活性成分和潜在靶点;查询NCBI数据库获得PCOS疾病靶点,找到药物和疾病的共靶点;通过DAVID数据库对共靶点进行基因功能GO富集分析和KEGG富集分析;采用Cytoscape软件构建成分-靶标-通路网络。结果:筛选得到有靶点的牛膝候选活性化合物共24个,作用于128个靶点;与PCOS的22个共靶点主要涉及AGE-RAGE信号通路、核因子-κB信号通路、TNF信号通路等;共靶点涉及化合物23个,7个靶点涉及5个及以上化合物,ESR1和AR涉及化合物多达19个,还有GSK3B(12个)、ESR2(11个)、PPARG(11个)、ADRB2(9个)涉及较多化合物。结论:牛膝治疗PCOS具有多成分、多靶点协同作用的特点,通过干预分子网络、生物过程和信号通路来发挥抗炎、抗肿瘤、调节血脂、促进微循环及改善胰岛素抵抗的作用。
关键词 牛膝;多囊卵巢综合征;肾虚血瘀;网络药理学;成分;靶点;通路;富集分析
Abstract Objective:To study the pharmacological mechanism of Achyranthes bidentata in the treatment of polycystic ovary syndrome(PCOS)by network pharmacological methods and techniques.Methods:The active components and potential targets of Achyranthes bidentata were screened by the platform of systematic pharmacological analysis of traditional Chinese medicine(TCMSP); the PCOS disease targets were obtained by querying the NCBI database to find the co-target of drugs and diseases; the gene function GO enrichment analysis and KEGG enrichment analysis were carried out by DAVID database on the co-target database; and the component-target-pathway network was constructed by Cytoscape software.Results:A total of 24 bull knee candidate active compounds were screened,and 128 targets were selected.The 22 common targets with PCOS mainly involved the AGE-RAGE signal path,NF-κB signal path,TNF signal path,etc.A total of 23 target involved in compounds,7 targets involved 5 or more compounds,ESR1 and AR involved as many as 19 compounds,as well as GSK3B(12),ESR2(11),PPARG(11),ADRB2(9)or more compounds.Conclusion:Achyranthes bidentata in the treatment PCOS has the characteristics of multi-component and multi-target synergistic effects.It can play the role of anti-inflammatory,anti-tumor,regulating blood lipid,promoting microcirculation and improving insulin resistance by interfering with molecular network,biological process and signaling pathway.
Keywords Achyranthes bidentata; PCOS; Kidney deficiency and blood stasis; Network pharmacology; Components; Targets; Pathways; Enrichment analysis
中圖分类号:R282 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.22.003
多囊卵巢综合征(Polycystic Ovarian Syndrome,PCOS)是影响女性最常见的内分泌紊乱疾病,在育龄女性中的发病率为5% ~20%,近年呈不断上升趋势。PCOS主要特征包括月经周期紊乱、高雄激素血症和肥胖等临床综合征[1]。PCOS的发病机制及其相关的症状虽有待解释,但症状和体征上的异质性提示其不可能是单一因素引起[2]。PCOS的发生不仅受遗传影响,也和下丘脑-垂体-卵巢轴调控功能紊乱、高胰岛素血症、肥胖、精神、心理、环境等因素密切相关[3]。中医药辨证论治的个性化方案在治疗多囊卵巢综合征方面有其独到之处。通过收集古今中医名家治疗多囊卵巢综合征疾病或症状的方剂加以整理,运用中医传承辅助系统进行数据分析发现,中医治疗PCOS证候组合中,以肾虚血瘀型和肝郁肾虚型最多,肾、脾、肝三脏功能失调是PCOS主要病机,补虚和解郁是治疗PCOS的思路,而补肾健脾、疏肝解郁、理气化痰、活血化瘀是治疗PCOS的主要治法[4]。在治疗PCOS的活血化瘀方剂中,牛膝的使用频次较高,且其具有逐瘀通经,补益肝肾,强筋壮骨,利尿通淋,引血下行的功效。故本研究采用网络药理学方法分析牛膝的化学成分、靶点和通路之间的关系,试图从整体层面揭示牛膝治疗PCOS的药理学机制。
1 资料与方法
借助中国中医科学院研制的中医传承辅助平台(2.5版本)建立多囊卵巢综合征方剂数据库并进行数据挖掘[4],数据库收集130位现代医家的352个方剂,通过对肾虚血瘀型方剂运用熵聚类法进行关联分析,发现在同时具有补肾和活血功效的中药中,牛膝的使用频次最高,故对其开展网络药理学的相关研究,揭示其治疗PCOS的药理学机制。
2 结果
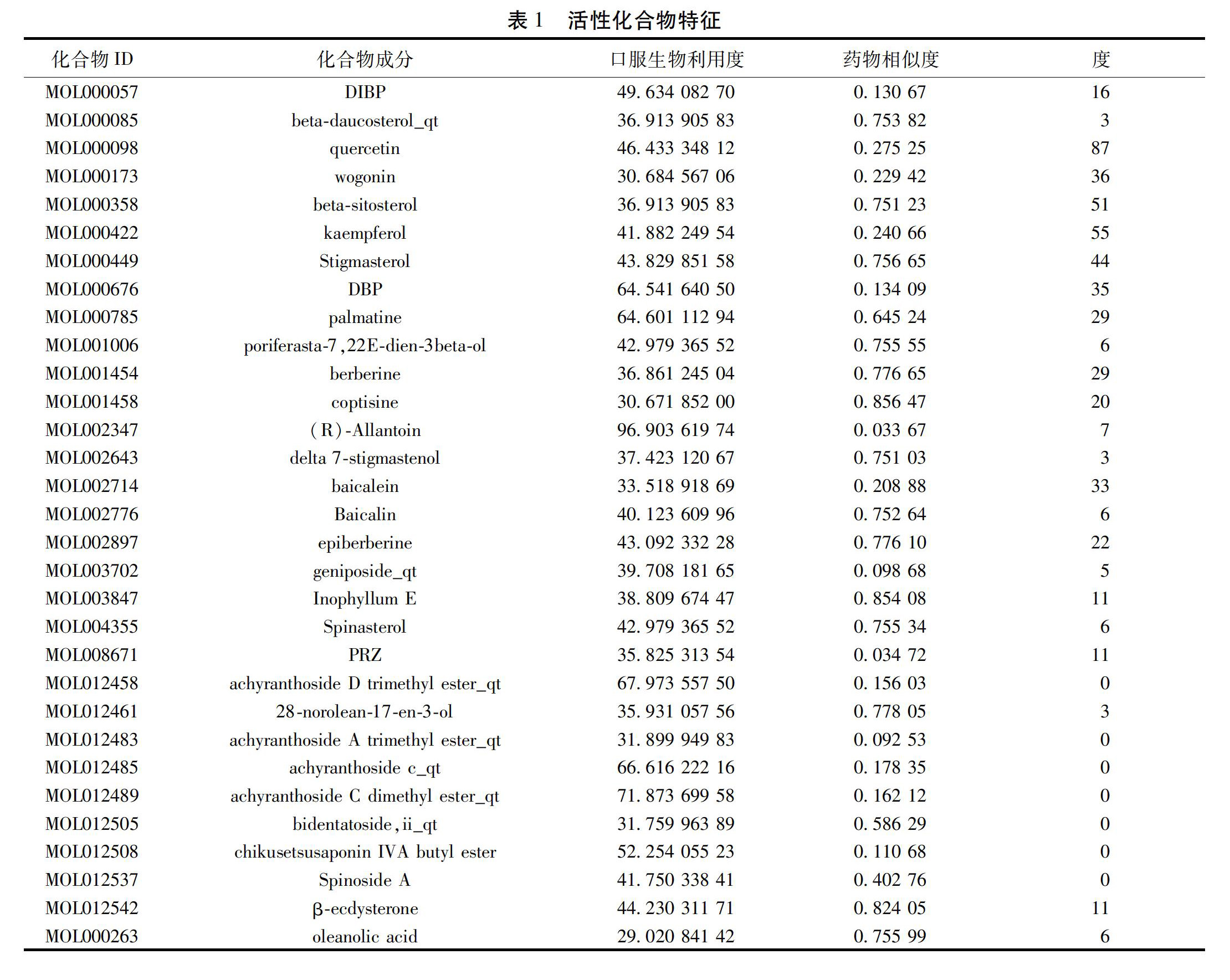
2.1 牛膝活性成分筛选及其潜在靶点预测 中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)作为目前国内较为完善的草药成分靶点数据库,共收录了505味草药的12 144个活性成分、关键药物动力学(ADME)性质、类药性、作用的靶点、参与的通路及相关疾病,为中草药的性质检索、新药开发和中医药基础理论的现代阐释提供了新手段和新方法。进入TCMSP平台(http://lsp.nwu.edu.cn/tcmsp.php),选择Herb name,输入“niuxi”,获得176个化学成分,然后根据口服生物利用度(OB)和药物相似度(DL)进行筛选,设为OB≥30%,DL≥0.03,去重后最后得到牛膝活性化合物30个。见表1。另外,oleanolic acid的OB值接近30%(29.02),因其为牛膝的主要成分特根据文献补入。同时在TCMSP中获得24个化合物的535个潜在靶点(其中有7个化合物无靶点),筛去重复项,经整理得到128个靶点。
2.2 药物与疾病共靶点及化合物-靶点网络 NCBI是一个关于分子生物学、生物化学和遗传学知识的存储和分析的数据库。进入NCBI基因数据库(https://www.ncbi.nlm.nih.gov),以“polycystic ovarian syndrome”为关键词检索,选择种属“人类”,得到228个PCOS疾病基因靶点。
将牛膝与PCOS疾病靶点分别录入Excel建立文档,通过比对找到两者的共有靶点22个,涉及化合物23个,这些可能是PCOS的主要作用靶点。见表2。将共靶点及其对应化合物数据导入Cytoscape3.7.0构建化合物-靶点(CT)网络。见图1。45个节点代表化合物和靶点,111条连线代表化合物和靶点的关系,每个靶点涉及的化合物均值为4.83,每个化合物涉及的靶点均值为5.05,涉及4个及以上靶点的化合物有13个,最多的有17个靶点。涉及5个及以上化合物的靶点有7个,最多的涉及19个化合物。这13个化合物和7个靶点很可能与PCOS关系最为密切。
2.3 共靶点蛋白互作网络 药物作用既可以表现为直接的靶点结合和单一的信号通路,也可以是直接靶點和间接靶点共同调控等多靶点、多通路、多层次的复杂网络模式。因此通过蛋白之间的相互作用关系即PPI网络可以进一步深入分析药物对PCOS的重要影响。进入String数据库,点击Multiple Proteins,输入22个共靶点,种属“人类”,设置评分为0.4,网络边缘含义为“molecular action(分子作用)”,得到蛋白互作特征网络。见图2。节点数为22,边数为97,平均节点度为8.82,局部聚类系数为0.676。PPI富集P值<1.0E-16。这意味着蛋白质之间的相互作用比基因组中随机的一组相似大小的蛋白质所预期的更多,即蛋白质之间的活跃度较高。
2.4 靶点通路注释分析 通过OMICSHARE(http://www.omicshare.com/)在线工具动态GO富集分析得到GO富集236条,设置参数为FDR<0.05,P<0.05,获得GO条目133个。见表3,图3。其中生物途径(BP)前5个为细胞坏死、细胞凋亡、细胞增殖、细胞调控翻译、细胞分化。分子功能(MF)前5个为酶结合、蛋白质结合、脂质结合、DNA结合、核酸结合。细胞定位(CC)前5个为细胞外间隙、细胞外区域部分、胞质部分、核内体、胞外区。通过OMICSHARE(http://www.omicshare.com/)在线工具KEGG富集分析得到KEGG信号通路富集90条,设置参数为P<0.05,得到KEGG条目17条。见表4,图4。同时借助Cytoscape3.7.0构建靶点-通路网络。见图5。
3 讨论
网络药理学(Network Pharmacology)是一门从生物网络的角度研究疾病的发生和发展的过程,认识药物与机体的相互作用并指导新药发现的学科。在研究工具上,该学科借助高通量组学数据、分子网络数据以及计算机模拟分析,研究药物的作用机制和促进药物创新[5]。而中医的整体观念、辨证论治理论与网络药理学的系统动态观高度一致,因此,运用网络药理学方法研究中医方药的作用机制成为目前药理学研究的一个热点[6]。本研究通过数据挖掘PCOS肾虚血瘀型方剂核心药物牛膝,借助系统药理学、药代动力学和生物信息学方法来确定牛膝的活性化合物及与PCOS相关的靶点和通路。
本研究通过TCMSP平台的OB和DL筛选,获得牛膝的23个化合物和128个靶点,发现其中靶点最多的是槲皮素(87个靶点)和山柰酚(55个靶点),其次是β-谷甾醇、豆甾醇、汉黄芩素、β-蜕皮甾酮、齐墩果酸等。有研究发现槲皮素具有降低体质量和卵巢直径,恢复卵泡腺外层及黄体功能的作用,并证实其具有减轻多囊卵巢综合征患者性激素和代谢紊乱的作用[7]。Neisy等[8]研究表明:槲皮素能显著减少PCOS-IR和显著诱导子宫GLUT4和ERα基因的表达。口服补充槲皮素可以降低多囊卵巢综合征超重或肥胖患者的抵抗素血浆水平和基因表达以及睾酮和LH浓度[9];Rezvan等[10]发现口服槲皮素能上调脂联素受体和AMPK的表达,改善PCOS患者的代谢特征。王针织研究表明,槲皮素可通过抑制TLR/核因子-κB信号通路,达到改善多囊卵巢胰岛素抵抗微环境炎性反应,从而逆转胰岛素抵抗[11]。槲皮素已被研究证实在治疗PCOS的肥胖和代谢综合征中发挥了有益的作用[12],其可能是治疗多囊卵巢综合征患者胰岛素抵抗、不孕症及其近期、远期并发症的一种有效的治疗方法[8]。山柰酚作为一种可抑制肿瘤发生的黄酮类化合物,可能是通过上调PTEN,失活PI3K/AKT通路,诱导细胞凋亡和自噬而发挥作用[13]。山柰酚还能部分抑制内质网应激反应和炎性反应,有显著增加丝氨酸的磷酸化胰岛素受体底物1(IRS)、C/EBPα及luconeogenic基因的表达,对内质网络应激引起的炎性反应和高血糖有一定的保护作用[14]。Alkhalidy等[15]研究发现,山柰酚增加了Akt和己糖激酶活性,降低了丙酮酸羧化酶(PC)和葡萄糖-6磷酸酶活性,认为山柰酚可能是一种天然存在的抗糖尿病化合物,有抑制葡萄糖的产生和改善胰岛素敏感性的作用。相关临床与实验研究表明,β-sitosterol(β-谷甾醇)具有抗糖尿病、调脂、抗癌、抗风湿等作用[16]。β-谷甾醇能干扰多种细胞信号通路,包括细胞周期、凋亡、增殖、成活、侵袭、血管生成、转移和炎性反应等[17]。汉黄芩素可直接或通过基因诱导细胞凋亡[18-20]、抗新生血管生成[21]。蜕皮甾醇可以改善微循环、抗氧化及保护内皮细胞、降低毛细血管通透性、增强机体免疫功能和调节血管舒缩。陈秋等[22-23]研究发现蜕皮甾醇在体外可通过肝细胞发挥非胰岛素依赖的降糖作用,增加胰岛素的敏感性并能明显改善糖代谢。齐墩果酸(OA)是天然三萜类化合物,具有抗糖尿病活性、抗氧化、抗肿瘤[24]、调节血脂和抗炎活性的糖苷配基[25]。有人提出OA可以保护免受氧化应激诱导的HUVEC细胞凋亡,这与AKT/eNOS信号通路有关[26]。OA明显减弱了Aroclor 1254诱导的胰岛素抵抗和葡萄糖和脂质参数的异常变化;OA可通过HNF1b介导的氧化还原稳态调节来抑制PCBs混合物诱导的氧化损伤和葡萄糖及脂质代谢功能障碍[27]。齐墩果酸可通过IRS-1/PI3K/Akt信号通路改善大鼠果糖过度消耗引起的脂肪组织胰岛素抵抗[28]。
牛膝药靶网络和PCOS网络有22个重叠基因,富集于90条通路。其中有5个靶点富集的通路有非洲锥虫病、甲型流感、疟疾、糖尿病AGE-RAGE信号通路、核因子-κB信号通路、类风湿关节炎、TNF信号通路、HTLV-I感染、癌症通路等,细胞因子中的肿瘤坏死因子(TNF)超家族是一类多功能炎性反应递质,可激活与细胞成活、凋亡、炎性反应和细胞分化相关的信号通路。其中TNF和核因子-κB信号通路在PCOS的发病中发挥了重要的作用。一项研究显示TNF-α可增加其自身信号传导途径相关分子的表达(P<0.05),并降低脂联素及其相关分子的蛋白质水平(P<0.05)[29]。此外,TNF-α增加了核因子-κB的核含量,而核因子-κB抑制剂未观察到TNF-α诱导的脂联素含量降低。TNF-α处理后GLUT-4表达水平较低(P<0.001)。因此,在人子宫内膜基质细胞中,TNF-α高水平可通过降低脂联素信号传导和GLUT-4蛋白质的表达,进而对胰岛素作用产生负面影响。另一项研究显示:lncRNA SRA改变了胰岛素释放,减轻卵巢损伤,并减少小鼠PCOS中血管生成因子的产生[30]。此外,靶向lncRNA SRA的shRNA抑制了PCOS小鼠和原代颗粒细胞中卵巢中DHEA诱导的炎性反应递质产生和核因子-κB的核转位。根据化合物靶点对应关系,牛膝的23个化合物中,指向ESR1和AR靶点的化合物最多,都为19个,其他靶点涉及的化合物为:GSK3B(12个)、ESR2(11个)、PPARG(11个)、ADRB2(9个),因此,ESR1、AR、GSK3B、ESR2、PPARG、ADRB2可能是牛膝在PCOS治疗中涉及的关键基因。一项研究显示,与健康女性相比,来自PCOS女性的卵泡中ESR1基因的表达较低;ESR1多态性与胰岛素抵抗指数和FSH水平的关联,强调了ESR1作为PCOS表型的遗传修饰物的重要性[31]。一项为了评估PCOS参与的雄激素受体(AR信号候选基因)基因的研究中显示[32]:许多研究报道了雄激素受体(AR)基因多态性CAG重复序列与PCOS发生的相关性,而该荟萃的分析表明AR基因的CAG长度变化与PCOS的发生无明显的关联,而CAG长度似乎与PCOS患者的T水平正相关。另有文献研究对比发现牛膝有多种潜在功能,其中止痛、清热解毒、逐瘀通经及消癥功能得到现代临床和实验研究的证实,具有一定消炎止痛、抗病毒、抗肿瘤的作用[33]。Xia等[34]发现在AR基因外显子1中(CAG)n的较短等位基因,可能通过上调AR的活性而引起雄激素过多症,进而增强了对PCOS的易感性。Peng等[35]研究发现雄激素受体(AR)基因第一外显子区域rs6152G/A多态与PCOS明显相关。Mifsud等[36]通过92个PCOS患者和112个正常对照组研究发现在AR基因的外显子1区短的CAG重复序列的长度与无排卵的PCOS患者的低血清雄激素水平有关。Hickey等[37]研究发现AR基因的外显子1区CAG多态和甲基化程度与PCOS的发生发展有关。
牛膝治疗PCOS具有多成分、多靶点的特点,是分子間协同作用的结果,通过干预分子网络、生物过程及信号通路等机制,其对PCOS的治疗主要是通过补肾活血化瘀以发挥抗炎、抗肿瘤、调节血脂、促进微循环及改善胰岛素抵抗等作用。通过对牛膝靶点成分药理作用及其可能机制的回顾,发现其可能通过多种信号通路、细胞凋亡、免疫抑制等途径发挥其抗糖尿病、调脂、抗肿瘤、抗炎等作用。目前,关于多囊卵巢综合征发病机制的研究表明,其多与糖脂代谢紊乱,卵泡颗粒细胞凋亡受阻、细胞炎性反应因子等有关。因此,我们对牛膝化合物成分-PCOS靶点的研究将为中药治疗PCOS提供药理学的理论支持。
参考文献
[1]Azziz R,Carmina E,Chen Z,et al.Polycystic ovary syndrome[J].Nat Rev Dis Primers,2016,2:16057.
[2]Franks S,Gharani N,McCarthy M.Candidate genes in polycystic ovary syndrome[J].Hum Reprod Update,2001,7(4):405-410.
[3]Franks S,Stark J,Hardy K.Follicle dynamics and anovulation in polycystic ovary syndrome[J].Hum Reprod Update,2008,14(4):367-378.
[4]黄一鸣,康开彪,潘文,等.基于数据挖掘多囊卵巢综合征的中医辨证用药规律分析[J].新中医,2018,50(6):60-64.
[5]Wetzel S,Klein K,Renner S,et al.Interactive exploration of chemical space with Scaffold Hunter[J].Nat Chem Biol,2009,5(8):581-3.
[6]Liu C X,Liu R,Fan H R,et al.Network Pharmacology Bridges Traditional Application and Modern Development of Traditional Chinese Medicine[J].中草药:英文版,2015,7(1):3-17.
[7]Jahan S,Abid A,Khalid S,et al.Therapeutic potentials of Quercetin in management of polycystic ovarian syndrome using Letrozole induced rat model:a histological and a biochemical study[J].J Ovarian Res,2018,11(1):26.
[8]Neisy A,Zal F,Seghatoleslam A,et al.Amelioration by quercetin of insulin resistance and uterine GLUT4 and ERα gene expression in rats with polycystic ovary syndrome(PCOS)[J].Reprod Fertil Dev,2019,31(2):315-323.
[9]Khorshidi M,Moini A,Alipoor E,et al.The effects of quercetin supplementation on metabolic and hormonal parameters as well as plasma concentration and gene expression of resistin in overweight or obese women with polycystic ovary syndrome[J].Phytother Res,2018,32(11):2282-2289.
[10]Rezvan N,Moini A,Gorgani-Firuzjaee S,et al.Oral Quercetin Supplementation Enhances Adiponectin Receptor Transcript Expression in Polycystic Ovary Syndrome Patients:A Randomized Placebo-Controlled Double-Blind Clinical Trial[J].Cell J,2018,19(4):627-633.
[11]王針织.槲皮素改善炎症微环境逆转多囊卵巢综合征胰岛素抵抗的机制研究[D].上海:第二军医大学,2014.
[12]Saleem F,Rizvi SW.New Therapeutic Approaches in Obesity and Metabolic Syndrome Associated with Polycystic Ovary Syndrome[J].Cureus,2017,9(11):e1844.
[13]Han X,Liu CF,Gao N,et al.Kaempferol suppresses proliferation but increases apoptosis and autophagy by up-regulating microRNA-340 in human lung cancer cells[J].Biomed Pharmacother,2018,108:809-816.
[14]Kim OK,Jun W,Lee J.Effect of Cudrania tricuspidata and Kaempferol in Endoplasmic Reticulum Stress-Induced Inflammation and Hepatic Insulin Resistance in HepG2 Cells[J].Nutrients,2016,8(1):60.
[15]Alkhalidy H,Moore W,Wang A,et al.Kaempferol ameliorates hyperglycemia through suppressing hepatic gluconeogenesis and enhancing hepatic insulin sensitivity in diet-induced obese mice[J].J Nutr Biochem,2018,58:90-101.
[16]Flampouri E,Theodosi-Palimeri D,Kintzios S.Strobilurin fungicide kresoxim-methyl effects on a cancerous neural cell line:oxidant/antioxidant responses and in vitro migration[J].Toxicol Mech Methods,2018,28(9):709-716.
[17]Bin SMS,Ameen SS.Beta-Sitosterol:A Promising but Orphan Nutraceutical to Fight Against Cancer[J].Nutr Cancer,2015,67(8):1214-1220.
[18]Wang N,Tang LJ,Zhu GQ,et al.Apoptosis induced by baicalin involving up-regulation of P53 and bax in MCF-7 cells[J].J Asian Nat Prod Res,2008,10(11-12):1129-1135.
[19]Chen YC,Shen SC,Lee WR,et al.Wogonin and fisetin induction of apoptosis through activation of caspase 3 cascade and alternative expression of p21 protein in hepatocellular carcinoma cells SK-HEP-1[J].Arch Toxicol,2002,76(5-6):351-359.
[20]况南珍,傅颖媛,黄彬红,等.黄芩苷对人肝癌细胞系SMMC7721抑瘤作用的实验研究[J].时珍国医国药,2008,19(6):1422-1424.
[21]Liu JJ,Huang TS,Cheng WF,et al.Baicalein and baicalin are potent inhibitors of angiogenesis:Inhibition of endothelial cell proliferation,migration and differentiation[J].Int J Cancer,2003,106(4):559-565.
[22]陈秋,夏永鹏,邱宗荫.蜕皮甾酮对HepG2细胞葡萄糖消耗的影响[J].中国药理学通报,2005,21(11):1358-1362.
[23]陈秋,夏永鹏,邱宗荫.蜕皮甾酮对胰岛素抵抗细胞模型胰岛素敏感性和糖代谢的影响[J].中国药理学通报,2006,22(4):460-464.
[24]Wang H,Zhong W,Zhao J,et al.Oleanolic Acid Inhibits Epithelial-Mesenchymal Transition of Hepatocellular Carcinoma by Promoting iNOS Dimerization[J].Mol Cancer Ther,2019,18(1):62-74.
[25]Wang S,Du LB,Jin L,et al.Nano-oleanolic acid alleviates metabolic dysfunctions in rats with high fat and fructose diet[J].Biomed Pharmacother,2018,108:1181-1187.
[26]Zhang W,Feng J,Cheng B,et al.Oleanolic acid protects against oxidative stress-induced human umbilical vein endothelial cell injury by activating AKT/eNOS signaling[J].Mol Med Rep,2018,18(4):3641-3648.
[27]Su S,Wu G,Cheng X,et al.Oleanolic acid attenuates PCBs-induced adiposity and insulin resistance via HNF1b-mediated regulation of redox and PPARγ signaling[J].Free Radic Biol Med,2018,124:122-134.
[28]Ying Li,Jianwei Wang,Tieguang Gu,et al.Oleanolic Acid Supplement Attenuates Liquid Fructose-Induced Adipose Tissue Insulin Resistance Through the Insulin Receptor substrate-1/phosphatidylinositol 3-kinase/Akt Signaling Pathway in Rats[J].Toxicol Appl Pharmacol,2014,277(2):155-163.
[29]Oróstica L,García P,Vera C,et al.Effect of T核因子-α on Molecules Related to the Insulin Action in Endometrial Cells Exposed to Hyperandrogenic and Hyperinsulinic Conditions Characteristics of Polycystic Ovary Syndrome[J].Reprod Sci,2018,25(7):1000-1009.
[30]Li Y,Zhao W,Wang H,et al.Silencing of LncRNA steroid receptor RNA activator attenuates polycystic ovary syndrome in mice[J].Biochimie,2019,157:48-56.
[31]范穎,梁茂新.基于文献研究的牛膝功效的发掘与利用[J].北京中医药大学学报,2015,38(9):594-596,605.
[32]Nectaria X,Leandros L,Ioannis G,et al.The importance of ERα and ERβ gene polymorphisms in PCOS[J].Gynecol Endocrinol,2012,28(7):505-508.
[33]Zhang T,Liang W,Fang M,et al.Association of the CAG repeat polymorphisms in androgen receptor gene with polycystic ovary syndrome:a systemic review and meta-analysis[J].Gene,2013,524(2):161-167.
[34]Xia Y,Che Y,Zhang X,et al.Polymorphic CAG repeat in the androgen receptor gene in polycystic ovary syndrome patients[J].Mol Med Rep,2012,5(5):1330-1334.
[35]Peng CY,Long XY,Lu GX.Association of AR rs6152G/A Gene Polymorphism With Susceptibility to Polycystic Ovary Syndrome in Chinese Women[J].Reprod Fertil Dev,2010,22(5):881-885.
[36]Mifsud A,Ramirez S,Yong EL.Androgen receptor gene CAG trinucleotide repeats in anovulatory infertility and polycystic ovaries[J].J Clin Endocrinol Metab,2000,85(9):3484-3488.
[37]Hickey T,Chandy A,Norman RJ.The androgen receptor CAG repeat polymorphism and X-chromosome inactivation in Australian Caucasian women with infertility related to polycystic ovary syndrome[J].J Clin Endocrinol Metab,2002,87(1):161-165.
(2019-08-22收稿 责任编辑:杨觉雄)
- 中加FTA建立的贸易基础分析和我国的应对策略
- 电子商务环境下我国国际贸易经济的发展模式研究
- 新时代背景下民营企业普通员工激励有效性探析
- 事业单位绩效工资改革中绩效考核管理的难点及应对策略
- 新形势下离退休管理工作的创新路径
- 机关单位员工培训问题及对策研究
- 新形势下事业单位人力资源管理浅析
- 基于管理心理学下的企业人力资源管理工作策略探究
- 跨文化下的中小企业人力资源管理问题及对策
- 互联网+时代下事业单位人力资源管理新趋势
- 深化城市活力建设背景下鞍山发展网红经济对策研究
- 短视频平台网络营销策略研究
- 拼多多电商平台的网络营销策略分析
- 浅析喜茶的网络营销策略
- 长春市旅游网络营销策略
- 网络经济背景下重庆农村电商发展策略研究
- 电子商务模式下绿色供应链发展研究
- 基于5G网络下电子商务物流管理的应用研究
- 基于风险管理视角下拓展投资融资渠道的有效路径探索
- 金融控股公司的监管及监管科技的应用
- 我国私募股权投资的融资研究
- 刍议企业海外绿地投资的非市场风险
- 浅谈融资租赁企业经营、盈利、融资模式
- 我国商业银行零售业务发展现状及策略
- 加强郑州市政府投资基金管理 提升财政资金引导作用
- tailcoat
- tailcoated
- tailcoats
- tailed
- tailers
- tailest
- tailgate
- tailgated
- tailgater
- tailgaters
- tailgates
- tailgating
- tailing
- tailless
- taillessly
- unconducively
- unconduciveness
- unconducivenesses
- unconducted
- unconductible
- unconductive
- unconfederated
- unconferred
- unconfessing
- unconfided
- 光光荡荡
- 光冒气不吭声了
- 光冒烟不着火
- 光凭一张嘴
- 光凭嘴
- 光出力,不出面
- 光出岔子
- 光出气,不出声
- 光出溜
- 光刀
- 光刮风不下雨——干吹
- 光前
- 光前启后
- 光前垂后
- 光前振后
- 光前映后
- 光前绝后
- 光前耀后
- 光前裕后
- 光剩下一张嘴儿
- 光剩下尺
- 光剩下抓虾
- 光剩鹅(讹)了
- 光务
- 光动嘴