史会连 方南元 陈沁磊


摘要 目的:观察化滞柔肝颗粒对高脂诱导的非酒精性脂肪性肝炎小鼠的保护作用及初步機制。方法:将小鼠随机分成正常组、安慰剂组、低、高剂量化滞柔肝组和易善复组,通过高脂饮食喂养8周,经HE染色确定建立了非酒精性脂肪肝肝炎小鼠模型,后各组给予不同药物灌胃,正常组及安慰剂组予以生理盐水灌胃,治疗持续4周。在末次给药后,解剖动物,取血清和肝组织,进行相应的检查。结果:在治疗4周末,HE染色及油红显示模型组肝组织细胞肿胀,脂肪沉积,其体质量、血清ALT、TG水平分别为(41.2±1.7)g、(81.07±3.19)U/L和(2.69±1.30)mmol/L,均显著高于正常组的体质量、血清ALT、TG水平(21.31±1.42)g、(31.2±2.74)U/L和(0.48±0.14)mmol/L(P<0.05),结果显示模型成功建立;后续HE染色、油红染色显示高剂量化滞柔肝组改善肝脏炎性反应及脂质沉积的作用较安慰剂组、低剂量化滞柔肝颗粒组、易善复组更加明显,且后续血清ALT及TG水平结果也和上述结果一致(P<0.05),但各观察组之间AST水平均无明显变化;通过对血清中细胞因子IL-18和IL-1β的检测,结果显示化滞柔肝颗粒组可降低细胞因子IL-18和IL-1β的水平,降低细胞因子的水平且较安慰剂组、易善复组更为明显,且呈剂量依耐性(P<0.05)。结论:化滞柔肝颗粒对高脂饮食诱导的非酒精性脂肪肝肝炎小鼠有保护作用,且和细胞因子IL-18和IL-1β有一定的相关性。
关键词 化滞柔肝颗粒;非酒精性脂肪肝肝炎;白细胞介素-1β;白细胞介素-18
Abstract Objective:To observe the protective effect of Modified Huazhi Rougan Granule on mice model with nonalcoholic steatohepatitis induced by high fat diet and explore its preliminary mechanism.Methods:The mice were randomly divided into normal group,placebo group,low and high dose of Huazhi Rougan Granule group and YiShanFu group.The mice were fed with high-fat diet for 8 weeks,then these mice were confirmed by HE staining to establish the model of nonalcoholic steatohepatitis.After that,each group was given different drugs by gavage for 4 weeks.At the same time,the normal group and placebo group were given normal saline by gavage for 4 weeks.After the last administration,the animals were dissected,serum and liver tissues were taken for corresponding examination.Results:At the end of the 4th week of treatment,HE and oil red staining showed that liver cells were swollen and filled by fat deposition in the model group,and the body weight,serum ALT and TG levels were(41.2±1.7)g,(81.07±3.19)U/L and(2.69±1.30)mmol/L respectively,which were significantly higher than those in the normal group(21.31±1.42)g,(31.2±2.74)U/L and(0.48±0.14)mmol/L(P<0.05); following HE and oil red staining showed that the effect of high dose of Huazhi Rougan Granule group on improving liver inflammation and lipid deposition was more obvious than that of placebo group,low dose of Huazhi Rougan Granule group and Yishanfu group,and the follow-up serum ALT and TG levels were consistent with the above results(P<0.05).However,there was no significant change in AST level among the experimental groups; through the detection of cytokines IL-18 and IL-1 β in serum,the results showed that the Huazhi Rougan Granule group could reduce the levels of cytokines IL-18 and IL-1 β,and reduce the level of cytokines,which was more remarkable than other groups(P<0.05).Conclusion:Huazhi Rougan Granule has protective effect on mice model with nonalcoholic steatohepatitis induced by high-fat diet,and it has certain correlation with IL-18 and IL-1 β.
Keywords Huazhi Rougan Granule; Nonalcoholic steatohepatitis; IL-1 β; IL-18
中图分类号:R453.9 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.22.006
非酒精性脂肪性肝病(Nonalcoholic Fatry Fiver Disease,NAFLD)是一种无过量酒精摄入,以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征。NAFLD成人发病率为6.3% ~45%,其中10% ~30%为非酒精性脂肪肝炎(Non-alcoholic Steatohepatitis,NASH)[1-2],当NAFLD由简单的脂肪变性向NASH转化时,肝脏更易向纤维化,肝脏衰竭和肝细胞癌等进展[3],严重危害人们的健康。因此,NASH的防治显得尤为重要,但目前NASH的具体机制尚不清楚,治疗上西医药物疗效不确切,且容易反弹,在临床工作及前期研究基础中,我们发现中医中药在治疗NASH方面更有优势。化滞柔肝颗粒由茵陈、决明子、柴胡、山楂、大黄、泽泻、白术、苍术、陈皮等组成,具有清热利湿、化浊解毒、祛瘀柔肝而不伤血的作用,临床用于治疗湿热瘀积型非酒精性脂肪肝[4],但目前机制尚不清楚,我们研究了该药在高脂模型NASH鼠中的作用及其机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 所有的动物研究都得到了南京中医药大学动物伦理委员会的批准,本研究采用8至10周龄雄性C57BL/6J野生型小鼠,购买于上海南模生物有限公司(许可证号:QDZ-SHL&CYY),小鼠同室分笼饲养,照明12 h/d,每日补充1次料块和水,环境温度控制在18~22 ℃,湿度60%。
1.1.2 药物 化滞柔肝颗粒(茵陈、决明子、大黄、泽泻、猪苓、山楂、苍术、白术、甘草等)(山东新时代药业有限公司,生产批号:C14000073788);多烯磷脂酰胆碱(易善复)[赛诺菲(北京)制药有限公司,生产批号:B122010049590]。
1.1.3 试剂与仪器 IL-1β试剂盒(Abcam公司,英国,批号:ab197742)和IL-18试剂盒(Abcam公司,英国,批号:ab216165);ALT试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-BC-K235-S)和TG试剂盒(武汉伊莱瑞特生物科技有限公司,批号:E-BC-K261-M);全自动生化分析仪(贝克曼库尔特有限公司,美国,型号:AU5800);组织包埋机(徕卡,德国,型号:Arcadia型);石蜡切片机(徕卡,德国,RM2235);荧光显微镜(徕卡,德国,型号:DM2000LED型);生物显微镜(徕卡,德国,型号:DMI1);通用台式离心机(艾本德,德国,型号:艾本德5810R型)。
1.2 方法
1.2.1 分组与模型制备 将动物分为野生鼠组+普通饮食组(空白组,A组),野生鼠组+高脂饮食组(安慰剂组,B组),野生鼠+高脂饮食+化滞柔肝颗粒低剂量处理组(低剂量组,C组),野生鼠+高脂饮食+化滞柔肝颗粒高剂量处理组(高剂量组,D组)和多烯磷脂酰胆碱组(易善复组,E组),每组动物8只。将动物置于(23±2)℃的清洁动物设施内,并控制每12 h光/暗循环。定期给小鼠喂食普通饲料/高脂饲料饮食,并予以动物饮用灭菌水。各组小鼠予以高脂饮食组/普通饮食喂养8周,高脂饮食由60%的脂肪,1.25%的胆固醇,0.5%w/w胆酸盐组成(HFD饮食)[5]。
1.2.2 给药方法 高脂饮食8周经病理证实形成NASH模型后,除去空白组外,其他各组继续予以高脂饮食,接着A和B组予以生理盐水灌胃做对照,根据体质量公式,C组予以低剂量化滞柔肝颗粒[3.6 g/(kg·d)]灌胃,D组予以高剂量化滞柔肝颗粒[14.4 g/(kg·d)]灌胃,E组予以多烯磷脂酰胆碱[150 mg/(kg·d)]灌胃4周。
1.3 觀测指标与方法 治疗前后均予以小鼠称重,治疗疗程结束后杀鼠,用3%多聚甲醛固定肝组织,常规石蜡包埋切片,HE染色,光学显微镜下观察。取血检测谷丙转氨酶(ALT),谷草转氨酶(AST),三酰甘油(TG)的表达情况,同时通过酶联免疫吸附试验法对动物血清IL-18及IL-1β细胞因子进行检测。
1.3.1 油红染色分析 用4%多聚甲醛将7 μm厚冷冻肝切片固定10 min,用双蒸水冲洗3次,取油红O母液与双蒸水以3∶ 2配制成油红O工作液,并过滤2次,切片用60%异丙醇清洗后,用过滤好的油红O工作液浸染10 min,用双蒸水清洗,再用苏木精染液复染30 s,自来水反蓝,甘油明胶密封,最后用光学显微镜拍照并分析。
1.3.2 血清生化及IL-18和IL-1β标测 取静脉血2 mL,使用BS-200型全自动生化分析仪测定血清中谷丙转氨酶(ALT),谷草转氨酶(AST),三酰甘油(TG),胆固醇(TC)水平的变化。酶联免疫吸附试验根据ELISA试剂盒(eBioscience,San Diego,CA,US)的指示定量血清中IL-1β和IL-18的水平。获得血清,采用IL-1β、IL-18 Elisa试剂盒,严格参照说明书操作,反应终止后,酶标仪测定450 nm处的吸光度值(OD值),根据试剂盒提供的标准品浓度及测定的OD值作标准曲线,计算各组血浆样本浓度,每个样本均设置2个复孔,取均值统计数据。
1.4 统计学方法 采用SPSS 17.0和GraphPad-Prism 5.0统计软件对研究数据进行统计分析,计量资料用均数±标准差(±s),采用单因素方差分析和LSD检验,以P<0.05为差异有统计学意义。
2 结果
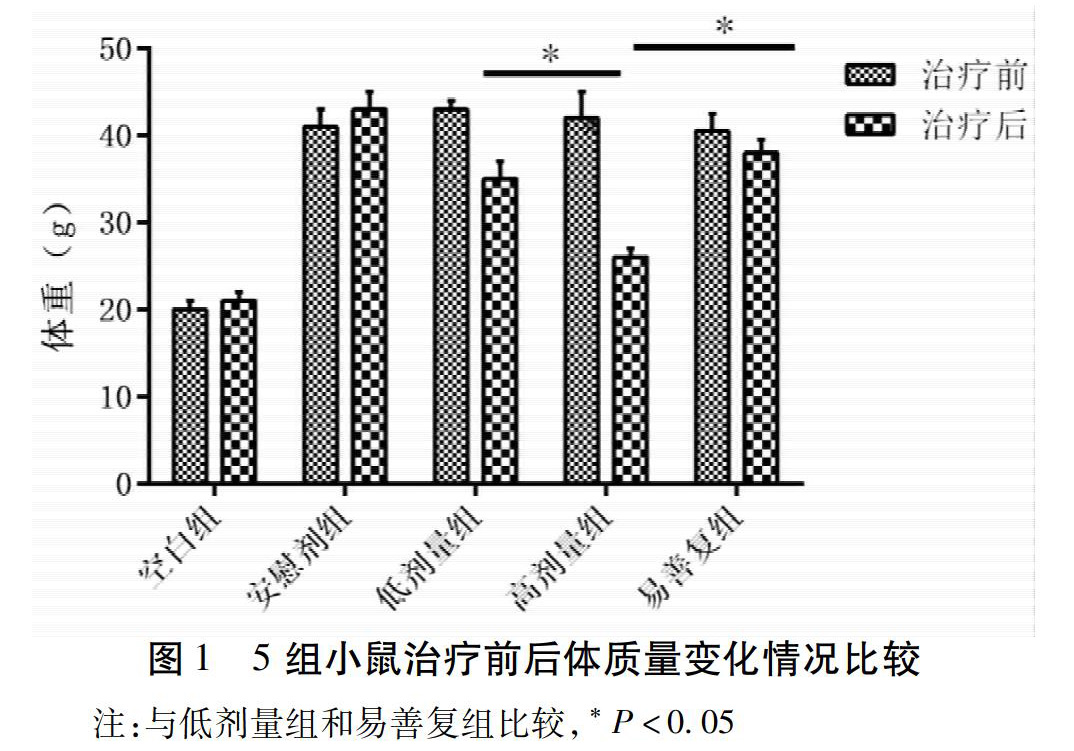
2.1 5组小鼠治疗前后体质量的变化情况比较 ? 与空白对照比较,模型组体质量明显升高,而不同剂量的化滞柔肝颗粒可以降低小鼠的体质量,和对照组、低剂量组、易善复组比较,高剂量组降低体质量的效果最佳,差异有统计学意义(P<0.05)。见图1。
2.2 5组小鼠肝细胞损害改善情况比较 在HFD饮食喂养4周后,HFD模型组的肝切片显示明显的空泡状肝细胞和严重的微小和大泡脂肪变性,并有明显的炎性反应细胞浸润,通过组织学HE染色证实造成NASH小鼠模型。服药疗程结束后的结果显示:与安慰剂组剂易善复组比较,化滞柔肝颗粒可以显著改善HFD饮食诱导的炎性反应变化,且不同浓度化滞柔肝颗粒的作用呈剂量依赖性。见图2。化滞柔肝颗粒可以降低血清中ALT的水平,但化滞柔肝颗粒降低AST的水平不明显。见图3。
2.3 5组小鼠肝脏脂质沉积情况比较 通过油红染色的方法来验证化滞柔肝颗粒对肝脏脂肪变性的改善情况。通过和健康饮食组对照,安慰剂组表现为脂质沉积增加和脂滴积累。研究结果表明,HFD喂养的小鼠肝脏脂肪变性明显高于空白组。口服不同浓度的化滞柔肝颗粒可以减少HFD喂养的小鼠肝脏中脂滴的数量和大小。见图4。通过生化试剂盒检测不同组别小鼠血清中的TG水平,与安慰剂组及易善复组比较,化滞柔肝颗粒可降低血清中TG的水平(P<0.05)。见图5。
2.4 5组小鼠IL-18及IL-1β水平比较 检测了5组小鼠焦亡相关细胞因子IL-18和IL-1β的水平。结果表明,HFD饮食增加小鼠血清中IL-18和IL-1β的表达水平。和安慰剂组和易善复组比较,不同浓度的化滞柔肝颗粒可以减低IL-18和IL-1β的水平,且和剂量有一定的相关性(P<0.05)。见图6、图7。
3 讨论
随着人们饮食和生活方式的改变,全球范围内NASH显著增加,平均发病年龄下降[6]。目前还没有完全证实的药物NASH和肝移植是终末期NASH的唯一治疗方案[7],因此迫切需要找到有效的药物治疗NASH。
既往NASH的發病机制中,很多假设表明NASH是许多因素共同作用的结果,包括遗传易感性、炎性反应,脂质代谢异常,氧化应激,线粒体功能障碍,细胞因子的产生改变,肠道失调和内质网应激等[8-9]。发病机制中的所有关键因素都是潜在治疗NASH的靶点[10],其中炎性反应和脂质代谢异常为NASH发病机制中极其重要的一环,有意思的是在本研究中,我们证明了化滞柔肝颗粒可以减弱HFD诱导NASH形成的炎性反应和脂质代谢异常。
目前用于治疗纳什的疗法包括改变生活方式、减肥手术和药物干预,包括噻唑烷二酮类,维生素E和二甲双胍等药物[8]。但是很多人难以维持健康的生活方式,且手术仍然不是大多数人的首选,而上述药物因为有一些不良反应或多或少收到限制[7],因此研发有效安全的药物治疗方案显得尤其重要。在过去的几十年里,中草药及其衍生化合物在治疗NASH方面由于其高效性和低不良反应风险等优点而广受关注[11-12]。
中医并没有脂肪肝病名,根据病因病机及症状将其分为“胁痛”“痰湿”“积聚”等范畴。病理因素为湿热、痰浊、瘀血,病性为虚实夹杂。化滞柔肝颗粒化滞柔肝颗粒主要成分为决明子、大黄、茵陈、泽泻、陈皮等,具有清热利湿、化浊解毒、祛瘀柔肝的功效,具有降脂与保肝、标本兼治等作用,目前已经在临床上治疗湿热蕴结型非酒精性脂肪肝,并取得很好效果[4]。同样在本研究中,我们证明了化滞柔肝颗粒可以减弱HFD诱导NASH形成的炎性反应和脂质代谢,从而得到治疗NASH的目的。除了非酒精性脂肪肝,关永霞等[13]的研究指出,化滞柔肝颗粒对酒精联合脂多糖诱导的酒精性肝炎小鼠有保护作用,后续研究指出酒精性脂肪肝大鼠伴有肠道屏障功能减弱,化滞柔肝颗粒对酒精性脂肪肝大鼠肠道屏障功能及肝脏功能具有双重保护作用[14],目前有研究指出化滞柔肝颗粒可通过改善胰岛素抵抗[15]、改善肠道毒血症等机制治疗非酒精性脂肪肝,但在动物机制方面研究较少,本研究正好填补了这部分空白。
目前细胞焦亡为机制研究的热点,有研究指出参与了NAFLD的发病及NASH的进展[16]。细胞焦亡是一种新的促炎程序性细胞死亡,它由核苷酸结合寡聚化结构域样受体蛋白3(Nod-like Receptor Protein 3,NLRP3)炎性反应小体促发。NLRP3炎性反应小体是一种细胞内蛋白复合物,可以被多种病原、大分子和环境刺激物激活。有研究指出,高脂血症及高血糖等刺激物可通过诱发细胞内ROS的释放,激活的NLRP3,和凋亡相关斑点样蛋白(Apoptosis-associated Speck-like Protein Containing CARD,ASC)ASC结合,使caspase-1活化,形成NLRP3炎性反应小体,剪切IL-1β和IL-18成熟,通过GSDMD蛋白形成孔径,并导致细胞焦亡,引起炎性反应的扩散及疾病的进展。Alegre Fernando等[17]提出,NLRP3诱发的肝细胞焦亡在NASH炎性反应的发生及肝脏纤维化过程中,起着及其重要的作用。作为焦亡的效应细胞因子,IL-1家族细胞因子(IL-1β/IL-18)通过GSDMD孔释放的炎性反应信号会诱发炎性反应细胞的聚集,再次刺激其他的细胞因子的产生,引起炎性反应扩大化,也有文献指出肝细胞焦亡释放的细胞因子IL-18可促进肝星状细胞(HSCs)的增生和活化,引起肝组织纤维化[18]。而在临床中,詹忠明等[19]提出检测IL-18浓度对反映肝细胞损害程度和判断脂肪肝患儿病情有一定的临床意义。A.E.Feldstein等[20]通过多中心临床研究提出,IL-18可作为非酒精性脂肪肝非侵入性诊断检测指标。在本研究中,我们也发现化滞柔肝颗粒可以减弱HFD诱导NASH形成的炎性反应和脂质代谢,且与细胞因子IL-18和IL-1β呈正相关,考虑化滞柔肝颗粒治疗NASH的作用可能和焦亡信号通路相关,具体机制有待研究的进一步深入。
综上所述,化滞柔肝颗粒可以降低HFD诱导NASH形成的ALT和AST水平,且可以降低NASH模型鼠的TG和TC水平,且与细胞因子IL-18和IL-1β呈正相关,可能是化滞柔肝颗粒治疗NASH的一个靶点,具体机制有待于研究进一步深入。
参考文献
[1]Younossi ZM,Koenig AB,Abdelatif D,et al.GIobal epidemiology of nonalcoholic fatty Iiver disease Metanalytic assessment of prevalence,incidence,and outcomes[J].Hepatology,2016,64(1):73-84.
[2]中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.非酒精性脂肪性肝病防治指南(2018年更新版)[J].临床肝胆病杂志,2018,34(5):947-957.
[3]Takakura Kazuki,Oikawa Tsunekazu,Nakano Masanori et al.Recent Insights Into the Multiple Pathways Driving Non-alcoholic Steatohepatitis-Derived Hepatocellular Carcinoma.[J].Front Oncol,2019,9:762.
[4]王席玲,赵连山,王晓芸.化滞柔肝颗粒对湿热淤积型非酒精性脂肪肝的治疗效果[J].世界中医药,2018,13(7):1669-1672.
[5]Shi H,Zhang Y,Xing J,et al.Baicalin attenuates hepatic injury in NASH cell model by suppressing inaflammsome-dependent GSDMD-mediated cell pyroptosis[J].Int Immunopharmacol,2020,3(8):106195.
[6]Bellentani S.The epidemiology of non-alcoholic fatty liver disease[J].Liver Int,2017,37 Suppl 1:81-84.
[7]Musso G,Cassader M,Gambino.R.Non-alcoholic steatohepatitis:emerging molecular targets and therapeutic strategies[J].Nature reviews.Drug discovery,2016,15(4):249-274.
[8]H.Tilg,A.R.Moschen,Evolution of inflflammation in nonalcoholic fatty liver disease:the multiple parallel hits hypothesis,Hepatology 2010,52:1836-1846.
[9]G.Lassailly,R.Caiazzo,F.Pattou,P.Mathurin,Perspectives on treatment for nonalcoholic steatohepatitis[J].Gastroenterology,2016,150(8):1835-1848.
[10]Rotman Y,Sanyal AJ.Current and upcoming pharmacotherapy for non-alcoholic fatty liver disease[J].Gut,2017,66(1):180-190.
[11]Guo H X,Liu D H,Ma Y,et al.Long-term baicalin administration ameliorates metabolic disorders and hepatic steatosis in rats given a high-fat diet[J].Acta Pharmacologica Sinica,2009,30(11):1505-1512.
[12]Duan X,Meng Q,Wang C,et al.Calycosin attenuates triglyceride accumulation and hepatic fifibrosis in murine model of non-alcoholic steatohepatitis via activating farnesoid X receptor[J].Phytomedicine:international journal of phytotherapy and phytopharmacology,2017,25:83-92.
[13]關永霞,李晓梅,张永霞,等.化滞柔肝颗粒对酒精联合脂多糖诱导的酒精性肝炎小鼠的保护作用[J].实用肝脏病杂志,2015,18(5):530-533.
[14]李晓梅,孙宝存,刘奋,等.酒精性脂肪肝大鼠肠道屏障功能变化及化滞柔肝颗粒的保护作用[J].实用肝脏病杂志,2014,17(2):172-175.
[15]李海霞,周全,王丽,等.化滞柔肝颗粒对非酒精性脂肪性肝炎患者胰岛素抵抗的影响[J].中成药,2017,39(8):1586-1590.
[16]Hirsova P,Gores GJ.Death Receptor-Mediated Cell Death and Proinflammatory Signaling in Nonalcoholic Steatohepatitis[J].Cell Mol Gastroenterol Hepatol,2015,1(1):17-27.
[17]Alegre Fernando,Pelegrin Pablo,Feldstein Ariel E.Inflammasomes in Liver Fibrosis[J].Seminars in Liver Disease,2017,37(2):119-127.
[18]Mehal W,Imaeda A.Cell Death and Fibrogenesis[J].Semin Liver Dis,2010,30(3):226-231.
[19]詹忠明,江永青,胡志坚,等.儿童脂肪肝患者血清IL-18表达水平与肝损伤的关系[J].实验与检验医学,2017,35(2):274-275,283.
[20]A.E.Feldstein,A.Wieckowska,A.R.Lopez,et al.Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis:a multicenter validation study[J].Hepatology(Baltimore,Md.),2009,50(4):1865-1866.
(2020-09-18收稿 责任编辑:王杨)
- 面向项目制造的MES精益生产计划管理研究与实现
- 浅析地质科学研究与区域地质调查
- 王檀教授运用青龙导滞汤治疗咳嗽验案举隅
- 金属冶炼行业事故特点及对策研究
- 浅析事业单位电子档案管理存在的问题及改进措施
- 委托运营模式下职工队伍建设探析
- 泰勒公式常见应用举例探析
- 基于机器学习的水稻地上生物量遥感反演
- 化工安全设计在预防化工事故发生中的作用分析
- 浅析天津市科普统计工作路径及方法
- 从石林县核桃发展现状谈核桃产业发展中存在的问题及对策
- 浅谈如何开展消防监督检查
- 新时期做好消防防火监督工作重难点分析
- 高层建筑的消防隐患及防火监督措施
- 浅谈公共娱乐场所火灾特点及火灾原因调查工作
- 消防救援装备建设的不足及对策分析
- 浅谈如何做好消防战训工作提升灭火救援实战能力
- 浅议如何在灭火救援战斗中提升安全防范工作
- 智慧消防技术在消防管理中的实施对策探讨
- 论无人驾驶卡车在新疆大南湖露天煤矿应用的可行性
- 大于60°煤层开切眼机械化掘进技术
- 浅谈新形势下燃煤发电机组的碳核查工作
- 煤矿机电设备安装要点及质量控制策略
- 复杂地质条件下灾害超前防控与资源高效回收一体化研究及应用
- 考虑风机谐波阻抗的谐波责任划分
- overcuriously
- overcuriousness
- overcuriousnesses
- overcurrent
- overdaintily
- overdaintiness
- overdaintinesses
- overdainty
- overdated
- overday
- overdazzle
- overdazzled
- overdazzles
- overdazzling
- overdebate
- overdebated
- overdebates
- overdebating
- overdebilitate
- overdebilitated
- overdebilitates
- overdebilitating
- overdecadence
- overdecadences
- overdecadent
- 嫘
- 嫘祖
- 嫚
- 嫚侮
- 嫚嫚
- 嫚嫚嬛嬛
- 嫚戏
- 嫚易
- 嫚言
- 嫚语
- 嫚辱
- 嫚骂
- 嫛
- 嫛婗
- 嫜
- 嫟猥昵
- 嫠
- 嫠不恤纬
- 嫠人
- 嫠妇
- 嫠家
- 嫠居
- 嫠忧
- 嫠独
- 嫠纬