蒋茂芬 刘春姣 洪海华

[摘要] 目的 基于NGS方法的基因檢测分析肺癌患者的基因变化,以探讨NGS方法的检测对于肺癌患者临床诊断的应用价值。 方法 选取2017年1月至2018年12月到我院进行诊断并住院治疗的76例初治肺癌患者作为研究对象,收集其治疗前后的临床资料,分析其NGS方法的基因检测结果。 结果 76例肺癌患者在治疗前及治疗后通过NGS方法检测出的基因位点突变的基因型中EGFR基因均具有最高的突变阳性率;治疗前76例患者中有58例患者存在基因位点突变,基因位点突变共计68个,治疗后之前的58例基因位点突变患者仅18例患者存在基因位点突变,基因位点突变共计28个;基因突变主要以EGFR、 KRAS 和MET为主;治疗后患者的例数下降,基因位点突变数由于不良反应上升,基因位点突变数与患者例数比率增加,但是整体患者例数呈下降趋势,提示病情改善患者增加,差异有统计学意义(P<0.05)。 结论 NGS基因检测技术在肺癌基因检测中具有独特的优势,可应用于单细胞和游离的循环DNA,可对从组织样本、胸水细胞蜡块、血液样本等多个样本类型中获取的DNA样本进行准确的基因测序与检测,具有极高的灵敏度与特异性,能够推动对肿瘤基因突变的基础和临床研究,降低检测的经济成本,使其能够实现在肺癌患者的临床诊断和治疗中的推广应用。
[关键词] 肺癌;NGS;基因检测分析;基因变化;肺癌患者;基因未变突变
[Abstract] Objective To explore the application value of NGS method in clinical diagnosis of patients with lung cancer by gene detection and analysis of the genetic changes of lung cancer patients based on NGS method. Methods Among the patients diagnosed and hospitalized in our hospital from January 2017 to December 2018, 76 patients with newly treated lung cancer were selected as objects of the research, and the clinical data before and after treatment were collected to analyze the genetic test results of the NGS method. Results The EGFR gene has the highest mutation positive rate among the genotypes of gene locus mutations detected by NGS method before and after treatment in 76 patients with lung cancer; of the 76 patients before treatment, 58 patients had gene locus mutations, a total of 68 gene locus mutations, and after treatment, only 18 patients had gene locus mutations in 58 patients with gene locus mutations, a total of 28 gene locus mutations; gene mutations are mainly EGFR, KRAS and MET; after treatment, the number of patients decreased, the number of gene locus mutations increased due to adverse reactions, and the ratio of the number of gene locus mutations to the number of patients increased, but the overall number of patients showed a downward trend, indicating that the number of patients with improved condition increased, and the difference was statistically significant(P<0.05). Conclusion NGS gene detection technology has unique advantages in lung cancer gene detection. It can be applied to single cells and free circulating DNA, and be used for accurate gene sequencing and detection of DNA samples obtained from tissue samples, pleural effusion cell wax blocks, blood samples and other samples. With extremely high sensitivity and specificity, it can promote basic and clinical research on tumor gene mutations and reduce the economic cost of detection, which is therefore worthy of wide application in the clinical diagnosis and treatment of patients with lung cancer.
[Key words] Lung cancer; NGS; Gene detection and analysis; Genetic changes; Patients with lung cancer; No genemutations
肺癌是起源于支气管黏膜、腺体或肺泡上皮的肺部恶性肿瘤。最近50年来,肺癌的发病率显著增高,尤其是在欧美工业发达的国家和我国的一些工业大城市[1]。目前肺癌的发病率在男性恶性肿瘤中已居首位,女性发病率也迅速增高,占女性常见恶性肿瘤的第2位或第3位[2]。肺癌已成为危害生命健康的主要疾病之一。随着医学领域生物工程技术的飞速发展,人们对于肺癌发病机制的不断探索,治疗肺癌已经走向靶向治疗等精准治疗的时代[3]。作为一项重要的实验技术,DNA测序(脱氧核糖核酸测序)在生物学研究中具有广泛的应用[4]。英国生物化学家Frederick Sanger和美国生物化学家Walter Gilbert于1980年共同推出了DNA测序技术,并获得了诺贝尔化学奖[5]。在过去的30年中,DNA测序技术取得了飞速的进步。DNA测序技术极大地支持了分子生物学的发展,是分子生物学中最常用的研究技术之一。Sanger的测序方法具有一定的局限性,依赖于电泳分离技术,无法进一步扩展和小型化。因此无法扩展基因组序列的测序程序,另一方面,这种顺序方法的成本非常昂贵[6]。近年来,由于测序技术的飞速发展,许多下一代测序技术应运而生,在过去,它也创造了使用大量劳动和材料密集型序列的许多方法的历史。ABI的第二代基于SOLID的测序和测序技术相继问世,这开启了大规模测序时代的帷幕。下一代测序技术是一种高性能的测序技术,这是对传统测序技术的革命性改进。同时,高通量测序技术(NGS)可一次对数百万甚至数千万个DNA序列进行测序,从而获得了总体成功[7]。NGS的基本原理是边合成边测序,即在Sanger等测序方法的基础上,通过技术创新,用不同颜色的荧光标记四种不同的脱氧核糖核苷三磷酸(Deoxy-ribonucleoside triphosphate,dNTP),当DNA聚合酶合成互补链时,每添加一种dNTP就会释放出不同的荧光,根据捕捉的荧光信号并经过特定的计算机软件处理,从而获得待测DNA的序列信息[8]。本研究通过对76例肺癌患者NGS基因检测,分析其检测结果的差异性,以探讨NGS检测对于治疗肺癌的临床应用价值,并为将来肺癌的临床诊治提供参考。
1 资料与方法
1.1一般资料
选取2017年1月至2018年12月到我院进行诊断并住院治疗的76例患者作为研究对象,其中,男47例,女29例,年龄42~85岁,平均61.41岁。13例患者存在肺部肿瘤家族病史,63例患者不存在肺部肿瘤家族史。本研究已取得本院医学伦理委员会批准。
1.1.1 纳入标准? ①年龄18~70岁,男女均可;②患者参与研究前均未采取任何放化疗治疗;③患者的肺部肿瘤根据《肺癌规范化诊治指南》已经过临床病理确诊,且所有患者具有可以测量的病灶区域,主要脏器功能基本正常;④患者均具有明确的基因检测标本类型,例如肿瘤原发组织、转移灶组织、胸水、外周血等,采集组织标本主要来源于原发肿瘤、转移淋巴结、胸膜、胸水细胞蜡块;⑤受试者自愿加入本研究,签署知情同意书,配合随访。
1.1.2 排除标准? 符合下列条件之一者将不得入选本试验:①不能或不愿意遵从研究方案中的各项要求;②处于孕期、哺乳期的患者(育龄妇女需检查妊娠试验);③处于急性传染病或慢性传染病活动期;④有明确药物过敏史或属过敏体质者;⑤不愿意提供手术组织进行检测的患者;⑥跟踪监测结果评价显示不再需要继续检测;⑦研究者认为患者不宜参加本试验的其他情况。
1.1.3 诊断标准? 参照《肺癌规范化诊治指南(2011年版)》原发性肺癌诊断标准对患者进行诊断;依据国际肺癌研究协会(IASLC)2009年第7版分期标准进行分期;病理类型参照2015版世界卫生组织肺癌组织学分类标准进行分组[4]。
1.2方法
1.2.1 治疗方法? 采用吉西他滨和铂类方案治疗鳞癌;采用培美曲塞和铂类方案治疗腺癌;对EGFR/ALK(Epidermal growth factor receptor/Anaplastic lymphoma kinase)阳性突变的晚期或转移性腺癌患者口服表皮生长因子受体酪氨酸激酶抑制剂(Epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI),直至疾病进展或发生不可耐受的毒副作用停用[9]。
1.2.2 基因检测? 分别在治疗前及治疗后对76例患者进行NGS基因检测。(1)血液样本:无法获得组织样本的患者,收集血液样本。(2)组织样本:组织样本进行石蜡包埋并按照1×1 cm2切片,厚度控制在5~10 μm,将切片样本置于1.5 mL并装有1 mL二甲苯的无菌离心管中进行涡旋处理,持续10 s。按照12 000转/min的速度在室温环境中进行离心处理,持续2 min,丢弃上层清液。在离心管中加入1 mL的无水乙醇并进行涡旋处理,持续10 s。按以上参数重复离心步骤,丢弃上层清液并在室温环境中静置,以便乙醇完全挥发,10 min后加入200 μL的GA(磷酸缓冲液型号)缓冲液以及20 μL的蛋白酶K,充分混匀后在56℃的條件下孵育,持续1 h至样本完全裂解。在90℃的条件下孵育1 h。在样品中加入2 μL浓度为100 mg/mL的核糖核酸酶(ribonuclease,RNaseA),并在室温条件下孵育2 min,加入220 μL的GB(磷酸缓冲液型号)缓冲液并进行涡旋混匀,加入250 μL无水乙醇并进行涡旋处理,充分震荡混匀后,短暂离心使管壁上的溶液收集到管底。将混合液加入一个吸附柱CR2(吸附柱国标型号)中,按照8000转/min的速度在室温条件下进行离心处理,持续2 min,倒掉废液,重新将吸附柱放回收集管中。加入500 μL GD缓冲液(磷酸缓冲盐溶液中的一种型号)按照8000转/min的速度在室温条件下进行离心处理,持续60 s后倒掉废液,将吸附柱放回收集管中。加入600 μL的PW漂洗液(70%~75%的乙醇漂洗溶液),重复以上离心操作。按照12 000转/min的速度在室温条件下进行离心处理,持续2 min后倒掉废液。将吸附柱开盖放置在室温环境中,2~5 min后将吸附柱CR2转入一个干净的离心管中,将65℃预热的30~100 μL洗脱缓冲液TE悬空滴加至吸附膜的中间部位,室温放置2~5 min,按照12 000转/min的速度在室温条件下进行离心处理,持续2 min,将收集有DNA的离心管-20℃保存[10-13]。
将治疗前后获得的DNA样本应用建立的基因文库进行测序,分析各患者的基因突变情况。
1.3 观察指标
对治疗前的患者行NGS检测并将检测结果归纳总结后进行分析对比。使用化疗与口服药物治疗1个月后,对患者进行CT(Computed tomography)等影像学检查,此后每隔2个月进行1次复查。进行跟踪随访时间结束后,对患者的肿瘤未进展或死亡时间进行最后一次评估。采用电话访问、与主治医师进行及时沟通、查阅复查病例的资料等对初始治疗的患者进行随访,以确保研究数据的真实有效。记录治疗前以及治疗后检测出基因突变患者的数量以及具体的基因位点突变情况,分析基因突变特点;对比治疗前以及治疗后检测出基因突变患者的基因位点平均突变个数,分析治疗前后基因变化特点。
1.4 统计学分析
将数据录入SPSS20.0软件进行处理与分析,计量资料采用(x±s)表示,组间比较采用t检验;计数资料采用(n,%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 結果
2.1 基因检测结果
76例肺癌患者治疗前NGS检测结果提示58例患者存在基因突变,突变位点共计68个,突变基因主要以EGFR、KRAS(Kirsten rat sarcoma viral oncogene)和MET(Mesenchymal to epithelial transition factor)为主,EGFR基因突变共30个,KRAS基因突变共有20个,MET基因突变共有15个。见表1。治疗后之前的58例基因位点突变患者仅18例患者存在基因位点突变,突变位点共计28个,基因突变主要以EGFR、KRAS和MET为主,EGFR基因突变共12个,KRAS基因突变共有8个,MET基因突变共有5个。见表2。
2.2 治疗前以及治疗后检测出基因突变患者的基因位点平均突变个数比较
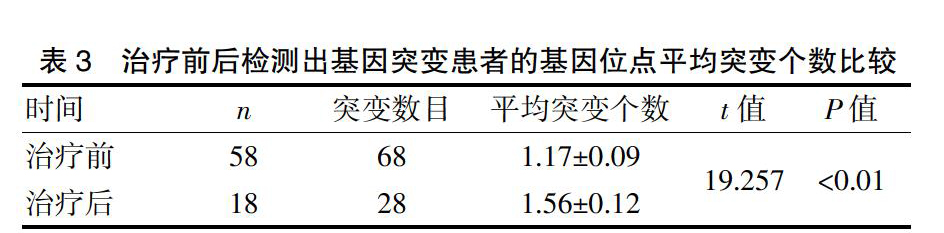
58例初治患者共发现68个基因位点突变,平均突变个数为1.17。治疗后之前的58例基因位点突变患者仅18例患者存在基因位点突变,共发现28个基因位点突变,平均突变个数为1.56,可见治疗后患者的基因突变数目增加,对此可以大胆进行假设患者的基因突变数目上升主要是因为治疗过程中的不良反应所导致的。而根据数据分析能够看出病情改善患者数量显著增加,其差异有统计学意义(P<0.01,t=19.257)。见表3。
3讨论
随着科学技术的发展,NGS技术已经逐步渗透到癌症病理分子诊断领域,其涉及的范围也更为广泛,在实体瘤以及血液恶性肿瘤的临床诊治中均有所涉及[14]。NGS技术利用具有平台特异性的DNA文库进行多重聚合酶链反应(Polymerase chain reaction,PCR),进而完成对目的基因扩增之后的测序。该技术适用于高通量测序,能够对肿瘤中出现的基因组的突变进行检测。NGS技术现已经实现在基因组、外显子组、转录组以及表观基因组等相关的基因研究组中的应用,为治疗肺癌患者的诊治机制以及医疗模式等带来了改变[15]。这项新型技术的开展将改变现如今对于肺癌信号通路的认识,可为癌症的临床治疗提供新的分子靶点[16]。NGS技术作为一种新的高通量测序,能够实现较大规模的平行测序,包括对于多个样品的靶向基因组区域进行同时测序,以实现对相同的运行检测中伴随的突变进行检查[17],能够对多种基因组的异常同时进行高精度和高灵敏度的筛选,例如单/多核苷酸的突变、小基因与大基因的插入和缺失、拷贝数和融合物的转录等,能够克服既往对于少见突变等传统的认识,并且有望实现对等位基因突变进行评估。该技术因其具有可靠的优势,目前在肿瘤领域,尤其是恶性肿瘤领域已实现广泛应用。
本研究中的76例肺腺癌患者NGS基因检测技术下,检测到6种基因的不同突变形式,其中,包括点突变、插入缺失、基因融合以及扩增。本研究的患者在治疗前后经过NGS检测到的基因突变中,EGFR基因突变的阳性率均为最高数值,其次为KRAS和MET。以往研究结果显示,无论是在总体基因突变个数或者是初次治疗肺癌患者人群中,EGFR基因突变的阳性率占比均在50%左右,并且以点突变、插入缺失、基因融合以及扩增为主要的突变形式,大多数为EGFR 19/21外显子突变,该结果与本研究结果较为相似。研究发现[9],TP53(Tumor protein 53)基因突变与EGFR、ALK和KRAS共同存在会使其生存时间变短。但由于本次研究纳入病例数量较小,尚未找到该作者所提出的这一基因与肿瘤演化的实际关联性。近几年来,肿瘤异质性逐渐引起了医学界相关学者的关注,对于肿瘤的演变、转移以及耐药机制等均进行了深入研究[18]。
目前为止,以组织生物标志物为基础进行诊治仍是诊断肺癌患者的金标准,现阶段接近32.5%的肺癌患者因体内没有足够的可用组织进行活检,并且固体活检并不能完全对于肿瘤的异质性进行显示,导致其基因检测受到限制。而“液体活组织检查”的优势在于不会造成侵入、能够反复获取以及经济成本低等,逐渐成为NGS基因检测过程中组织标本的替代物,成为近年来生物医学研究的热点。而本研究中对部分患者进行外周血采集或者制作胸水细胞蜡块,并将其作为NGS基因检测的样本,结果显示应用NGS基因检测对组织样本、血液样本、胸水细胞蜡块样本进行基因测序,均明确检测出其中EGFR、KRAS、MET、ALK、RET、PIK3CA等基因突变情况,说明应用NGS对组织标本或者液体标本进行基因检测均可获得准确的基因突变数据。Erin等[19]表示NGS能够对血液或其他体液进行低丰度ctDNA的检测,以NGS作为基础的诊断方法,使用中性福尔马林样品活检进行基因检测的检测方式已经被证实具有相对的高敏感性和特异性。该结论与本研究的结果相符。
刘东来等[20]研究提出随着对肿瘤的持续治疗,其肿瘤异质性明显增加,其药物耐药性也有所增加,进一步说明肿瘤异质性是导致药物耐药性的关键原因。而本研究中58例存在基因突变的患者在治疗后仅有18例存在基因突变,说明本研究所提出的治疗方法能够有效降低患者体内的肿瘤基因在耐药方向的突变风险。但基因突变的平均突变数相比于治疗前明显提高,证实不同的个体化治疗策略在一定程度上对患者的基因突变具有影响,另一方面,本研究所得到的治疗方式的优化,能够在临床上对于患者的病症情况进更为精准明确的分析,使无病灶患者能够有效避免溢出治疗所带来的额外高昂治疗费用以及不良反应。NGS的高效化、计算机化和生物信息化技术在推动科技进步的同时,患者知情权和数据发布的相关伦理问题也逐渐体现出来。该技术仍有部分局限性,如需要的时间、实验设备不便捷以及计算机数据分析等各方面需要大量的投入。
NGS基因检测技术在肺癌基因检测中具有独特的优势,可应用于单细胞和游离的ctDNA,同时可对从组织样本、胸水细胞蜡块、血液样本等多个样本类型中获取的DNA样本进行准确的基因测序与检测,具有极高的灵敏度与特异性,能够推动肿瘤基因突变的基础和临床研究,降低检测的经济成本,使其能够实现在肺癌患者的临床诊断和治疗中的推广应用。
[参考文献]
[1] 王琼,吕亚莉,钟梅,等.二代测序技术检测肺癌相关基因突变状态临床病理意义[J].中华肿瘤防治杂志,2018, 4(2):1-6.
[2] 郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[3] 李伟明,王景辉,宋学坤,等.高通量测序检测晚期肺腺癌患者EGFR基因结果与临床的相关性[J].中国实用医刊,2019,45(4):7-12.
[4] Liu Y,Xu C,Wang WX,et al.Genomic profiling of gene abcrrations in 323 Chinese NSCLC patients[J]. J Thorac Oncol,2019,13(4):S12-S13.
[5] 魏雨晴. 基于二代测序检测的非小细胞肺癌患者EGFR-TKIs治疗后三种疾病进展模式的基因突变和生存分析[D].南京大学,2019.
[6] 刘苗苗,南岩东,鲁曦,等.二代测序技术在肺癌组织相关基因突变检测中的临床应用价值[J].中华诊断学电子杂志,2019,7(2):103-108.
[7] 黄清洁. 基于二代测序的非小细胞肺癌基因突变表型及临床病理特征分析[D].郑州大学,2019.
[8] 黄清洁,陈天东,陈海瑞,等.基于二代测序的300例非小细胞肺癌中驱动基因突变与临床病理特征的关系[J].临床与实验病理学杂志,2019,35(3):286-290.
[9] 周丽,张越峰,姚国丽,等.二代测序技术对晚期非小细胞肺癌的临床意义[J].中国乡村医药,2019,26(6):84-86.
[10] 苏海翔,刘超敏,郭亚楠,等.液体活检技术在肺癌精准医疗中的应用[J].甘肃医药,2019,38(2):100-104.
[11] 陈宇,张绪超,郭伟浜,等.“去重”在肺癌NGS数据分析中的重要作用[J]. 肿瘤防治研究,2018,45(1):7-10.
[12] 袁雪. 基于NGS檢测的晚期非鳞非小细胞肺癌的临床研究[D].大连医科大学,2019.
[13] 徐澄澄.二代测序法基因检测指导EGFR突变的晚期非小细胞肺癌患者EGFR-TKIs获得性耐药后续治疗策略的临床研究[J].广西医科大学学报,2019,35(12):1620-1623.
[14] 刘苗苗,南岩东,房延凤,等.基于二代测序的肺癌患者外周血ctDNA突变与临床病理特征的相关性研究[J].国际呼吸杂志,2019,3(14):1041-1046.
[15] 熊东海,Raymond U Osarogiagbon,王嫣,等.驱动基因作为肺癌预防和治疗的靶标[J]. 化学进展,2019,25(9):1517-1525.
[16] 翚缨,曾灏.二代测序技术在实体肿瘤诊疗中的应用进展[J].中国医药科学,2020,(20):40-43
[17] 李研,张繁霜,郭蕾,等.基于二代测序技术的循环肿瘤DNA检测在表皮生长因子受体酪氨酸激酶抑制剂耐药肺癌患者耐药基因检测中的应用[J].中华病理学杂志,2019,47(12):904-909.
[18] Weng L,Wang L,Chen X,et al. Detecting ultra low-frequency variants and gene fusions in lung cancer patients using an amplicon-based Firefly NGS method[J]. Journal of Clinical Oncology,2018,12(224):456.
[19] Erin L Crawford,Thomas M Blomquist,James C Willey. Conversion of the Lung Cancer Risk Test (LCRT) to a next generation sequencing(NGS)platform[J]. Cancer Research,2019,75(15):4259.
[20] 刘东来,张鑫媛,周海卫,等.肺癌相关基因突变二代测序检测试剂参考品的建立[J].中国新药杂志,2019,27(21):2490-2497.
(收稿日期:2020-05-20)
- 从“求真”到“审美”:由《烈火英雄》观照新闻改编电影之维
- 幻象之维:金基德电影中的新古典主义东方美学
- “符号·人本”“被言说·言说”“道具·审美”
- 乡土·映像·国家:国产农村类型片的世纪新篇
- 类型策略与国际传播:2019年越南电影概观
- 《囧妈》之争:流媒体之媒介迷思与国产电影结构性困局
- “封神宇宙”的可能性和限度:《哪吒之魔童降世》的“新神话”问题
- 文化地理学视阈下的“四川电影”
- 改革开放以来四川电影的创作状况、主要特色与演进趋势
- 早期四川电影放映地形图
- “建国”叙事: 经典重大题材电影之国家形象研究
- 从《银翼杀手2049》解码 欧美电影之赛博朋克文化
- 形态·技法·格调:张艺谋银幕审美三题
- 《一条狗的使命》多维叙事的“轮回”时空投射
- 叙事伦理、社会镜像与生态摹拟:电影中动物形象的多元文化意蕴
- 《我和我的祖国》:人民史观、集体叙事及文化认同
- 由电视纪录片《侗族大歌》探寻侗戏非遗的多维价值
- 电视剧《奢香夫人》:生命家园的找寻、回归与追问
- 媒介迭新视阈下国产动漫产业拓新
- 神话与现实:中国动画电影的现代性改编
- 苦闷的灵魂:曹禺作品改编电影的再创作与人格折射
- 李睿珺银幕之旅:“他者”镜像与“在场”言说
- 打破与超越:盖·里奇电影的狂欢性、解构性与荒诞性
- 更迭·能指·重构:21世纪工业类型片之东北映像
- 民间性、民族性与时代性:早期国产音乐电影的“在场性”
- roundednesses
- roundednessroundedroundedness
- rounder
- rounders
- roundest
- rounding
- roundlot
- round lot
- roundness
- roundnesses
- round off
- rounds
- round sb/sth up
- round sb/sth ↔ up
- round sth off
- round sth out
- round sth up
- round sth up/down
- round sth up/down (to sth)
- round sth ↔ down
- round sth ↔ off
- round table
- roundtable
- round the back
- round-the-clock
- 箜篌引
- 箝
- 箝制
- 箝勒
- 箝口
- 箝口不言
- 箝口侧目
- 箝口结舌
- 箝塞
- 箝头管脚
- 箝揣
- 箝束
- 箝求
- 箝结
- 箝络
- 箝语
- 箝默
- 箟
- 箟簬
- 箟𥳆
- 箠
- 管
- 管丈母娘叫大嫂子——没话找话
- 管三军不吃淡饭
- 管不了庙里的事