李月玲 郑薇薇 邵喆

摘要:分子排阻色谱法广泛用于治疗性蛋白质药物的质量控制,也是治疗性抗体质量控制的重要手段。由于色谱柱基质与蛋白质尤其是聚集体常有非特异性相互作用,质量控制的分子排阻色谱法常常低估聚集体的含量,因此用于质量控制的SEC方法不一定适用于高聚集体含量样品的分析。本文希望通过在流动相中添加精氨酸来建立一种更适用于高含量聚集体样品分析的分子排阻色谱法。文中阐述了该分析方法的建立并对该方法进行了方法学验证。结果表明该分析方法的专属性、精密度和准确度均符合要求,适合用于高比例聚集体样品的分析。
关键词:分子排阻色谱法;聚集体;抗体
【中图分类号】R-2 ??【文献标识码】A ??【文章编号】1673-9026(2020)06-091-03
治疗性蛋白质由于分子本身的复杂性,往往含有引起免疫原性反应的聚集体,给病人带来严重的安全性风险,所以对于治疗性蛋白聚集体的分析在治疗性蛋白的质量控制中尤为重要[1]。单克隆抗体亦是如此[2]。分子排阻色谱法(SEC)常作为治疗性蛋白聚集体比例分析的方法,是治疗性蛋白质量控制的主要手段之一[3]。但是,由于蛋白质与基质的非特异性相互作用,导致分子排阻色谱法检测得到结果失真。研究表明聚集体更易与基质发生非特异性相互作用,保留在色谱柱内而不能被洗脱[4]。影响非特异性相互作用的因素有很多,如色谱柱基质类型、流动相的PH和离子强度等[5]。一旦,分子排阻色谱法的一些参数确定下来,可以利用流动相添加剂来改善聚集体的分离情况。分子排阻色谱法在行业内普遍用于质量控制,分析单克隆抗体时,通常采用0.1M磷酸盐-0.1M硫酸钠作为流动相。本文主要研究了在现有方法的基础上,流动相中添加精氨酸对分子排阻色谱法性能的影响,并对新建立的方法进行性方法学验证。
1.实验材料与方法
1.1.材料
5个自主生产的单克隆抗体产品,均为液体制剂。分别编号为IgG-1,IgG-2,IgG-3,IgG-4 、IgG-5和IgG-5H(由IgG-5H的高温破坏得到)。磷酸二氢钾和硫酸钠均购自阿拉丁,盐酸和氢氧化钠购自国药试剂,精氨酸(Arg)购自默克,水为Mili-Q超纯水,0.22μm滤器购自密理博。
色谱柱及其保护柱购自东曹,色谱柱型号TSK gel G3000SWXL(7.8mm×30cm,5μm);液相色谱仪为安捷伦1260,紫外检测器。
1.2.方法
样品准备,0.1 M Na2SO4-0.1 M KH2PO4溶液稀释到5.0 mg/ mL。IgG-5置于65℃孵育0.5h、1、2h、3h后获得高聚集体比例样品IgG-5H1、IgG-5H2、IgG-5H3、IgG-5H4,检测前用0.1 M Na2SO4-0.1 M KH2PO4溶液稀释至5.0 mg/ mL,0.22μm滤器过滤后使用。
优化的液相色谱方法参数,流动相为在0.1M KH2PO4-0.1 M Na2SO4溶液中加入0.4M的精氨酸,pH6.7。进样体积10μL,柱温25℃,流速1.0 mL/min,等度洗脱20 min,采用面积归一化法计算。
1.3.方法验证
参照ICH Q2(R1)指南,分别对方法的专属性、精密度、准确度和线性进行了考察[6]。方法的专属性通过聚集体与单体的分离度,以及辅料对检测的干扰来评价。方法的准确度通过不同浓度样品的检测结果与“真值”的偏离来评价。精密度考察了重复性和中间精密度。重复性通过不同浓度的样品的检测结果来评价,中间精密度通过日间和不同仪器的检测结果来评价。线性通过峰面积相对浓度的线性回归来评价。
2.结果
2.1.方法开发
2.1.1.精氨酸的添加量
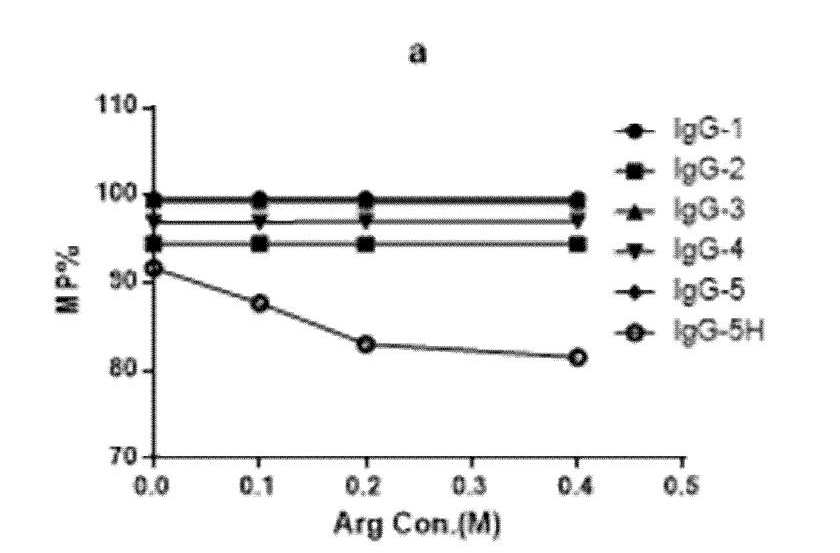
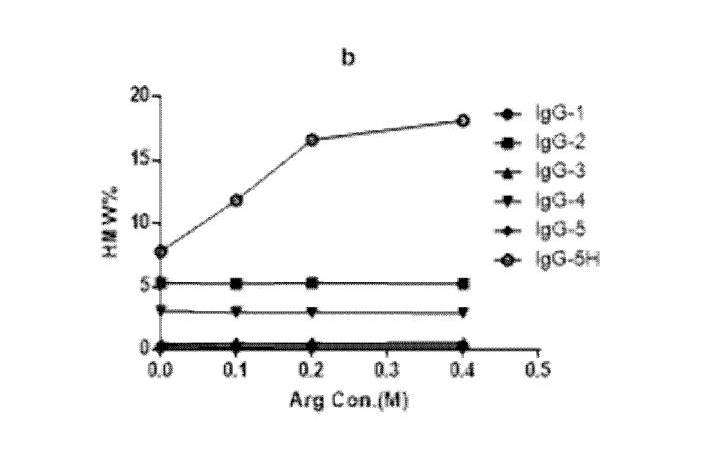
为了研究的流动相中精氨酸添加量,用添加不同量精氨酸的流動相分别分析5种单抗,及1种高聚集体含量样品。流动相分别含有0M,0.1M,0.2M,0.4M的精氨酸,检测结果见图1。结果表明精氨酸的添加对5中单抗的分析结果无影响,但对高聚集体含量样品IgG-5H的分析结果影响较大。随着精氨酸浓度的增加,IgG-5H单体(MP)含量逐渐下降,聚集体(HMW)含量逐渐增加,单体峰面积基本不受影响,聚集体峰面积逐渐增加。故在后续实验中选择在流动相中添加0.4M精氨酸。
2.1.2.流动相中添加0.4 M精氨酸对不同聚集体含量样品分析的影响
分别用含0 M精氨酸和0.4 M精氨酸的0.1 M Na2SO4-0.1 M KH2PO4溶液做流动相,按2.1方法分析样品IgG-5、IgG-5H1、IgG-5H2、IgG-5H3、IgG-5H4,检测结果见表1。结果表明,聚集体含量越高的样品D的绝对值越大,受影响越严重。说明样品中的聚体更易于基质的发生非特异相互作用,正是这种非特性相互作用导致聚集体含量被低估。
2.2.方法验证
2.2.1.专属性
取IgG5、IgG-5H3、辅料溶液样品各1份检测,结果显示该方法可以分离聚集体(HMW)与主峰(MP),且辅料峰不影响检测。
2.2.2.线性考察
取样品IgG-5H3,配制1.0 mg/mL,2.5 mg/mL,5.0 mg/mL,7.5 mg/mL,10.0mg/mL,共5个浓度点。以浓度(横坐标)相对峰面积(纵坐标)做线性回归。结果显示主峰和聚集体的线性相关系数R2值分别为1.0000和0.9996,证明在1~10mg/mL浓度范围内线性关系良好。
2.2.3.准确度
取样品IgG-5H3,配置4.0mg/mL、5.0mg/mL和7.5 mg/mL3个浓度点的样品,每个浓度配置6份,进行检测,取6份结果的平均值作为结果。以5.0mg/mL的检测结果为真值,计算各组分比例的差值。结果表明,在4.0~7.5mg/mL范围内单体、聚集体和低分子差值在1.0%以内,准确度良好。
2.2.4.精密度
取樣品IgG-5H3,配置4.0 mg/mL、5.0 mg/mL和7.5 mg/mL 3个浓度点的样品,进行检测,3个浓度点的聚集体%、单体%和低分子%的RSD分别为1.7%、0.40%和2.8%(见表2的第一次实验)。重新制备样品,在不同的仪器上用相同的方法做检测,两次实验聚集体%、单体%和低分子%的总RSD分别为1.7%、0.37%和3.5%。精密度良好。
3.讨论
单克隆抗体中的聚集体会引发免疫原性,危害病人安全。在单克隆抗体的质量控制中,利用SEC-HPLC分析产品的聚集体含量对单克隆抗体进行质量控制,已写入欧盟药典。实验证明,磷酸盐-氯化钠流动相在分析低聚集体含量的样品时,尚能胜任。但是在分析高聚集体含量的样品时,常常造成聚集体含量的低估。本文通过在流动相中添加精氨酸,抑制聚集体与基质之间的非特异性相互作用,提高了检测数据的质量,使检测结果更准确可靠。所以在分析高聚集体含量样品或与基质非特异性相互作用较强样品时,建议在流动相中添加适当比例的添加物以得到更可靠的数据。
参考文献
1.W. Wang, Protein aggregation and its inhibition in biopharmaceutics, Int. J.Pharm. 289 (2005) 1–30.
2.M. Vázquez-Rey,D.A. Lang,Aggregates in monoclonal antibody manufacturing processes,Biotechnol. Bioeng. 108 (2011) 1494–1508.
3.Engelsman,J.; Garidel, P.; Smulders,R.; Koll, H.; Smith,B.; Bassarab,S.; Seidl,A.; Hainzl,O.;Jiskoot,W. Strategies for the Assessment of Protein Aggregates in Pharmaceutical Biotech Product Development. Pharmaceutical Research 2010,1–14.
4.Herold M.1993. SEC:Influence of salt concentration in the mobile phase. Am Lab 25:35–38.
5.T. Arakawa,D. Ejima,T. Li,J.S. Philo,The critical role of mobile phase composition in size exclusion chromatography of protein pharmaceuticals,J.Pharm. Sci. 99 (2010) 1674–1692.
6.I.C.H. Q2(R1),Validation of Analytical Procedures: Text and Methodology,2005
- 基于双重流水同步迭代的SM3算法高速硬件设计
- 如何使IT与OT安全协同工作
- 基于大数据的网络信息安全防护策略
- 2019年网络安全威胁
- 高效漏洞管理的7项基本原则
- 2020年值得关注的网络安全公司
- 盘点2019年十大数据泄露事件
- 物联网为医疗机构打造的5项业务平台
- 区块链驱动金融创新的实践研究
- 石油化工自动化技术的发展现状及分析
- 智能煤场的设计与应用
- 未来推动企业创新的10种优秀技术
- 基于符号语义映射神经网络模型的知识图谱表示学习算法
- 展望未来制定物联网的标准
- 如何开发“智能助理”平台
- 《网易云音乐7》体验
- 教你轻松调整硬盘分区
- 《微信7.0.10》黑暗模式终于来啦
- 学校办公管理中Office办公软件的应用
- 盘点曾经火爆现在却鲜有人用的软件
- 超高好评率的3款内存
- 华为Sound X音质与智能体验完美结合的新选择
- 车载居家冷热两用倍思零度空间专属冰箱
- 三星CTG9&CTG7闪耀CES2020
- 高通正式发布骁龙XR2 5G平台和全新骁龙计算产品组合
- propellors
- propels
- propensities
- propensity
- propensive
- propeptide
- proper
- properer
- properest
- properly
- proper name
- proper names
- proper-names'
- properness
- propernesses
- proper noun
- proper nouns
- proper-nouns'
- propers
- properties
- property
- propertybond
- property bond
- property company
- propertycompany
- 激荡喷涌
- 激荡的水流
- 激薄停浇
- 激衷
- 激讦
- 激贪
- 激贪厉浊
- 激赏
- 激赞
- 激起
- 激起人粪
- 激起公粪(愤)
- 激起愤慨
- 激起民愤
- 激起民粪(愤)
- 激起波浪
- 激起白色浪花的急流
- 激越
- 激越昂扬
- 激越豪放的乐曲或文辞
- 激越高亢
- 激跳
- 激进
- 激进派
- 激进词