代晓晓 鞠波

[摘要]目的探討上调miR-19b表达对H2O2诱导的SH-SY5Y细胞损伤的影响及机制。方法体外培养SH-SY5Y细胞,将其分为对照组、H2O2组、H2O2+miR-NC组和H2O2+miR-19b组,采用实时荧光定量PCR(RT-PCR)检测各组细胞中miR-19b表达,四甲基噻唑蓝(MTT)法和流式细胞仪分别检测细胞存活率和凋亡率,相关试剂盒检测细胞上清液中乳酸脱氢酶(LDH)、细胞内超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽还原酶(GSH-Px)水平,蛋白印迹(Western blot)检测各组细胞中磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)和磷酸化AKT(p-AKT)等蛋白表达。结果与对照组相比,H2O2组细胞中miR-19b表达、细胞存活率和细胞内SOD、GSH-Px活力及PI3K、p-AKT蛋白表达水平均降低(P均<0.05),而细胞凋亡率、LDH活力和MDA含量均升高(P均<0.05)。与H2O2组相比较,H2O2+miR-19b组miR-19b表达、细胞存活率和细胞内SOD、GSH-Px活力以及PI3K、p-AKT蛋白表达水平均升高(P均<0.05),而细胞凋亡率、LDH活力和MDA含量均降低(P均<0.05)。结论上调miR-19b表达可提高H2O2诱导的SH-SY5Y神经细胞存活率,减轻细胞凋亡和氧化应激损伤,其作用机制可能与激活PI3K/AKT信号通路有关。
[关键词]miR-19b;神经细胞;细胞凋亡;氧化应激;PI3K/AKT信号通路
[中图分类号]R322.8;R342.2[文献标志码]A[文章编号]2096-5532(2021)01-0082-05
[ABSTRACT]ObjectiveTo investigate the effect of miR-19b upregulation on H2O2-induced SH-SY5Y cell injury and rela-ted mechanism. MethodsSH-SY5Y cells were cultured in vitro and were then divided into control group, H2O2 group, H2O2+miR-NC group, and H2O2+miR-19b group. RT-PCR was used to measure the expression of miR-19b in each group; MTT assay and flow cytometry were used to measure cell viability and apoptosis rate, respectively; related kits were used to measure the level of lactate dehydrogenase (LDH) in cell supernatant and the levels of superoxide dismutase (SOD), malondialdehyde (MDA), and glutathione peroxidase (GSH-Px) in cells; Western blot was used to measure the protein expression of phosphoinositide 3-kinase (PI3K), protein kinase B (AKT), and phosphorylated AKT (p-AKT). ResultsCompared with the control group, the H2O2 group had significant reductions in the expression of miR-19b in cells, cell viability, the activities of SOD and GSH-Px in cells, and the protein expression levels of PI3K and p-AKT (all P<0.05), as well as significant increases in cell apoptosis rate, LDH activity, and MDA content (all P<0.05). Compared with the H2O2 group, the H2O2+miR-19b group had significant increases in the expression of miR-19b, cell viability, the activities of SOD and GSH-Px, and the protein expression levels of PI3K and p-AKT (all P<0.05), as well as significant reductions in cell apoptosis rate, LDH activity, and MDA content (all P<0.05). ConclusionUpregulation of miR-19b can increase the viability of H2O2-induced SH-SY5Y cells and reduce cell apoptosis and oxidative stress injury, possibly by activating the PI3K/AKT signaling pathway.
[KEY WORDS]miR-19b; nerve cells; apoptosis; oxidative stress; PI3K/AKT signaling pathway
阿尔茨海默病和帕金森病等神经退行性疾病严重威胁人类生命健康,给病人家庭及社会造成了巨大的经济压力。研究显示,氧化应激诱导的神经细胞损伤与神经退行性疾病的发生发展密切相关[1-2],减轻氧化应激诱导的神经细胞损伤对于神经退行性疾病的治疗尤为重要。微小RNA(miRNA)是一类内源性短链非编码RNA,参与调控细胞凋亡、氧化应激和炎症反应等生理或病理过程,在人类多种疾病的发生发展中发挥重要的作用[3-5]。MiR-19b是miR-17-92基因簇家族成员,在改善氧化应激所致的心肌损伤、肺损伤等方面发挥积极作用[6-7]。过氧化氢(H2O2)是细胞氧化代谢的重要产物,可以穿透细胞膜与胞内还原型铁离子反应产生羟自由基,能够造成多种组织细胞损伤,常用于建立细胞损伤模型[8-9]。有文献报道,miR-19b在阿尔茨海默病病人血清中表达下调,而上调其表达可改善阿尔茨海默病大鼠的认知功能[10]。但目前,miR-19b是否在H2O2诱导的神经细胞损伤中发挥保护作用尚不清楚。因此,本研究主要观察了上调miR-19b表达对H2O2诱导的神经细胞SH-SY5Y损伤的影响,并探讨其可能的分子机制,旨在为改善H2O2所致神经损伤提供新靶点。
1材料与方法
1.1主要试剂
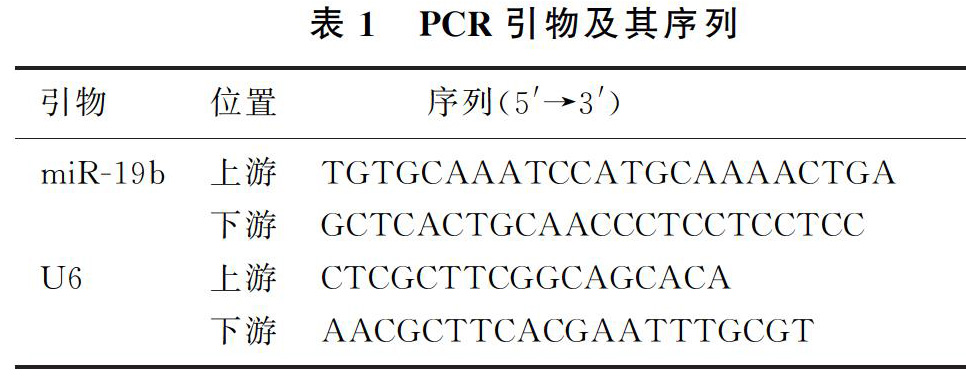
人神经母细胞瘤SH-SY5Y细胞株购于上海锐聪实验设备有限公司,乳酸脱氢酶(LDH)和细胞内超氧化物歧化酶(SOD)、丙二醛(MDA)和谷胱甘肽还原酶(GSH-Px)试剂盒购于南京建成科技有限公司,1640培养液、胎牛血清和2.5 g/L胰蛋白酶购于美国Gibco公司,辣根过氧化酶标记的羊抗鼠或兔IgG抗体、BCA蛋白浓度测定试剂盒和细胞凋亡检测试剂盒购于碧云天生物技术研究所,磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路相关蛋白PI3K、AKT、磷酸化AKT(p-AKT)和甘油醛-3-磷酸脱氢酶(GAPDH)抗體均购于美国Santa Cruz公司,四甲基噻唑蓝(MTT)试剂购于美国Sigma公司。转染试剂脂质体2000以及总RNA提取试剂(Trizol试剂)购于美国Invitrogen公司。miR-19b引物序列、miR-19b模拟物及其阴性对照购于广州锐博生物公司。实时荧光定量PCR(RT-PCR)试剂盒购于大连宝生物公司。
1.2实验方法
1.2.1细胞培养、转染和分组处理采用含体积分数0.10胎牛血清的1640培养基于37 ℃、饱和湿度和体积分数0.05 CO2培养箱内常规培养SH-SY5Y细胞。将对数生长期的SH-SY5Y细胞种植于细胞板上,常规培养。待细胞融合度达75%时,参照脂质体2000说明书步骤将miR-19b模拟物及其对照序列分别转染至SH-SY5Y细胞。将细胞分为如下4组:①对照组(A组):SH-SY5Y细胞未处理,常规培养24 h;②H2O2组(B组):200 μmol/L的H2O2处理SH-SY5Y细胞24 h;③H2O2+miR-NC组(C组):200 μmol/L的H2O2处理转染miR-19b模拟物对照序列的SH-SY5Y细胞24 h;④H2O2+miR-19b组(D组):200 μmol/L的H2O2处理转染miR-19b模拟物的SH-SY5Y细胞24 h。
1.2.2RT-PCR检测细胞中miR-19b的表达以2.5 g/L胰蛋白酶消化收集处理4组细胞后,采用Trizol法提取各组细胞的总RNA后,使用紫外线分光光度计检测RNA的浓度与纯度。参照RT-PCR试剂盒说明书步骤将RNA进行逆转录,并以逆转录产物为模板,使用广州锐博生物公司合成的PCR引物上PCR仪进行扩增。PCR引物及其序列见表1。反应条件:95 ℃预变性6 min;95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸30 s,循环40次。以U6为内参照,采用2-△△Ct法检测各组细胞中miR-19b的表达水平。实验重复3次。
1.2.3MTT法检测细胞存活率将细胞接种至96孔细胞板上,按照1.2.1进行分组处理。每组实验设置5个复孔。处理结束后,弃上清液,加入5 g/L的 MTT溶液,于培养箱内孵育4 h。加二甲基亚砜溶液震荡反应15 min后,用酶标仪检测各组细胞在490 nm波长处的吸光度值(A),并计算各组细胞的存活率。存活率(%)=(实验值A/对照组A)×100%。实验重复3次。
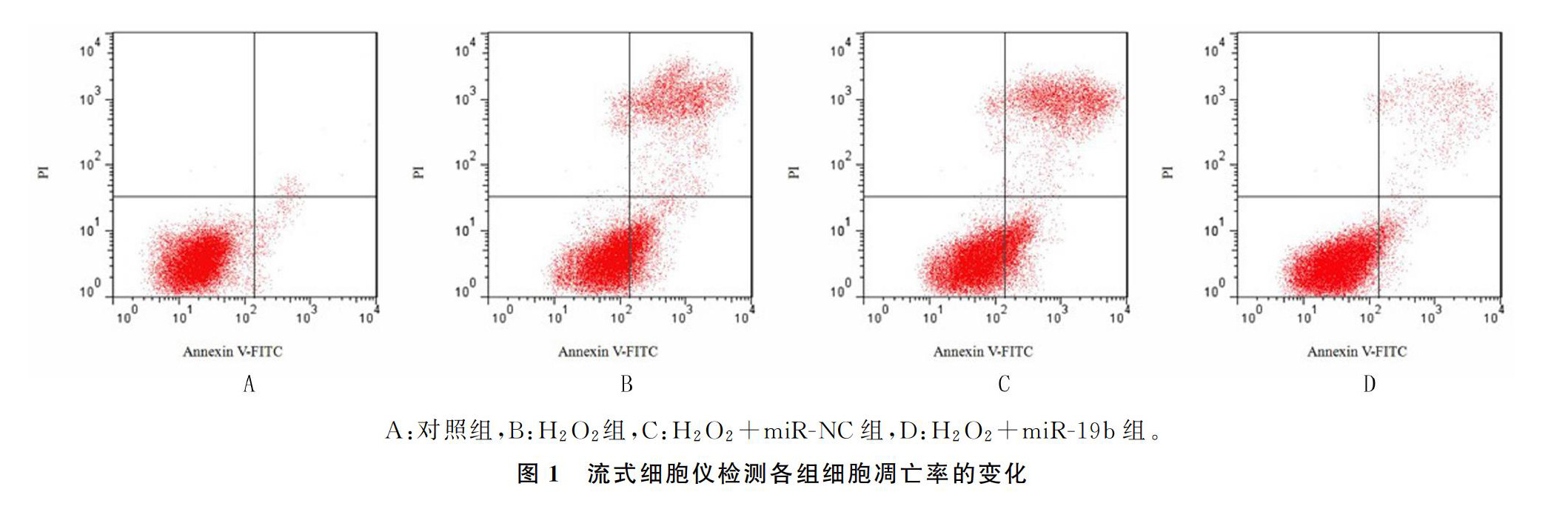
1.2.4流式细胞仪检测细胞凋亡率将细胞接种至6孔细胞板上,按照1.2.1进行分组处理。处理结束后,用胰蛋白酶消化收集各组细胞。以磷酸缓冲液洗涤细胞2次后,加入500 μL的 Binding Buffer悬浮细胞,再加入Annexin V-FITC溶液和PI溶液各5 μL,重复混匀后置于避光条件下反应15 min,流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.2.5MDA含量和LDH、SOD、GSH-Px活力检测将细胞接种至6孔细胞板上,按照1.2.1进行分组处理。处理结束后,收集各组细胞及上清液,分别参照LDH、SOD、MDA和GSH-Px试剂盒说明书步骤进行检测。实验重复3次。
1.2.6Western blot检测PI3K/AKT信号通路相关蛋白PI3K、AKT和p-AKT蛋白的表达将细胞接种至6孔细胞板上,按照1.2.1进行分组处理。处理结束后,收集各组细胞。加入细胞裂解液提取各组细胞总蛋白后,参照BCA蛋白浓度测定试剂盒说明书步骤检测总蛋白的浓度与纯度。将蛋白样品与等体积的Loading buffer充分混匀后,置于沸水浴中煮沸变性5 min。将蛋白样品以每孔80 μg上样至SDS-PAGE凝胶中进行电泳分离,分离结束后转至PVDF膜上。将膜置于含有50 g/L脱脂奶粉的封闭液中封闭1 h后,转入以1∶1 000比例稀释的一抗工作液中于室温下孵育2 h;封闭液洗膜后,然后转入以1∶2 000比例稀释的二抗工作液中室温孵育1.5 h。滴加化学发光剂暗室内显影曝光后,采用凝胶成像系统分别扫描分析各组细胞中PI3K、AKT和p-AKT等蛋白的表达水平。目的蛋白的相对表达量=目的蛋白灰度值/内参GAPDH灰度值。实验重复3次。
1.3统计学处理
采用SPSS 22.0软件进行统计学分析,计量数据以±s形式表示,多组间比较使用单因素方差分析,组间多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2结果
2.1转染后SH-SY5Y细胞miR-19b表达变化
各组间miR-19b的表达水平差异有统计学意义(F=148.58,P<0.001)。多重比较结果显示:与对照组相比较,H2O2组SH-SY5Y细胞中miR-19b的表达水平明显降低(P<0.05);与H2O2组相比,H2O2+miR-19b组细胞中miR-19b的表达水平明显升高(P<0.05)。见表2。
2.2上调miR-19b表达对SH-SY5Y细胞存活率和凋亡率的影响
各组间细胞存活率、凋亡率差异有统计学意义(F=185.84、60.69,P均<0.001)。多重比较结果显示:与对照组相比较,H2O2组细胞存活率明显降低(P<0.05),而凋亡率明显升高(P<0.05),差异均有统计学意义;与H2O2组相比较, H2O2+miR-19b组细胞存活率明显升高(P<0.05),而细胞凋亡率明显降低(P<0.05),差异均有统计学意义。见表2、图1。
2.3上调miR-19b表达对SH-SY5Y细胞MDA含量和SOD、GSH-Px、LDH活力影响
各組间MDA、SOD、GSH-Px和LDH差异有统计学意义(F=128.069~288.945,P均<0.05)。多重比较结果显示:与对照组相比,H2O2组细胞上清液中LDH活力和细胞内MDA含量均升高(P<0.05),而细胞内SOD和GSH-Px活力降低(P<0.05);与H2O2组相比,H2O2+miR-19b组中LDH活力和MDA含量均降低(P<0.05),而SOD和GSH-Px活力升高(P<0.05)。上述各指标差异均有统计学意义。见表3。
2.4上调miR-19b表达对SH-SY5Y细胞PI3K/AKT信号通路相关蛋白表达的影响
各组间PI3K、p-AKT和AKT差别有统计学意义(F=2.349~204.192,P均<0.05)。多重比较结果显示:与对照组相比较,H2O2组细胞中PI3K和p-AKT蛋白的表达水平均明显降低(P<0.05);与H2O2组相比,H2O2+miR-19b组细胞中PI3K和p-AKT蛋白的表达水平均明显升高(P<0.05)。见图2、表4。
3讨论
H2O2可产生活性氧,增强细胞膜的通透性,促进细胞色素C释放,进而激活Caspase级联反应,诱导细胞发生凋亡[11-13]。LDH是一种反映细胞损伤的糖酵解酶,其释放量越高,细胞损伤程度越重[14]。SOD是体内重要的氧自由基天然清除剂,可减轻自由基对机体组织造成的损伤[15]。GSH-Px也是一种重要的抗氧化酶,且与SOD具有协同作用[16]。MDA是脂质氧化终产物之一,其含量高低可间接反映自由基对机体的损伤程度[17]。本文的研究结果显示,200 μmol/L的H2O2处理降低了神经细胞SH-SY5Y的存活率,提高了细胞凋亡率及细胞上清液中LDH活力和细胞内MDA的含量,而降低了细胞内SOD和GSH-Px的活力,表明H2O2诱导了SH-SY5Y神经细胞损伤。
miRNA在真核生物中广泛存在,参与神经退行性疾病的发生发展。作为一种miRNA,miR-19b参与多种疾病的发生发展进程。研究显示,miR-19b在失血性休克病人中升高,下调miR-19b可减轻低氧/复氧诱导的人肺微血管内皮细胞功能障碍,降低肺损伤[18]。上调miR-19b和miR-21可通过靶向下调PTEN的表达来抑制神经元细胞凋亡,减轻脊髓损伤[19]。而减少miR-19b的表达可以改善艾塞那肽对非肥胖糖尿病的治疗作用,有效控制血糖并改善炎症反应和免疫功能,并减少胰岛细胞损伤[20]。miR-19b在小鼠哮喘模型中低表达,上调其表达可通过升高SOD活力和降低MDA含量减轻氧化应激引起的肺组织损伤[7]。本研究以H2O2处理SH-SY5Y神经细胞结果显示,细胞中miR-19b表达水平明显降低,提示miR-19b可能在H2O2诱导的SH-SY5Y细胞损伤过程中发挥着重要的作用。通过转染miR-19b模拟物成功上调miR-19b表达,而且上调miR-19b表达提高了H2O2作用下的SH-SY5Y细胞存活率,并降低了细胞凋亡率及细胞上清中LDH活力和细胞中MDA含量,且提高了SOD和GSH-Px的活力。提示上调miR-19b表达可抑制H2O2诱导的SH-SY5Y细胞凋亡及氧化应激水平,减轻了H2O2诱导的SH-SY5Y细胞损伤。这与WEI等[21]报道的miR-19b可减轻MPP+诱导的SH-SY5Y细胞损伤的结果一致。
PI3K/AKT信号通路是细胞内信号转导的重要通路之一,AKT在PI3K信号传导过程中发挥着枢纽作用,其磷酸化被激活后可通过调控多种基因的表达在细胞代谢、增殖和凋亡等方面发挥着重要作用,与包括阿尔茨海默病在内的多种疾病的发生发展密切相关[22-23]。已有研究结果显示,在H2O2诱导的SH-SY5Y细胞损伤过程中PI3K/AKT信号通路受到抑制[24];miR-19b可能通过下调PTEN表达激活AKT信号通路[25]。为了探讨miR-19b在保护H2O2诱导的SH-SY5Y细胞损伤中的分子机制,本研究进一步的检测结果显示,上调miR-19b表达可以逆转H2O2对SH-SY5Y细胞中PI3K和p-AKT蛋白表达的抑制作用,提示miR-19b可能通过激活PI3K/AKT信号通路减轻H2O2诱导的SH-SY5Y细胞损伤。
综上所述,miR-19b在H2O2诱导的神经细胞损伤方面发挥着积极的作用,其机制可能与激活PI3K/AKT信号通路有关。本文结果进一步揭示了miR-19b在神经细胞损伤中的作用,为其作为改善H2O2诱导的神经细胞损伤的有效靶点提供了新的参考依据。但本研究仅在细胞层面初步探究了miR-19b对神经细胞损伤的保护作用及可能机制,接下来将进一步通过动物实验验证miR-19b对神经细胞损伤的保护作用及其他调控通路。
[参考文献]
[1]韩云峰,田三春,杨宏艳,等. 五味子酚对H2O2诱导SH-SY5Y细胞氧化损伤的保护作用[J]. 中国药学杂志, 2018,53(4):273-277.
[2]荣家闵,于明,葛雅琨,等. 水飞蓟宾对H2O2诱导SH-SY5Y细胞损伤的保护作用及机制[J]. 南京医科大学学报(自然科学版), 2020,40(4):515-520.
[3]CAI M B, HU Z H, HAN L P, et al. MicroRNA-572/hMOF/Sirt6 regulates the progression of ovarian cancer[J].? Cell Cycle, 2020,19(19):2509-2518.
[4]ZHOU J L, LI L W, HU H, et al. Circ-HIPK2 accelerates cell apoptosis and autophagy in myocardial oxidative injury by sponging miR-485-5p and targeting ATG101[J].? Journal of Cardiovascular Pharmacology, 2020,76(4):427-436.
[5]BALA S S, CALENDA C D, CATALANO D, et al. Deficiency of miR-208a exacerbates CCl 4-induced acute liver injury in mice by activating cell death pathways[J].? Hepatology Communications, 2020,4(10):1487-1501.
[6]XU J H, TANG Y, BEI Y H, et al. miR-19b attenuates H2O2-induced apoptosis in rat H9C2 cardiomyocytes via targeting PTEN[J].? Oncotarget, 2016,7(10):10870-10878.
[7]YE L, MOU Y, WANG J, et al. Effects of microRNA-19b on airway remodeling, airway inflammation and degree of oxidative stress by targeting TSLP through the Stat3 signaling pathway in a mouse model of asthma[J].? Oncotarget, 2017,8(29):47533-47546.
[8]李嫻,何钊,丁伟峰,等. 美洲大蠊油脂对过氧化氢诱导SH-SY5Y细胞氧化损伤的保护作用[J].? 环境昆虫学报, 2018,40(1):36-42.
[9]MOHD-ZAHID M H, JALIL J, CHAN K M, et al. Neuroprotective effects of Ocimum basilicum extract against hydrogen peroxide-induced oxidative stress in SK-N-SH neuroblastoma cells[J].? Sains Malaysiana, 2018,47(9):2129-2139.
[10]徐静,吴玉泉,许娟,等. 阿尔茨海默病患者血清miR-19b-3p表达与认知功能的关系[J].? 中华行为医学与脑科学杂志, 2017,26(11):994-998.
[11]孙贤辉,梁华兵,周爽,等. 姜黄素减轻过氧化氢诱导皮层神经细胞凋亡的JAK信号通路机制研究[J].? 临床和实验医学杂志, 2018,17(14):1489-1493.
[12]豆立冬,曾思,盛琼,等. 亚甲蓝对过氧化氢诱导小鼠巨噬细胞线粒体途径凋亡的影响[J]. 中华麻醉学杂志, 2018,38(6):723-727.
[13]段卡丹,张守彦,李松森. miR-92a对H2O2诱导的H9C2心肌细胞凋亡以及MAPK-ERK通路的影响[J].? 中国循证心血管医学杂志, 2020,12(3):312-316.
[14]GENG S M, HAO X Y, XU H C, et al. Cardiac injury after acute carbon monoxide poisoning and its clinical treatment scheme[J].? Experimental and Therapeutic Medicine, 2020,20(2):1098-1104.
[15]NIU S Q, XU L, YUAN Y Q, et al. Effect of down-regulated miR-15b-5p expression on arrhythmia and myocardial apoptosis after myocardial ischemia reperfusion injury in mice[J].? Biochemical and Biophysical Research Communications, 2020,530(1):54-59.
[16]YANG G, ZHAO Y. Overexpression of miR-146b-5p ameliorates neonatal hypoxic ischemic encephalopathy by inhibiting IRAK1/TRAF6/TAK1/NF-αB signaling[J].? Yonsei Medical Journal, 2020,61(8):660-669.
[17]LI M Y, LIU P P, XUE Y C, et al. Tannic acid attenuates hepatic oxidative stress, apoptosis and inflammation by activating the Keap1-Nrf2/ARE signaling pathway in arsenic trioxide-toxicated rats[J].? Oncology Reports, 2020,44(5):2306-2316.
[18]WU F, WANG J Y, CHAO W, et al. miR-19b targets pulmonary endothelial syndecan-1 following hemorrhagic shock[J].? Scientific Reports, 2020,10(1):15811.
[19]WANG Z, SONG Y X, HAN X W, et al. Long noncoding RNA PTENP1 affects the recovery of spinal cord injury by regulating the expression of miR-19b and miR-21[J].? Journal of Cellular Physiology, 2020,235(4):3634-3645.
[20]HE J S, KANG Y Y, LIAN C W, et al. Effect of miR-19b on the protective effect of Exendin-4 on islet cells in non-obese diabetic mice[J].? Experimental and Therapeutic Medicine, 2019,18(1):503-508.
[21]LIU W, GENG L J, CHEN Y. MiR-19b alleviates MPP+-induced neuronal cytotoxicityviatargeting the HAPLN4/MAPK pathway in SH-SY5Y cells[J].? RSC Advances, 2018,8(19):10706-10714.
[22]SUN Z Q, SUN L, TU L X. GABAB receptor-mediated PI3K/Akt signaling pathway alleviates oxidative stress and neuronal cell injury in a rat model of Alzheimers disease[J].? Journal of Alzheimers Disease, 2020,76(4):1513-1526.
[23]ZHANG X L, LIU Z. MiR-19a inhibitor improves diabetic re-tinopathy in rats through PTEN/Akt/P-Akt signaling pathway[J].? Journal of Biological Regulators and Homeostatic Agents, 2020,34(2):509-515.
[24]WANG J, LIU H D, ZHANG X, et al. Sulfated hetero-polysaccharides protect SH-SY5Y cells from H2O2-induced apoptosis by affecting the PI3K/Akt signaling pathway[J].? Marine Drugs, 2017,15(4):110.
[25]朱宏文,喻溥蛟,許嘉鸿. miR-19b通过激活Akt信号通路保护心肌细胞凋亡[J].? 上海大学学报(自然科学版), 2019,25(1):10-17.
(本文编辑 于国艺)
- 我国上市公司会计政策选择研究
- 试论新会计准则中公允价值计量
- 试论会计信息化建设的有效途径
- 强化企业应收账款管理的现实性思考
- 我国经济型酒店利用微信公众号进行微信营销的研究
- 区域旅游市场营销规划模式研究
- 联合利华的跨文化营销策略探析
- 浅析苹果手机的营销策略
- 加多宝在营销方式选择上的利弊分析
- 体验经济视角下品牌展会营销策略探究
- 众筹营销发展的主要障碍分析
- 现代管理视域下韩非子制度化管理的智慧
- 我国企业内部控制中存在问题及对策研究
- 统计的高效性对企业管理重要性探析
- 深度剖析传统企业下转型的二手市场
- 上市公司盈利能力的局限性及完善
- 浅析数学统计在企业管理中的运用
- 浅谈现代企业经济管理模式的规范化
- 浅谈如何提升港口企业文化
- 浅谈加强企业经济管理有效性的策略
- 企业预算编制中存在的问题以及对策分析
- 企业管理与数学统计关系之辨析
- 企业管理活动中的数学定量化职能分析
- 论建立现代企业管理统计系统
- 降低企业物资采购成本的措施分析
- be under attack/fire
- be under consideration
- be under control
- be under discussion
- be under investigation
- be under no obligation to do sth
- be under pressure
- be under sb's control
- be under sb's spell
- be under sb's/the thumb
- be understaffed
- be under stress/be under a strain
- be under stress/be under (a) strain
- be under stress/be under strain
- be under suspicion
- be under the impression
- be under the impression (that)
- be under the impression that...
- be under the impression that
- be under threat
- availers
- availing
- availingly
- availment
- avail-oneself-of
- 慎重选拔
- 慎重,小心
- 慎防杜渐
- 慎静
- 慎默
- 慑
- 慑伏
- 慑其军威而败逃
- 慑北
- 慑屈
- 慑怖
- 慑怯
- 慑息
- 慑惮
- 慑慑
- 慑慴
- 慑服
- 慑栗
- 慑气
- 慑气屏息
- 慑畏
- 慑耸
- 慑锉
- 慑骇
- 慓