凌霄雁 林栩 郑心彤 古贤君 梁钊 覃卿 杜秀日
【摘要】目的?探討瞬时转染miR-155mimics和miR-155 inihibitor化学合成物在足细胞中表达变化及其稳定情况。方法?体外培养小鼠肾小球足细胞,用脂质体法将miR-155mimics/NC、miR-155 inihibitor/NC、Cy3 miR-155 mimics/inhibitor NC转染足细胞,构建足细胞内miR-155高表达模型、低表达模型、荧光基团。然后用免疫荧光显微镜观察不同剂量LipofectamineTM 2000转染不同浓度Cy3 miR-155 NC后的荧光转染效果。用实时荧光定量PCR 技术检测足细胞中miR-155mimics浓度梯度(50、80、100 nmol/mL)、miR-155 inihibitor浓度梯度(80、100、150 nmol/mL)的miRNA-155表达。结果?达到一定剂量的LipofectamineTM 2000足以饱和不同浓度的miRNA,并将不同浓度Cy3 miR-155 NC成功转入足细胞内,且转染效率达80%以上。qRT-PCR结果显示转染miR-155mimics、miR-155 inihibitor 24 h后,miR-155在足细胞中的表达明显改变,与阴性对照组(NC)比较差异有统计学意义,表明转染成功。转染80 nmol/mL浓度的miR-155mimics,miR-155在足细胞中的表达明显上调 (P<0.001),与其他浓度对比表达量升高,差异有统计学意义。转染150 nmol/mL浓度的miR-155 inihibitor,miR-155在足细胞中的表达明显下调(P<0.001),与其他浓度对比表达量降低,差异有统计学意义。结论?LipofectamineTM 2000达到适当剂量时将各工作浓度的miRNA-155转入足细胞内的转染效果高。80 nmol/mL的miR-155mimics和150 nmol/mL的miR-155 inhibitor可能较适合用于实验研究。
【关键词】足细胞;miR-155 mimics;miR-155 inihibitor;LipofectamineTM 2000
中图分类号:R329.2+6?文献标志码:A?DOI:10.3969/j.issn.1003-1383.2019.12.002
【Abstract】Objective?To investigate the expression and stability of transiently transfected miR-155mimics and miR-155 inhibitor chemical compounds into podocytes.Methods?Mouse glomerular podocytes were cultured in vitro,and miR-155 mimics/NC,miR-155 inhibitor/NC,Cy3 miR-155 mimic/inhibitor NC were transfected into podocytes by liposome method to construct miR-155 high expression model or low expression model and fluorophore in podocytes.The transfection effect of different doses of LipofectamineTM 2000 transfecting different concentrations of Cy3 miR-155 NC was observed by immunofluorescence microscopy.miRNA-155 expression transfected with miR-155 mimics at concentration gradient (50,80,100 nmol/mL) or miR-155 inhibitor at concentration gradient (80,100,150 nmol/mL) in podocytes was detected by qRT-PCR.Results?A fixed dose of LipofectamineTM 2000 was sufficient to saturate different concentrations of miRNA,and different concentrations of Cy3 miR-155 NC were successfully transferred into podocytes,and the transfection efficiency was over 80%.qRT-PCR results showed that the expression of miR-155 in podocytes was significantly changed after transfection of miR-155 mimics or miR-155 inhibitor for 24 h,and the difference was statistically significant compared with the negative control group(NC),indicating a successful transfection.When transfected with miR-155mimics at a concentration of 80 nmol/mL,the expression of miR-155 in podocytes was significantly up-regulated compared with other concentrations(P<0.001).And when transfected with miR-155 inhibitor at 150 nmol/mL,miR-155 expression in podocytes was significantly down-regulated?compared with other concentrations(P<0.001).Conclusion?With appropriate dose of LipofectamineTM 2000,the transfection efficiency of working concentration of miRNA-155 into podocytes is high.Concentrations of 80 nmol/mL miR-155 mimics and 150 nmol/mL miR-155 inhibitor may be suitable for experimental studies.
【Key words】podocyte;miRNA-155 mimics;miRNA-155 inihibitor;LipofectamineTM 2000
微小RNA(miRNA)是一种内源性小分子非编码RNA,在生物生长发育,细胞增殖、分化、凋亡及疾病发生中发挥至关重要的作用。其作用机理是与靶基因完全或部分互补结合,从而在转录后对靶基因水平实行负性调节。miRNA在不同肾脏疾病如肾病综合征、糖尿病肾病、IgA肾病、狼疮性肾炎、多囊性肾病和移植排斥反应等具有特异性的表达谱[1]。足细胞即肾小球脏层上皮细胞,是一种高度特异、终末分化、位于基底膜最外层的上皮细胞,与基底膜、肾小球内皮细胞共同构成肾小球滤过屏障。足细胞的结构和功能与微小病变肾病、局灶节段性肾小球硬化(FGSG)、膜性肾病、糖尿病肾病、系统性红斑狼疮性肾炎等肾小球疾病的发生发展机理密切相关[2]。我们之前用转化生长因子β1(TGF-β1)诱导足细胞损伤模拟肾病模型,发现miRNA-155表达上升[3],但miRNA-155是否在足细胞损伤中起着调节作用尚不清楚,因此,本实验旨在通过瞬时转染不同浓度miR-155mimics和miR-155 inihibitor化学合成物,目的是筛选出适合今后实验的化学合成物浓度,实现稳定的足细胞miRNA-155高表达和低表达,以期为进一步深入研究miRNA-155在足细胞损伤的作用奠定基础。
1?材料与方法
1.1?材料
肾小球足细胞株(MPC5)购于上海复旦大学细胞中心,RPMI1640培养基(美国Gibco)、胎牛血清(以色列BI-04-002-1A),LipofectamineTM 2000(invitrogen),miR-155mimics/mimics NC、miR-155 inihibitor/inhibitor NC、Cy3 miR-155 mimic/inhibitor NC均购买于广州锐博公司,RNAiso Plus RNA 提取试剂盒(日本TaKaRa 9108),Mir-X miRNA FirstStrand Synthesis Kit(美国clontech 638315),SYBR Premix Ex TaqTM Ⅱ(日本TaKaRa,RR820A),miRNA-155 Forward primer由生工生物工程(上海)股份有限公司合成,引物序列见表1(miRNA mRQ 3primer由TaKaRa公司提供,为其专利,不提供具体碱基序列)。
1.2?足细胞培养
培养方法参考本课题组的前期研究,稍作修改[4]。细胞复苏后,每2~3 d换液1次,细胞融合至80%左右消化传代,在含10%胎牛血清的RPMI1640 培养液,37℃、5% CO2培养箱中培养。14 d左右分化成熟后用于后续实验。
1.3?实验分组
细胞传代后,以0.4×105~1×105个对数生长期细胞种于24孔板或6孔板中,待各组细胞融合至50%~70%后用含1%胎牛血清的RPMI1640培养液同步化24 h。参照说明书化学合成miRNA工作浓度范围10~200 nmol/mL,将Cy3 miR-155 mimic/inhibitor NC分五组浓度梯度(50、80、100、120、150 nmol/mL)、miR-155mimics/mimics NC分三组浓度梯度(50、80、100 nmol/mL)、miR-155 inihibitor/inhibitor NC分三组浓度梯度(80、100、150 nmol/mL)。同时根据转染试剂LipofectamineTM 2000的用量分组,miRNA∶LipofectamineTM 2000用量比值为1∶0.01~1∶0.1(pmol∶μL)。或Cy3 miR-155 NC、miR-155mimics/mimics NC、miR-155 inihibitor/inhibitor NC为以上浓度不变,而LipofectamineTM 2000在24孔板用量为1.5 μL,6孔板用量为7.5 μL,具体分组详见表2。
1.4?细胞转染
分別将Cy3 miR-155 NC、miR-155 mimics/mimicsNC、miR-155inihibitor/inhibitor NC、脂质体LipofectamineTM 2000加入相应剂量的OPTI-MEM培养基中静置5 min,然后与LipofectamineTM 2000一一对应混匀,室温静置20 min后分别加入24孔板或6孔板中,孵育4~6 h后改用含10% FBS的RPMI-1640培养基,37℃、5% CO2培养箱中继续培养至24 h。
1.5?miRNA-155荧光转染效率的测定
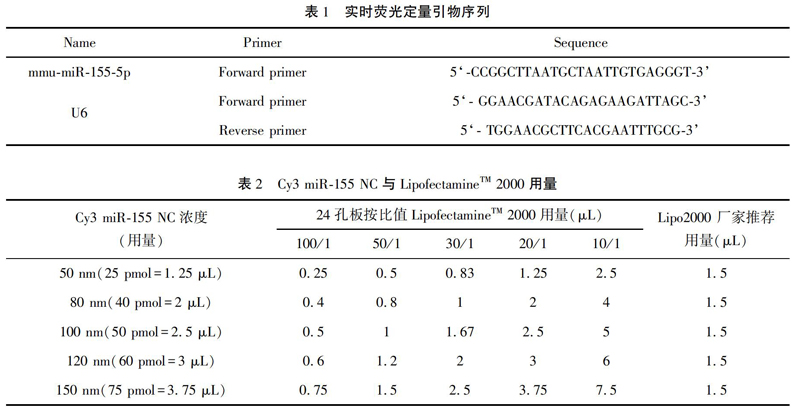
24小时后通过免疫荧光倒置显微镜观察计数表达红色荧光的细胞,扫描采集图像。随机取3个高倍镜视野,计算每个视野下表达红色荧光的细胞数占总细胞数的百分比(转染细胞率=荧光表达细胞数/总细胞数×100%),取其平均值作为转染效率。
1.6?Real-time RT-PCR检测miRNA-155表达
按照RNAiso Plus说明书提取各实验组小鼠足细胞的总RNA。经紫外分光光度计测定OD260、OD280及RNA 浓度,琼脂糖凝胶电泳检测RNA完整性。取1 μg总RNA反转录合成cDNA,具体操作按照试剂盒说明书进行。使用LightCycler96实时荧光定量PCR仪进行检测。选取U6作为miRNA的内参,检测miR-155、U6的mRNA表达。以2-△△CT法计算相对表达量,ΔΔCT=(CT实验组目的-CT实验组内参)-(CT对照组目的-CT对照组内参)。
1.7?统计学方法
采用SPSS 20.0 进行统计分析,符合正态分布的资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(Oneway ANOVA),两两比较用LSD-t 检验。检验水准:α=0.05,双侧检验。
2?结?果
2.1?足细胞转染情况
在24孔板中将1.5 μL LipofectamineTM 2000和Cy3 miRNA-155 mimic/inhibitor NC或按照1∶0.01~1∶0.1(pmol∶μL)比值(表2)转入足细胞中,24 h后在荧光倒置显微镜下检测其转染的荧光图,发现转染比值为20/1时,即Cy3用量与LipofectamineTM 2000一致时,足细胞的胞质中出现了明显的荧光(图1B,D),其他比值LipofectamineTM 2000用量大于等于1.5 μL时,足细胞也出现了较明显的荧光(图1F,H,J),并且荧光效率都能达到80%以上。而LipofectamineTM 2000用量小于1.5 μL时,足细胞只见散在的荧光点,胞质中没有出现明显的荧光(图2B,D),未转染的足细胞是没有荧光的。在6孔板中将7.5 μL LipofectamineTM 2000与Cy3 miRNA-155mimic/inhibitor NC转入足细胞中,24 h后在荧光倒置显微镜下检测其转染的荧光,如图3所示:转染Cy3 miRNA-155 NC后的足细胞的胞质中出现了明显的荧光(图3B,D),并且荧光效率都能达到80%以上。而未转染的足细胞是没有荧光的。
2.2?miR-155mimics转染足细胞后引起miR-155水平升高
将不同浓度miR-155mimics和miR-mimics NC分别转入足细胞中,24 h后收集细胞,提取RNA,用实时荧光定量PCR检测各组细胞内miR-155的表达。如图4所示:与miR-mimics NC相比,miR-155mimics转染后miR-155水平显著上调(P<0.001),且转染浓度为80 nM的miR-155 mimics上调最为明显,差异有统计学意义(P<0.001)。
2.3?miR-155 inhibitor转染足细胞后引起miR-155水平降低
将不同浓度miR-155 inhibitor和miR-inhibitor NC分别转入足细胞中,24 h后收集细胞,提取RNA,用实时荧光定量PCR检测各组细胞内miR-155的表达。如图5所示:与miR-inhibitor NC相比,miR-155 inhibitor转染后miR-155水平显著下调(P<0.001),且转染浓度为150 nM的miR-inhibitor,细胞miR-155的RNA下降水平低于浓度为80 nM和100 nM的miR-inhibitor,差异有统计学意义(P<0.001,P=0.001)。
3?讨?论
微小RNA(miRNA)几乎参与所有细胞功能的调控,肾脏发育过程中需要miRNA的活性调节,作为调节肾脏的病理生理基因表达的小分子非编码RNA,在肾脏健康和疾病中起着关键作用[5]。近年来miRNA在足细胞中的表达和功能分析取得了进展,甚至可能成为疾病生物标志物和治疗的重要靶点。在膜性肾病(MN)中,检测到七种足细胞特异性miRNA,例如特异性肾连蛋白(nephronectin,NPNT)的miR-378a,Müller-Deile等人[6]发现 miR-378a-3p可抑制基底膜中足细胞衍生的细胞外基质蛋白NPNT的表达水平,引起足细胞损伤。Ramezani等人[7]提取FGSG患者尿液的外泌体miRNA,检测发现miR-155水平上调。Beltrami等[8]在糖尿病肾病患者尿液中也发现miR-155水平表达明显增加,认为其可成为生物标志物。在狼疮性肾炎患者的血浆中,Zununi等[9]发现 miR-155水平显著增加,可能提示炎症反应活动期,且与炎症介导的肾小球内皮损伤和纤维化相关。
足细胞是肾小球滤过屏障不可缺少的重要部分,它的损伤涉及人类许多肾脏疾病,因此miR-155成为肾小球疾病的生物标志物前景是可预见的。我们课题组前期研究结果已经表明miRNA-155在足细胞损伤中的表达变化[3],然而miR-155在足细胞中的功能如何,其参与足细胞损伤的具体机制不详,这是我们今后所研究的方向。
micrONTM miRNA mimic是一种化学合成的miRNA 模拟物,模拟细胞中成熟miRNA 的高水平表达,使内源miRNA的调控作用增强。micrOFFTM miRNA inhibitor也是化学合成经特殊修饰的miRNA抑制剂,通过特异性结合成熟miRNA分子而抑制细胞中miRNA对靶基因的调控作用。作为专门用于miRNA功能研究的化学合成物,它们更容易控制转染工作浓度,操作方便快捷,高效能且可以缩短实验周期,因此miRNA mimic和 miRNA inhibitor是瞬时转染较为理想的选择,国内外应用都很广泛。然而在国内外文献中发现,许多不同miRNA,甚至同个miRNA,miRNA mimic和 miRNA inhibitor用于实验的工作浓度并不一致,文献也并没有阐明选择的理由。miRNA mimic和 miRNA inhibitor在不同的生产来源有一定的差异,在不同的细胞中表达功能也不完全一致,转染试剂和方法也有所不同。
在动脉粥样硬化泡沫细胞[10]中使用转染试剂Lipofectamine?LTX & Plus转染100 nmol/mL miR-155mimic或miR-155 inhibitor,并在不同時间梯度检测miR-155的有效表达量。在心肌细胞中,有文献选择miR-155 mimic工作浓度为50 nmol/mL,使用X-treme GENE siRNA转染试剂进行瞬时转染[11]。在我们的实验中,首先使用转染成功指示剂Cy3 miR-155 NC对化学合成物miRNA在足细胞中的转染效果进行初步观察。根据说明书miRNA mimic起始工作浓度为50 nmol/mL,miRNA inhibitor为100 nmol/mL,并参考文献,将Cy3 miR-155 NC分为不同浓度梯度,同时根据miRNA公司推荐转染试剂LipofectamineTM 2000的用量进行分组,miRNA∶LipofectamineTM 2000用量比值为1∶0.01~1∶0.1(pmol∶μL),或根据LipofectamineTM 2000公司推荐,24孔板用量为1.5 μL和6孔板用量为7.5 μL进行分组。在24孔板中转染24 h后,免疫荧光显微镜观察表明转染时LipofectamineTM 2000要达到一定适当的量,才能饱和不同浓度的miRNA,将Cy3 miRNA-155 NC成功转入足细胞内。6孔板中转染实验再次验证LipofectamineTM 2000只有达到适当的剂量才足以将各工作浓度的miRNA-155成功转入足细胞内,并且荧光效率能达到80%以上。接着我们按照以上试剂用量及实验方法,用qRT-PCR检测miR-155的表达量变化情况,结果显示转染不同浓度miR-155 mimic,miR-155在足细胞中表达均上调显著,转染不同浓度miR-155 inhibitor后,miR-155表达也均明显下调。研究结果表明miR-155mimi和miR-155 inhibitor在足细胞中转染成功,并且浓度80 nmol/mL miR-155mimic的miR-155表达上调比其他两个浓度高,浓度150 nmol/mL miR-155 inhibitor 的miR-155表达下调比其他两个浓度低,这两个工作浓度可能较适合用于我们的实验研究。
有研究者使用LipofectamineTM 2000转染30 nmol/mL和50 nmol/mL两个浓度的miR-30 inhibitor入足细胞[12],结果显示浓度50 nmol/mL即对靶基因有明显作用。在本实验中,我们选择化学合成物,对其进行浓度、剂量摸索,为后期的实验做好准备,后期我们将对转染时间和对靶蛋白的作用予进一步的研究。
参?考?文?献
[1]Zhao H,Ma SX,Shang YQ,et al.microRNAs in chronic kidney disease[J].Clin Chim Acta,2019,491:59-65.
[2]Asanuma K.The role of podocyte injury in chronic kidney disease[J].Nihon Rinsho Meneki Gakkai Kaishi,2015,38(1): 26-36.
[3]郑心彤,凌霄雁,古贤君,等.miR-155在TGF-β1诱导足细胞损伤中的表达及其与synaptopodin、CD2 AP表达的相关性[J].中国免疫学杂志,2019,35(7):786-791.
[4]黄海庭,林栩,尤燕舞,等.瞬时受体电位阳离子通道蛋白6高表达对转化生长因子-β1诱导体外培养小鼠肾足细胞损伤的作用[J].右江医学,2016,44(4):374-380.
[5]Trionfini P,Benigni A.MicroRNAs as Master Regulators of Glomerular Function in Health and Disease[J].J Am Soc Nephrol,2017,28(6):1686-1696.
[6]Müller-Deile J,Dannenberg J,Schroder P,et al.Podocytes regulate the glomerular basement membrane protein nephronectin by means of miR-378a-3p in glomerular diseases[J].Kidney Int,2017,92(4):836-849.
[7]Ramezani A,Devaney JM,Cohen S,et al.Circulating and urinary microRNA profile in focal segmental glomerulosclerosis:a pilot study[J].European Journal of Clinical Investigation,2015,45(4):394-404.
[8]Beltrami C,Simpson K,Jesky M,et al.Association of Elevated Urinary miR-126,miR-155,and miR-29b with Diabetic Kidney Disease[J].Am J Pathol,2018,188(9):1982-1992.
[9]Zununi VS,Nakhjavani M,Etemadi J,et al.Altered levels of immune-regulatory microRNAs in plasma samples of patients with?lupus nephritis[J].Bioimpacts,2018,8(3):177-183.
[10]Li X,Kong D,Chen H,et al.miR-155 acts as an anti-inflammatory factor in atherosclerosis-associated foam cell formation by repressing calcium-regulated heat stable protein 1[J].Sci Rep,2016,6:21789.
[11]Guo J,Liu HB,Sun C,et al.MicroRNA-155 Promotes Myocardial Infarction-Induced Apoptosis by Targeting RNA-Binding Protein QKI[J].Oxid Med Cell Longev,2019,5:4579806.
[12]Rui P,Li Z,Yuru Z,et al.MiR-30a Inhibits the Epithelial—Mesenchymal Transition of Podocytes through Downregulation of NFATc3[J].International Journal of Molecular Sciences,2015,16(10):24032-24047.
(收稿日期:2019-10-11?修回日期:2019-11-14)
(編辑:王琳葵?梁明佩)
- 观老戏品究内涵探新意重现经典
- 试论戏曲元素对竹笛演奏的影响
- 谈话剧的广播叙述法
- 多功能组合木偶表演舞台的设计使用
- 谈戏剧舞台灯光色彩的运用
- 在戏曲中打击乐发挥的作用
- 浅谈现代戏曲舞台艺术
- 马王堆汉墓刺绣纹样在湘绣文创品中的应用
- 谈扬琴在戏曲乐队伴奏中的地位
- 刍议非遗视阈下传统手工艺人的传承困境及应对策略
- 京剧月琴的演奏艺术分析
- 唢呐演奏技术的传承与发展研究
- 乡情乡韵蕴锡剧美声美音进校园
- 京剧铜锤花脸的声腔风格流变
- 京剧花旦的艺术特色及表演技巧
- 京剧青衣表演艺术
- 当代瑶族民歌的传承与保护对策探讨
- 京剧青衣的表演方法与演唱技巧
- 汪曾祺小说中的自由意识与书写
- 浅析《简·爱》中女主人公的忠于自我精神
- 论朱自清散文《背影》的艺术美
- 珍惜现下拥有的
- 《傲慢与偏见》中的人物性格与婚姻观研究
- 何思瑶摄影作品选
- 陈竹意作品选
- possessivenesses
- possessives
- possessive²
- possessive¹
- possess-of
- possessor
- possessors
- possessorship
- possessorships
- possess-with
- possibilities
- possibility
- possible
- possibler
- possibles
- possiblest
- possibly
- post-
- post
- postabdomen
- postabdomens
- postabdominal
- post-abortal
- postabortion
- post-abortum
- 凤鵷
- 凤鷟
- 凤鸟
- 凤鸟不至
- 凤鸟乘于风,圣人因其时
- 凤鸟夜鸣
- 凤鸟随鸡
- 凤鸣
- 凤鸣岐山
- 凤鸣朝日
- 凤鸣朝阳
- 凤鸣足足
- 凤鸣鹤唳
- 凤鸾
- 凤鸾之瑞
- 凤鸾同巢
- 凤鸾箫
- 凤鹤
- 凤麟
- 凤麟并至
- 凤麟起舞
- 凥
- 凫
- 凫上水
- 凫乙