摘要:分析阐述了高中生在化学学习中需要形成的信息素养。以高考化学题中的典型图形信息题为例作了分类和解析;对每类题中的信息呈现方式与解析策略方法作了一般性的归纳和总结;指出应注重在识图、析图和用图的教学过程中不断提升学生的信息素养和分析解决问题的能力。
关键词:信息素养;图形信息题;解析策略与方法;中学化学教学
文章编号:1005–6629(2016)12–0080–05 中图分类号:G633.8 文献标识码:B
1 有关背景
1992年,澳大利亚梅耶委员会(Mayer Committee)指出:核心素养是个体高效率地参与工作与融入社会所不可或缺的基本素养。指向能以整合的方式将知识和技能应用于工作情境中,并提出了七大核心素养分支:收集、分析和整理信息的能力;交流思想和信息的能力;计划与组织活动的能力;与他人合作的能力;运用数学方法与数学技术的能力;解决问题的能力;使用技术手段的能力[1]。信息素养是现代公民全面素质的重要组成部分。高中教育的目的之一就是为高中生终生学习和发展奠定基础[2]。《高中化学新课程理念与实施》中提到“让学生在探索、发现、发展的主动学习的过程中體验科学探究的历程,通过学生实验、操作、调查、信息搜集与处理、表达与交流等,自主、独立地发现问题所在,培养搜集和处理信息的能力……”[3]。
当今社会已进入一个信息多元化的时代,每天我们会接触到如波涛汹涌般袭来的各种各样的海量信息,高中化学学习中同样要面对并处理形式各异的信息。《普通高中化学课程标准(实验)》在第二部分“课程目标”“二、过程与方法”中有如下陈述:3.在化学学习中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工[4]。这不仅指明了学生获取信息的具体途径及形成信息素养的方法,同时对高考中如何考查学生信息素养与能力(特别是获取及加工应用新信息)有了具体、细致、规范的要求。同时,在命制试题时,我们发现题目所呈现情境的形式各异,文字、图形、数据表格、曲线图、仪器构造示意图等形式丰富多彩,使得学生要调用自己的各种感官,学会进行信息转换,并将其准确地与自己所掌握的知识、具备的社会经验结合起来,凸显了科学能力的考查[5]。下面以近几年来一些高考题及其解答来分析阐述。
2 图形信息题分类及解析策略与方法
2.1 装置图类
2.1.1 电化学装置图
例1 [2015全国新课标I卷11]微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图1所示。下列有关微生物电池的说法错误的是( )
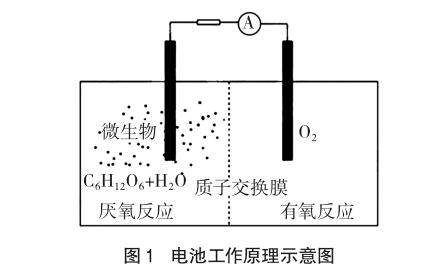
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
解析:首先根据装置图中的信息可知,厌氧反应在负极一侧,而有氧反应在正极一侧。再根据厌氧反应中碳元素的化合价的变化:葡萄糖(C6H12O6)中碳元素平均为0价,CO2中碳元素为+4价,所以生成CO2的反应为氧化反应,应在负极发生。故A错误。而由题干信息知:在微生物的作用下,该装置为原电池装置,原电池能加快反应速率,故可认为微生物促进了反应中电子的转移。故B正确。由于原电池中阳离子向正极移动,故C正确。电池总反应的实质是葡萄糖的氧化,故D正确。
信息呈现方式与解析策略方法:此类试题,一般会在题干和图中提供一些与电极反应或总反应相关的信息。解答时应重点关注两极反应物、产物、电子流向(电源正负极)、电极材料、隔膜类型(H+、OH-、气体等)、电解质类型(溶液或熔融物)、电解质溶液酸碱性等重要信息。通过整合相关信息并结合有关守恒原理,写出有关电极反应式或总反应式,据此再进行分析判断。
2.1.2 实验装置图
例2 [2014全国新课标I卷13]利用下图所示装置进行下列实验,能得出相应实验结论的是( )
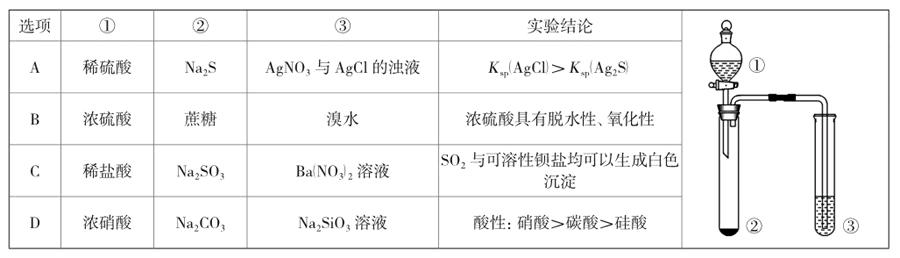
解析:由装置图的信息可知,左侧为分液漏斗与试管搭配的固+液反应装置,再将产生的气体通入右侧试管的溶液中,由试管中产生的现象得出实验结论。A中稀硫酸与Na2S反应产生H2S,它与AgNO3、AgCl均能反应而产生黑色Ag2S沉淀(黑色沉淀能将白色遮盖掉),故不能确定H2S与AgCl反应而产生了Ag2S,故得不出A中实验结论。B中浓硫酸可使蔗糖炭化而变黑,说明浓硫酸具有脱水性;浓硫酸再与生成的碳反应得到SO2,而SO2能使溴水褪色而显示其氧化性,故B正确。C中稀盐酸与Na2SO3反应产生SO2,但SO2通入Ba(NO3)2溶液中使溶液呈酸性,而硝酸能将+4价的硫氧化为+6价,进而生成了硫酸钡沉淀,但若将SO2通入BaCl2等溶液中,却因违背强酸制弱酸的原理而不能反应,当然不会生成白色沉淀。D中虽然浓硝酸与Na2CO3反应生成CO2气体,但由于浓硝酸具有挥发性,也随CO2一同进入Na2SiO3溶液中,由于硝酸酸性较强,硝酸优先与Na2SiO3反应,因而不能得出酸性碳酸>硅酸的结论。
信息呈现方式与解析策略方法:此类试题,一般在题干中提供一些与化学实验相关的信息(如装置图、反应物、生成物、实验现象等信息)。解答时应重点关注装置图的特点、反应的类型与反应原理等,分析并思考有关实验现象(或实验现象与结论的关系),据此再分析判断得出正确答案。
2.2 图像类
2.2.1 反映物质组成或成分变化的图像
例3 [2014全国新课标II卷27(4)] PbO2在加热过程中发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[(样品起始质量-a点固体质量)/样品起始质量×100%]的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。
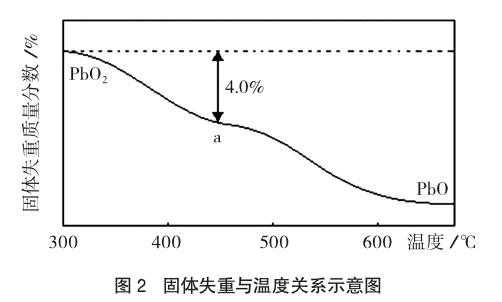
解析:由图示信息可知,该图反映了PbO2随温度的升高而发生分解时,固体失重质量分数(纵坐标)随温度(横坐标)变化的情况。到a点时,固体失重质量分数为4.0%,设有1mol PbO2(质量为239g)发生分解,则有(2-x)/2×32=239×4.0%,解得x=1.4;再根据mPbO2·nPbO,(2m+n)/(m+n)=1.4,可得m/n=2/3。
信息呈现方式与解析策略方法:此类试题一般在题中出现有关物质组成或成分变化的二维坐标系信息。解答时应根据图像的特点,找出反映物质组成或成分变化的相关规律或定量关系,分析计算出物质的组成、成分或写出有关反应式。
2.2.2 反映分子组成特點的图像
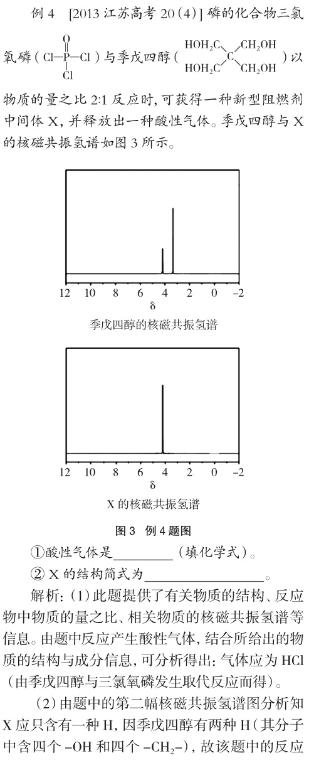

①ΔH3 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图所示的变化趋势,其原因是。
解析:①由题中文字信息“(NH4)2CO3捕获CO2”,知图知对应的反应为Ⅲ(在此,反应Ⅲ为有效信息,反应Ⅰ、Ⅱ为干扰信息)。由图4可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动,正反应为放热反应,则有ΔH3<0(这段分析,主要依据为图像信息)。
②在T1~T2区间,此时可逆反应尚未达到平衡,温度升高,化学反应速率加快,CO2的捕获量随温度的升高而提高。在T4~T5区间,此时可逆反应已达到平衡状态,由于该反应为放热反应,温度升高,平衡逆向移动,CO2的捕获量随温度的升高而降低。
参考答案:(2)①ΔH3<0。②在T1~T2区间,可逆反应尚未达到平衡,温度升高,化学反应速率加快,所以CO2被捕获的量随温度升高而提高。在T4~T5区间,可逆反应已达到平衡,由于正反应为放热反应,温度升高,平衡逆向移动,所以不利于CO2的捕获。
信息呈现方式与解析策略方法:此类试题一般在题中提供物质成分与某些外界条件间关系的信息。解答时应根据影响反应速率或化学平衡的各种因素,深入分析物质成分随外界条件发生变化的原因,按照题中的要求规范解答。
2.2.4 其他二维坐标系类图形
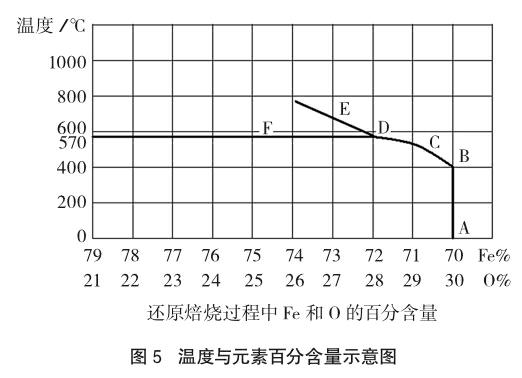
例6 [南京2015考前模拟题20-1(2)]用CO还原焙烧氧化铁时,温度的变化对还原焙烧产物影响很大。图5是不同温度下还原焙烧过程固体中Fe和O的百分含量变化示意图(其中A、B、D为纯净物,C、E、F为两种物质组成的混合物,F中有一种物质为Fe)。
根据图中信息可知,C点物质主要成分是:(填化学式);D→E过程发生的反应为: ;用CO还原焙烧氧化铁炼铁时,温度最好控制在570℃左右的原因是:。
解析:首先分析横、纵坐标代表的量及其关系,根据横坐标Fe或O的百分含量结合A、B、D为纯净物的提示信息,分析计算判断出A~B为Fe2O3,D为Fe3O4;C为Fe3O4和Fe2O3混合物,F为Fe3O4和Fe混合物;而E中除了Fe3O4外,另外一种物质含铁量要比Fe3O4高又不是Fe,分析得出它是FeO。所以,A→B过程Fe2O3没有被还原;B→D为Fe2O3被还原为Fe3O4的过程;D→E为Fe3O4被还原为FeO过程;D→F为Fe3O4被还原为Fe的过程。因此,用CO还原焙烧氧化铁炼铁时,温度最好控制在570℃左右的原因是:温度太低,氧化铁被还原为四氧化三铁,不能得到铁;温度太高,氧化铁被还原为氧化亚铁,且多消耗能源。
参考答案:Fe3O4和Fe2O3;Fe3O4+CO△= 3FeO+CO2;温度太低,氧化铁被还原为四氧化三铁,不能得到铁;温度太高,氧化铁被还原为氧化亚铁,且多消耗能源。
信息呈现方式与解析策略方法:二维坐标曲线图是数学方法中函数类图形的y-x曲线图。这类图形大多以时间、温度、元素百分含量、pH等量为横坐标,以物质的某种性质和特征等为纵坐标,以二维坐标系曲线来表示物质的变化。它能借助简单的线条走向,巧妙地表达物质结构、性质、现象与化学原理等方面的信息,考查学生对图形含义的理解、图形信息的收集与处理及曲线与文字的相互转化等方面的综合能力。
解答时步骤方法为:
(1)看图:一看纵横坐标含义;二看特殊点(起点、拐点、落点);三看变化趋势(规律);四看曲线之间的关系。
(2)分析:分析图像中隐含的信息,找出数据之间的关联点;同时根据问题类型,联系化学概念、化学原理等,将其加工成化学语言对问题进行分析。
(3)答题:针对题意运用图形特征解决相关问题。
2.3 溶解度表类
例7 [2011江苏高考19(2)]反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.15(相关物质的溶解度曲线见图6)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称) 、干燥。
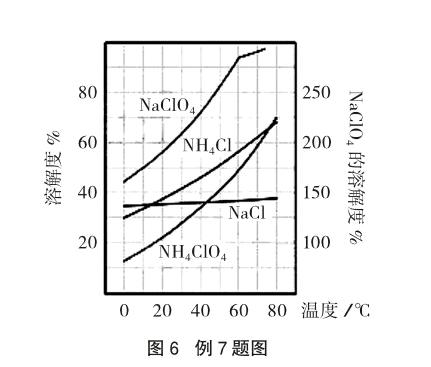
解析:首先观察溶解度曲线,发现纵坐标有左右两个,但问题中涉及的物质的溶解度均与左边纵坐标有关。由溶解度曲线可知,NH4ClO4属于溶解度变化“陡升型”类物质,而NaCl属于“缓升型”类物质,且混合溶液中NH4ClO4相对于NaCl含量较多(其实溶液中也含有少量NaClO4和NH4Cl)。故要得到较多NH4ClO4晶体,应先制成饱和溶液,再根据NH4ClO4的溶解度特点的信息,通过冷却使其析出(此时NaCl析出较少)。若不能达到产品的纯度要求,可再重复实验(重结晶),直到符合要求为止。参考答案为:蒸发浓缩,冷却结晶,过滤,冰水洗涤。
信息呈现方式与解析策略方法:此类试题,通常在题中提供物质(有时会有干扰物质)的溶解度变化曲线的信息,如上题中“缓升型”“陡升型”的信息,有时还会有一些特殊的情况,如Ca(OH)2为溶解度变化“下降型”物质,少数物质还会在某温度时达到溶解度最大值,要求分析判断获得(提纯)物质的方法。解答此类问题的方法是:从溶解度曲线中读出相关物质的溶解度随温度变化特点的信息(有时需排除无关物质的干扰),厘清不同溶解度变化类物质与分离提纯方法的关系,得到所需的物质。如上题中欲从混合溶液中获得较多NaCl晶体,可采取的操作为:加热蒸发、趁热过滤、(乙醇)洗涤。
3 结语
纵观近几年的各地高考化学试题,每年都有以图形方式呈现相关实验结果及各类信息的试题。要求学生在获取信息后对相关现象、事实作出合理解释,在分析推理基础上作出合理的判断或得出正确的结论。试题的新颖度、难度和区分度在一定程度上都借助于图形的创新得以体现。图形题将数据、圖线与化学问题融为一体,信息量大,信息加工涉及诸如信息的寻找、选择、整理、重组、应用等各方面。因此要在教学中指导学生了解图形所呈现的化学含义,掌握化学图形最基本的剖析方法,从中提炼出相关的信息,尝试应用图形分析解决化学问题,表述自己的思路与思维的结果。这样不仅可以提高自己的识图能力,更能通过这个过程训练与优化思维策略,加深对化学基础知识、基本理论的理解,更好地解决化学实际问题,不断提升信息素养和综合运用能力。
参考文献:
[1] Haworth David,Browne Geoff. Key Competencies[M]. The Educational Resources Information Center,1992:11~13.
[2]常珊珊,李家清.课程改革深化背景下的核心素养体系构建[J].课程·教材·教法,2015,(9):30~31.
[3]朱越,岳刚德.高中化学新课程理念与实施[M].海口:海南出版社,2004:27~28.
[4]中华人民共和国教育部制订.普通高中化学课程标准(实验)[S].北京:人民教育出版社,2003:7~8.
[5]周业虹.关注社会参与 注重评价方式 培养科学素养[J].化学教学,2016,(4):93.
- 浅谈光纤通信技术发展趋势的研究
- 电力基建配套通信工程项目管理
- 刍议电视新闻采编的工作创新策略
- 电力通信光缆运行维护及外力破坏防范措施
- 大磁盘空间服务器RAID构建方法
- 网络安全现状与技术发展
- 全网通终端手机发展与展望
- 浅谈移动互联网背景下的中医健康管理服务系统的研究开发
- 浅谈计算机网络通讯技术故障分析与处理
- 输油管道泄漏无线监测系统的设计研究
- 浅谈医院信息网络系统安全的管理和维护
- 三网融合下的有线电视研究
- 计算机网络信息安全及防护策略研究
- 基于FPGA的异步FIFO的设计
- 运营商蜂窝物联网NB-IoT及eMTC的部署策略探讨
- 10kV电力电缆故障分析及其论述
- 基于综合集成研讨厅的协同会商系统的思考
- 网络通信技术在现实中的应用和影响研究
- 基于IMX6Q构建云终端
- 计算机数据挖掘技术的开发研究
- 西藏地区互联网及电子商务发展情况研究报告
- 大数据对图书馆信息服务的启示
- 高中生学习计算机技能的方向的探索
- 基于博弈论在蜂窝网络D2D通信中的干扰管理技术研究
- 存量站址整合
- ruder
- rudery
- rudest
- rudimentarily
- rudimentariness
- rudimentarinesses
- rudimentary
- rudiments
- rudish
- rue
- rued
- rueful
- ruefully
- ruefulness
- ruefulnesses
- rueing
- ruer
- ruers
- rues
- ruffle
- rufflers
- ruffles
- ruffle²
- ruffle¹
- ruffling
- 睁察
- 睁开
- 睁开眼
- 睁眉怒目
- 睁眼
- 睁眼一团黑
- 睁眼一抹黑
- 睁眼不眠
- 睁眼仰视的样子
- 睁眼儿
- 睁眼光是钱
- 睁眼怒视
- 睁眼愣视
- 睁眼愣视的样子
- 睁眼的样子
- 睁眼的瞎子
- 睁眼直视
- 睁眼瞎
- 睁眼瞎子
- 睁眼瞎子挟算盘——冒算
- 睁眼瞎考状元——白丢人现眼
- 睁眼苫眉
- 睁眼说瞎话
- 睁着
- 睁着一只眼,闭着一只眼