摘 要 通过电聚合和电沉积,将聚邻苯二胺(PoPD)/酸化多壁碳纳米管(MWNTs)网孔结构支撑的硅钨酸(SiW12 )杂多阴离子成功地组装在玻碳电极(GCE)上,形成SiW12/PoPD/MWNTs/GCE。采用扫描电子显微镜和循环伏安法对不同电极复合膜进行表征,并考察BrO3在电极上的电化学行为,发现SiW12/PoPD/MWNTs/GCE对BrO3具有显著的电催化还原性,其作用机理是基于硅钨酸杂多阴离子复合膜在电化学还原BrO3过程中,通过静电作用将BrO3吸附到电极的表面,BrO3在电极表面接受H+ 和硅钨酸失去的电子,依次被还原为HBrO、Br2 、Br
。该电极在0.20 mol/L 磷酸盐缓冲溶液(pH=3.0)中,BrO3的线性范围为1.0×108 ~1.0×104 mol/L,检出限达7.0×109 mol/L。此电极选择性、重现性、稳定性好,可用于实际水样中BrO3检测,回收率在98.4%~104.1%之间,且与离子色谱方法检测结果一致,符合国家标准对水中溴酸盐的检测要求。
关键词 硅钨酸杂多阴离子; 碳纳米管; 网孔结构; 溴酸盐; 水质检测
1 引 言
溴酸盐(BrO3)是天然泉水、矿泉水和生活饮用水经过臭氧或者氯氧消毒所产生的毒副产物[1] ,会损伤细胞内DNA和染色体的结构[2] ,是潜在的致癌物[3] 。欧洲、美国、中国等先后明确规定禁止使用溴酸盐作为食品的处理剂或者添加剂[4] 。我国明确规定饮用水中BrO3的含量不得超过10 μg/L。因此,发展合理的BrO3消除及快速检测技术对水资源的保护、人类的健康非常重要。
目前, 检测BrO3的方法主要有分光光度法[5] 、荧光分析法[6] 、离子色谱法[7] 、离子色谱-质谱联用法[8] 、等离子质谱法[9] 、X-射线荧光法[10] 、电化学方法[11] 等,其中电化学修饰电极具有仪器简单,操作方便、快速灵敏等优点,受到研究者的关注。检测BrO3的修饰电极敏感膜基本可分为3类:第一类是有机聚合膜,即在电极上电聚合有机胺(如苯胺等)形成导电聚合物敏感膜[12] ;第二类是金属杂多酸膜,即在电极上修饰金属杂多酸及其盐,如Cs3PW12 O40 复合膜对BrO3有良好响应[13] ;第三类是金属杂多酸结合有机物或有机聚合物形成的敏感膜,如Rodriguez-Albelo等[14] 采用对苯二甲酸、四丁基铵与磷钼锌杂多酸合成的金属有机框架化合物在0.2~40 mmol/L之间对BrO3有良好的电催化还原性能;Ding等[15] 在玻碳电极(GCE)表面电化学还原经聚二甲基二烯丙基氯化铵处理过的氧化石墨烯,结合磷钼酸,对BrO3响应的线性范围达0.02 ~10 mmol/L。第三类敏感膜不仅具备有机聚合膜的优良稳定性,也具备金属杂多酸多电子可逆氧化还原性,因此得到许多研究者关注[14~16] 。然而,在金属杂多酸中,特别是结合有机聚合物的硅钨酸(SiW12 )还很少用于BrO3的灵敏检测。本研究通过电聚合邻苯二胺(o-PD)于酸化多壁碳纳米管(MWNTs)上形成网孔状支撑结构,再逐步电沉积硅钨酸杂多阴离子而构建一种新型结构的SiW12/PoPD/MWNTs/GCE,对BrO3具有高灵敏性,在环境保护和食品安全领域具有重要价值。
2 实验部分
2.1 仪器与试剂
所有电化学实验均在CHI-760B型电化学工作站(上海辰华仪器有限公司)上完成,采用常规三电极体系:裸玻碳电极(GCE)或复合膜修饰电极为工作电极,铂丝为辅助电极,饱和甘汞电极作为参比电极;电极表面形貌采用JSM-6700型扫描电子显微镜(SEM,日本电子公司)表征;电极、玻璃仪器的超声清洗和碳纳米管溶液的辅助分散均采用KQ-3200B型超声波清洗器(昆山市超声仪器有限公司)。
硅钨酸(H4SiW12 O40 ,简写为SiW12 )、邻苯二胺(o-PD)、KBrO3、NaBr、H3PO4(85%)、Na2HPO4、NaH2PO4、K3F(CN)6、N,N-二甲基甲酰胺(上海国药集团化学试剂有限公司);多壁碳纳米管(MWNTs,纯度为98%,南京吉仓纳米科技有限公司);氧化铝粉(上海仙仁仪器仪表有限公司);所用试剂均为分析纯,实验用水均为超纯水(电导率≥18.3 MΩ·cm)。
2.2 SiW12/PoPD/MWNTs/GCE的制备
依次用粒径为1.0、0.3和0.05 μm的Al2 O3粉末将GCE表面打磨至镜面般光滑,分别置于无水乙醇、丙酮和超纯水中超声清洗5 min,自然晾干,备用。
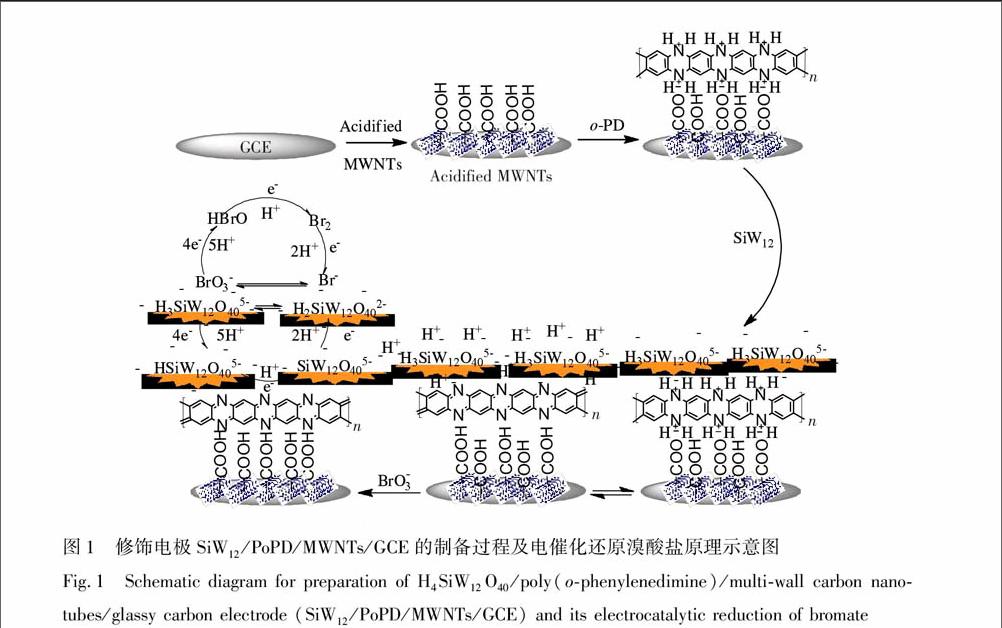
如图1所示,采用物理沉积、电化学聚合和沉积方法制备复合膜修饰电极。按Subrizi等[17] 的方法对MWNTs进行酸化,取10 μL 酸化后的MWNTs悬浊液(1 mg/mL)滴涂在预处理好的GCE表面上,静置、晾干,得到MWNTs/GCE;然后采用循环伏安法(CV),将制备好的MWNTs/GCE置于含0.01 mol/L o-PD的0.5 mol/L H2SO4溶液中进行电位扫描,电位范围为0.8~1.5 V,扫速为100 mV/s,扫描12圈,得到PoPD/MWNTs/GCE;再将上述电极置于含3.5 mg/L SiW12 和0.5 mol/L H2SO4的混合溶液中,在0.8~0.8 V范围内进行CV扫描,扫速为100 mV/s,扫描15圈,得到复合膜修饰电极SiW12/PoPD/MWNTs/GCE。
2.3 水样采集
水样有自来水、矿泉水(康师傅矿物质水,武汉顶津食品有限公司长沙生产分公司)、实验室废水、雨水(采集于实验室楼顶)、湖水(云影湖水面下20 cm处)、江水(湘江江心水面下20 cm处)。所有水样各取1 L,分别密封保存于聚乙烯瓶中,冷藏于有冰袋的保温箱。实验前将水样中的固体杂物滤去,再用0.45 μm滤膜过滤,以1% HCl调节水样至pH 3.0,然后置于冰箱中保存备用。
3 结果与讨论
3.1 邻苯二胺的电聚合
在电极表面电聚合邻苯二胺可形成导电性能强的聚邻苯二胺膜层(图1)。将制备好的MWNTs/GCE置于含0.01 mol/L邻苯二胺的0.5 mol/L H2SO4溶液中进行CV扫描,随着扫描圈数的增加,o-PD氧化峰(0.65 V)的电流值逐渐变小,PoPD还原峰(-0.32 V)和氧化峰(0.01 V)的电流值逐渐增加,且随反应进行溶液的颜色逐步由无色转变为淡黄色,说明o-PD分子在电极表面聚合为PoPD。优化的电聚合扫描圈数为12圈。
3.2 电沉积硅钨酸
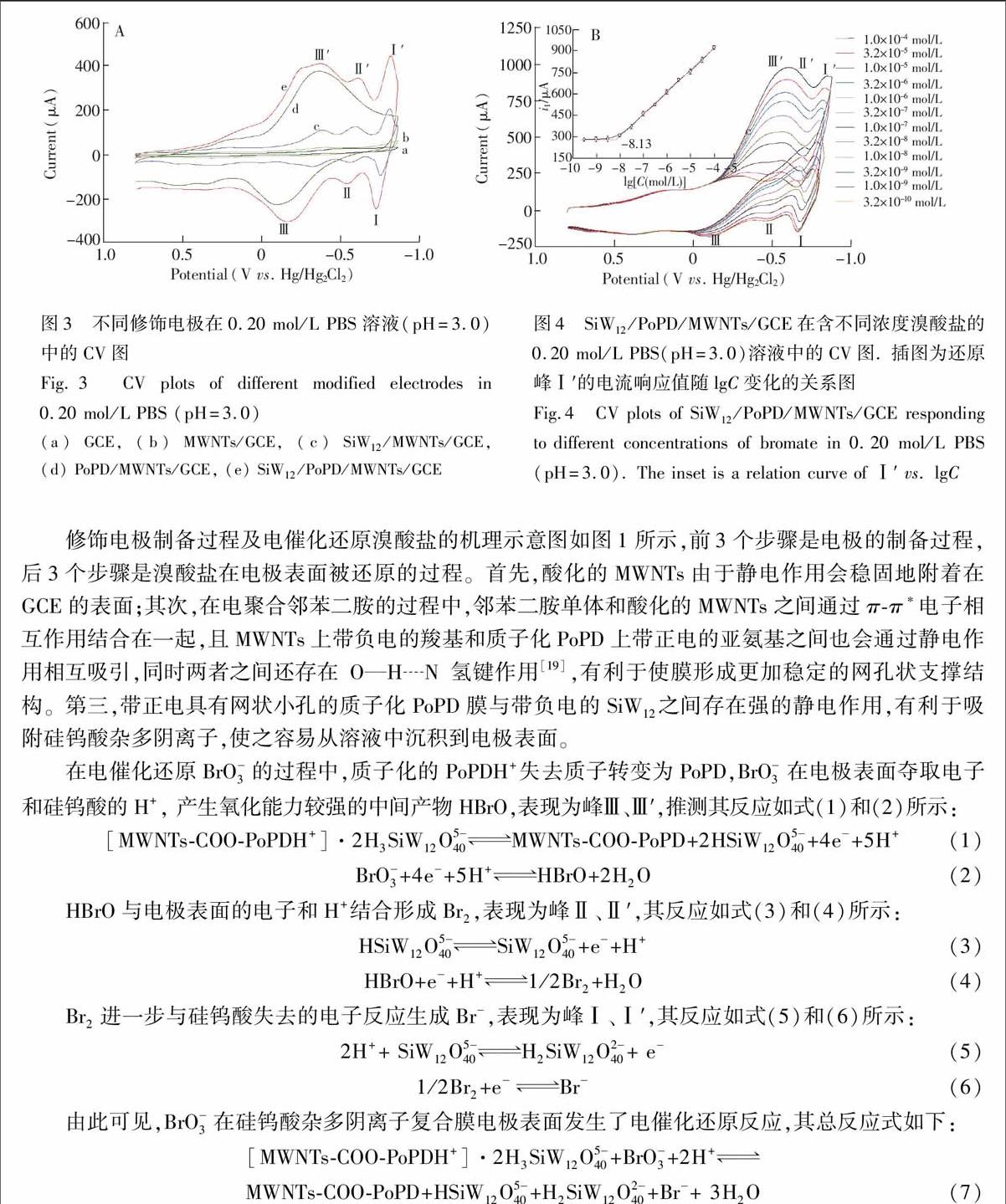
通过电化学方法在PoPD/MWNTs/GCE表面沉积SiW12 ,可以使带负电的硅钨酸快速与带正电的聚邻苯二胺膜层紧密地结合在一起(图1)。将制备好的PoPD/MWNTs/GCE置于含3.5 mg/L SiW12 和0.5 mol/L H2SO4溶液中进行CV扫描,观察到3对可逆氧化还原峰,其相应的条件电位分别为Ef(Ⅰ-Ⅰ′)=0.77 V、 Ef(Ⅱ-Ⅱ′)=0.58 V、Ef(Ⅲ-Ⅲ′) =0.34 V;与PoPD氧化还原峰电位对比可知,峰Ⅲ和峰Ⅲ′不仅是SiW12 的第三对氧化还原峰,还是PoPD的氧化还原峰。一方面,这是由于PoPD的氧化还原峰和SiW12 的第3对氧化还原峰的电位值比较接近造成的;另一方面,在电沉积过程中带负电的硅钨酸杂多阴离子与聚邻苯二胺上质子化的亚氨基容易通过静电作用结合,导致这两个峰的之间的电位差进一步减小。在这3对峰中,硅钨酸特征峰Ⅰ和Ⅰ′的电流值最大,峰形最好。优化的电沉积扫描圈数为15圈。
3.3 修饰电极的SEM表征
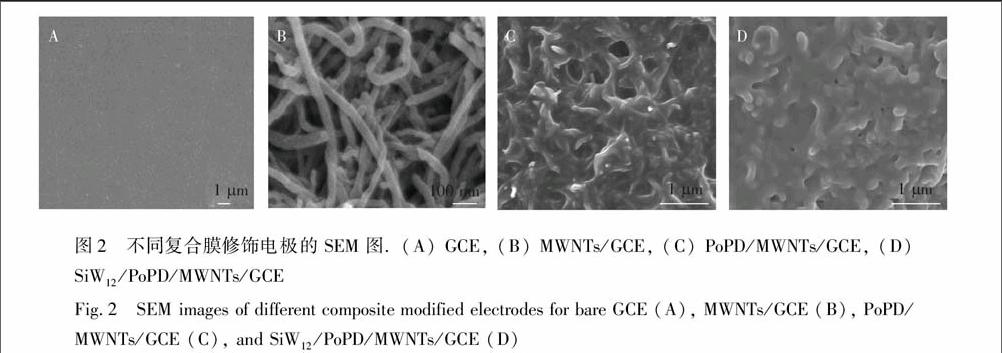
采用SEM分别表征了不同复合膜修饰电极的表面形貌(图2)。由图2A可见,未经修饰的裸GCE表面十分平整。在GCE表面修饰上MWNTs后,电极表面出现了大量呈管状物质(图2B),这大大增加了修饰电极的比表面积。在MWNTs/GCE上电聚合o-PD后,修饰电极上出现了一层薄膜覆盖物,并且表面有许多网状小孔(图2C),该结构具有优良的支撑作用和吸附性能。在PoPD/MWNTs/GCE上电沉积硅钨酸后,电极表面网状小孔被部分填充或渗透覆盖(图2D),这说明硅钨酸已经与聚邻苯二胺结合,并有效附着到电极表面。
3.4 SiW12在PoPD修饰玻碳电极上的直接电化学行为
采用循环伏安法考察了不同膜修饰电极在pH 3.0的0.20 mol/L磷酸盐缓冲溶液(PBS)中的电化学行为(图3)。在-0.8~0.8 V范围内,裸GCE和MWNTs/GCE都没有出现氧化还原峰。电沉积硅钨酸后,SiW12/MWNTs/GCE呈现出3对明显的氧化还原峰,此复合膜在测试过程中不牢固、易脱落。而有聚邻苯二胺支撑的SiW12/PoPD/MWNTs/GCE则牢固、稳定,且出现三对明显的非常强的氧化还原峰,其各对氧化峰与还原峰的电位差(-EP )分别为-EⅠ-Ⅰ′ = 91 mV、-EⅡ-Ⅱ′ =73 mV、-EⅢ-Ⅲ′ =187 mV,且各对氧化还原峰的电流响应值之比(ipa/ipc )均约等于1。根据Laviron理论[18] ,准可逆过程的-EP<200 mV, 表明此电极反应为准可逆反应。
3.5 溴酸盐电化学响应特性及机理探讨
采用循环伏安法探讨了修饰电极SiW12/PoPD/MWNTs/GCE对不同浓度BrO3的电化学响应特性(如图4所示),随着溴酸盐浓度的增加,还原峰Ⅰ′的电流逐渐增大,与之对应的氧化峰Ⅰ的电流逐渐减小,说明电极对BrO3的还原具有催化作用;当浓度大于3.2×108 mol/L时,还原峰Ⅲ′和Ⅱ′重合,这是因为PoPD的还原峰逐渐增大、负移,电位相近,与SiW12 还原峰Ⅲ′、Ⅱ′叠加在一起。同时,在浓度范围为1.0×108 ~ 1.0×104 mol/L之间,还原峰Ⅰ′的峰电流值与浓度对数值呈良好的线性关系(图4内插图),线性方程可拟合为iⅠ′ = 1530 + 153.5 lgC,相关系数r=0.9993;由作图法可得电极的检测下限为7.0×109 mol/L,即0.89 μg/L,低于国家规定的水中溴酸盐含量不超过10 μg/L的界限,因此该修饰电极可用于饮用水中BrO3的高灵敏检测。
(a) GCE, (b) MWNTs/GCE, (c) SiW12/MWNTs/GCE, (d) PoPD/MWNTs/GCE, (e) SiW12/PoPD/MWNTs/GCE 图4 SiW12/PoPD/MWNTs/GCE在含不同浓度溴酸盐的0.20 mol/L PBS(pH=3.0)溶液中的CV图. 插图为还原峰Ⅰ′的电流响应值随lgC变化的关系图修饰电极制备过程及电催化还原溴酸盐的机理示意图如图1所示,前3个步骤是电极的制备过程,后3个步骤是溴酸盐在电极表面被还原的过程。首先,酸化的MWNTs由于静电作用会稳固地附着在GCE的表面;其次,在电聚合邻苯二胺的过程中,邻苯二胺单体和酸化的MWNTs之间通过π-π*电子相互作用结合在一起,且MWNTs上带负电的羧基和质子化PoPD上带正电的亚氨基之间也会通过静电作用相互吸引,同时两者之间还存在OHN氢键作用[19] ,有利于使膜形成更加稳定的网孔状支撑结构。第三,带正电具有网状小孔的质子化PoPD膜与带负电的SiW12 之间存在强的静电作用,有利于吸附硅钨酸杂多阴离子,使之容易从溶液中沉积到电极表面。
在电催化还原BrO3的过程中,质子化的PoP + 失去质子转变为PoPD,BrO3在电极表面夺取电子和硅钨酸的H+, 产生氧化能力较强的中间产物HBrO,表现为峰Ⅲ、Ⅲ′,推测其反应如式(1)和(2)所示:[MWNTs-COO-PoP +]·2H3SiW12O540MWNTs-COO-PoPD+2HSiW12O5
40+4e+5H+(1)BrO3+4e+5H+HBrO+2H2O(2)HBrO与电极表面的电子和H+结合形成Br2,表现为峰Ⅱ、Ⅱ′,其反应如式(3)和(4)所示:
3.6 缓冲液pH值的影响
将制备好的SiW12/PoPD/MWNTs/GCE分别置于pH值为5.0,3.9,3.0,2.5,2.0,1.35,含3.2×103的0.20 mol/L PBS溶液中测定其循环伏安曲线。当pH<3.0时,还原峰Ⅰ′电流值随pH值增加而增大;当pH>3.0时,峰Ⅰ′电流值随pH增大而下降;当pH=3.0时,峰Ⅰ′的电流值最大,即pH 3.0为最佳条件。
3.7 扫描速率对电极的影响
3.8 重现性、重复性和电极的稳定性
将同一批次制备的7支SiW12/PoPD/MWNTs/GCE分别置于含0.10和10 μmol/L BrO3的0.20 mol/L PBS溶液(pH=3.0)中进行测定,还原峰Ⅰ′电流响应值的相对标准偏差分别为2.1%和3.3%,表明电极重现性好。取同一支电极在上述两个相同溶液中反复测定6次,其响应值的相对标准偏差分别为1.6%和2.2%,表明电极的重复性好。
将电极SiW12/PoPD/MWNTs/GCE对含1.0 μmol/L BrO3样品进行连续检测,持续35天。在28 天内,电极对BrO3的响应值基本保持不变,其电流响应的平均值为(624.9±2.5)μA,电流响应变化的相对标准偏差为0.40%,且使用28和35天时的电流响应值分别下降为初始响应值的99.40%和96.31%,说明此电极具有良好的稳定性,使用寿命至少为1个月。
3.9 干扰离子影响
在优化条件下,考察了常见阴离子对此修饰电极测定BrO
3.10 分析应用
将所制电极SiW12/PoPD/WMNTs/GCE,用于所采集的自来水、矿泉水、实验室废水、雨水、湖水和江水等水样中溴酸盐的测定,计算样品中BrO 3的含量和回收率,并与国家标准—离子色谱法进行对照,结果见表1。由表1可知,所制得修饰电极和离子色谱法对水样中溴酸盐含量的检测结果比较一致,两个方法的平均相对偏差为1.3%,且修饰电极方法的回收率在98.4%~104.1%之间,表明此电极对实际水样中溴酸盐的定量检测达到高准确度,在食品安全和环境监测领域的实际应用具有可行性。
4 结 论
基于酸化多壁碳纳米管和电聚合邻苯二胺形成的网状支撑结构,电沉积具有多电子可逆氧化还原性的硅钨酸,构建了一种用于实际水样中溴酸盐高灵敏检测的新型结构修饰电极SiW12/PoPD/MWNTs/GCE,检测下限达到7.0×109 mol/L,探讨了其电催化还原BrO3的行为和机理。此电极可与离子色谱方法相比拟,在食品安全和环境监测方面具有应用价值。
References
1 Davidson A N, Chee-Sanford J, Lai H Y, Ho C H, Klenzendorf J B, Kirisits M J. Water Res, 2011, 45(18): 6051-6062
2 Zhang Y, Jiang L J, Jiang L P, Geng C Y, Li L L, Shao J, Zhong L F. Chem. Biol. Interact., 2011, 189(3): 186-191
3 Kolisetty N, Delker D A, Muralidhara S, Bull R J, Cotruvo J A, Fisher J W, Cummings B S. Arch. Toxicol., 2013, 87(11): 1911-1925
4 Oyekunle J A O, Adekunle A S, Ogunfowokan A O, Olutona G O, Omolere O B. Toxicol. Rep., 2014, 1: 224-230
5 Romele L, Achill M. Analyst, 1998, 123: 291-294
6 Al-Saidi H M, El-Shahawi M S. Spectrochim. Acta A, 2015, 138: 736-742
7 YANG Chun-Ying, HANG Yi-Ping, ZHONG Xin-Lin. Chinese J. Anal. Chem., 2007, 35 (11): 1647-1650
杨春英, 杭义萍, 钟新林. 分析化学, 2007, 35(11): 1647-1650
8 Barron L, Gilchrist E. Anal. Chim. Acta, 2014, 806: 27-54
9 Elwaer A R, McLeod C W, Thompson K C. Anal. Chem., 2000, 72(22): 5725-5730
10 Hatzistavros V S, Koulouridakis P E, Aretaki I I, Kallithrakas-Kontos N G. Anal. Chem., 2007, 79(7): 2827-2832
11 SHI Yuan-De, LIN Shen, XU Hui-Hong, LUO Ming-Hong, ZHENG Si-Ning. Chem. J. Chinese. U., 2010, 31(6): 1200-1205
施源德, 林 深, 徐慧红, 罗明洪, 郑思宁. 高等学校化学学报, 2010, 31(6): 1200-1205
12 Ding L, Li Q, Zhou D D, Cui H, An H, Zhai J P. J. Electroanal. Chem., 2012, 668: 44-50
13 Cuentas-Gallegos A K, Miranda-Hernández M, Vargas-Ocampo A. Electrochim. Acta, 2009, 54(18): 4378-4383
14 Marleny Rodriguez-Albelo L, Ruiz-Salvador A R, Sampieri A, Lewis D W, Gómez A, Nohra B, Mialane P, Marrot J, Sécheresse F, Ngo Biboum R, Keita B, Nadjo L, Dolbecq A. J. Am. Chem. Soc., 2009, 131(44): 16078-16087
15 Ding L, Liu Y P, Guo S X, Zhai J P, Bond A M, Zhang J. J. Electroanal. Chem., 2014, 727: 69-77
16 Papagianni G G, Stergiou D V, Armatas G S, Kanatzidis M G, Prodromidis M I. Sens. Actuators B, 2012, 173: 346-353
17 Subrizi F, Crucianelli M, Grossi V, Passacantando M, Pesci L, Saladino R. ACS Catalysis, 2014, 4(3): 810-822
18 Laviron E. J. Electroanal. Chem., 1974, 52(3): 355-393
19 Wu T M, Lin Y W. Polymer, 2006, 47(10): 3576-3582
- 酒店女性管理者工作压力源与缓解对策研究
- 某高速公路路堑高边坡施工安全总体风险评估的应用
- 基于ISM的X公司生产系统影响因素分析
- 创新驱动下的高层次经营管理人才培养机制建设研究
- 试析工程造价超预算的原因和控制策略
- 试析公路试验检测与现场施工质量控制要点
- PPP模式下城市污水处理风险管理
- 福建LNG5#、6#储罐总承包项目进度管理的系统控制
- 银川市旅游发展潜力评价研究
- 大学生购买知识付费产品的调查研究
- 高原地区埋地钢制油气管道风险评价模型研究
- 我国物业管理企业发展现状分析
- 基于FMEA法的复杂系统风险因素识别研究
- 浅谈小型混凝土预制构件在开民高速中的施工管理与质量控制
- 基于BIM的建筑工程项目集成管理研究
- 基于PDCA循环管理的大学生主题餐厅策划与经营
- 创业孵化基地、创业团队及创业项目的全生态协同系统探索
- 我国职业资格证书供给问题的探析
- 基于SWOT分析的广西“渝桂新”南向通道建设对策研究
- 资源型县域经济转型发展研究
- 基于BIM技术的建筑工程安全管理研究
- 高精度智能全站仪结合徕卡多测回测角软件在山区高程控制测量中的应用
- Revit在住宅项目中的运用
- 我国装配式建筑发展现况探讨
- 现代信息技术在高等教育中的应用进展
- blur
- blurb
- blurbed
- blurbing
- blurbist
- blurbists
- blurbs
- blurred
- blurredly
- blurredness
- blurrednesses
- blurring
- blurringly
- blurs
- blurt
- blurted
- blurter
- blurters
- blurting
- blurt-out
- blurt out
- blurts
- blurt sth out
- blur²
- blur¹
- 老明公
- 老星
- 老春
- 老是
- 老是响(想)
- 老是埋怨客观
- 老是惊慌恐惧,心神不定
- 老是想着,念念不忘
- 老是扭在一起
- 老是记挂在心,放心不下
- 老是那一套
- 老是面皮,饱是肚皮
- 老晃儿
- 老晒
- 老景
- 老曲儿
- 老更
- 老月
- 老有所为
- 老有所乐
- 老有所伴
- 老朋友
- 老朋友和新朋友
- 老朋友的感情
- 老末