
1.考查非金属及其化合物的性质
例1(江苏化学卷)下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )。
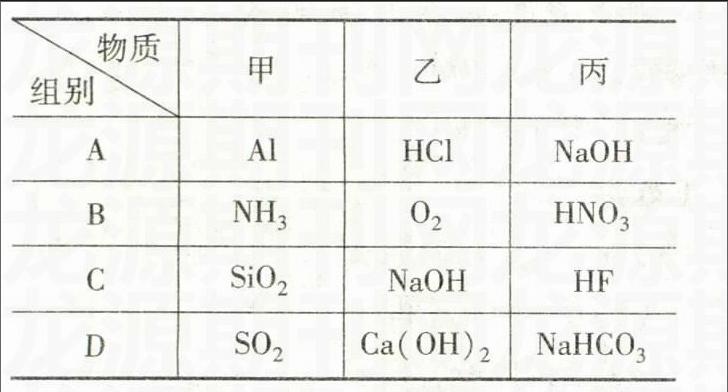
物质组别甲乙丙
AAlHClNaOH
B NH3O2 HNO3
CSiO2NaOHHF
DSO2Ca(OH)2NaHCO3
解析Al与盐酸和NaOH溶液均能反应,盐酸与NaOH溶液也能反应;NH3与O2和HNO3均能反应(NH3与O2反应生成NO和水),但O2与HNO3不反应;SiO2与NaOH溶液和HF均能反应,NaOH溶液与HF也能反应;SO2与Ca(OH)2溶液和NaHCO3溶液均能反应,Ca(OH)2溶液与NaHCO3溶液也能反应;则只有B项符合题意。故答案为B。
例2(海南化学卷)下列关于物质应用的说法错误的是( )。
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气 D.Na2S可除去污水中的Cu2+
解析玻璃容器可长期盛放不能与玻璃反应的酸,但由于氢氟酸能腐蚀玻璃,则不能盛放氢氟酸,A项错误;纯碱溶液显碱性(水解使溶液显碱性),可用于清洗油污(能促进油脂的水解),B项正确;浓氨水挥发出的氨气能够与氯气反应先生成氮气和氯化氢(2NH3+3Cl2N2+6HCl),然后HCl与NH3反应可产生白烟(NH3+HClNH4Cl),则浓氨水可检验氯气管道漏气,C项正确;Na2S电离出的S2-与污水中的Cu2+反应生成CuS沉淀,则Na2S可除去污水中的Cu2+,D项正确。故答案为A。
2.考查非金属化合物的性质
例3(天津理综卷,节选)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a.NH3 b.HI c.SO2 d.CO2
解析浓硫酸是酸性干燥剂,且具有强氧化性,不能干燥NH3和HI,能够干燥SO2和CO2;P2O5也是酸性干燥剂,能够干燥HI,不能干燥NH3。故答案为b。
3.考查物质的成分与应用
例4(海南化学卷)化学与日常生活密切相关,下列说法错误的是( )。
A.碘酒是指单质碘的乙醇溶液 B.84消毒液的有效成分是NaClO
C.浓硫酸可刻蚀石英制艺术品
D.装饰材料释放的甲醛会造成污染
解析碘酒是指单质碘的酒精溶液,酒精是乙醇的俗称,A项正确;84消毒液是Cl2与NaOH溶液反应得到的,其有效成分是NaClO,B项正确;浓硫酸与石英(二氧化硅)不反应,浓硫酸不能刻蚀石英制艺术品(氢氟酸可刻蚀石英制艺术品),C项错误;甲醛是有毒气体(甲醛会造成人体一些不适,使人的免疫能力下降),因此装饰材料释放的甲醛会造成污染,D项正确。故答案为C。
例5(海南化学卷)下列关于物质应用和组成的说法正确的是( )。
A.P2O5可用于干燥Cl2和NH3
B.“可燃冰”主要成分是甲烷和水
C.CCl4可用于鉴别溴水和碘水
D.Si和SiO2都用于制造光导纤维
解析P2O5是酸性干燥剂,可用于干燥Cl2,但P2O5能够与碱性气体NH3发生反应而不能干燥NH3,A项错误;“可燃冰”是甲烷的水化物,其主要成分是甲烷和水,B项正确;溴单质和碘单质在有机溶剂CCl4中的溶解度较大(其溶液的颜色不同),而在水中的溶解度较小,且CCl4的密度比水大,分别向溴水和碘水中加入CCl4、振荡、静置,下层是紫色的碘的CCl4溶液或橙色的溴的CCl4溶液,则CCl4可用于鉴别溴水和碘水,C项正确;Si用于制半导体材料,SiO2用于制造光导纤维,D项错误。故答案为B、C。
4.考查氯水的性质与成分
例6(江苏化学卷)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
解析氯气是黄绿色气体,氯水的颜色呈浅黄绿色,说明氯水中含有Cl2(氯水的颜色是氯气分子表现出来的),A项正确;向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,白色沉淀是AgCl,说明氯水中含有Cl-,B项正确;向氯水中加入NaHCO3粉末,有气泡产生(产生的气体是CO2),说明氯水中含有H+,C项正确;向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明有氯化铁生成,由于氯气也能把FeCl2氧化成FeCl3,则不能说明氯水中含有HClO,D项错误。故答案为D。
5.考查常见气体的实验室制法
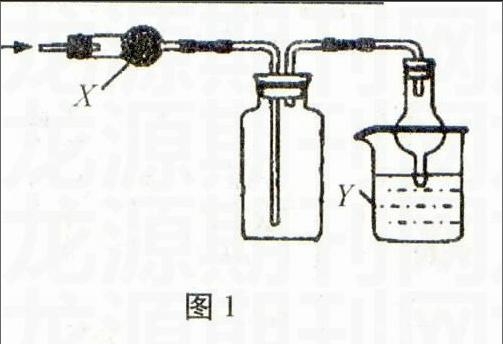
例7(上海化学卷)图1是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )。
选项X收集气体Y
A 碱石灰氯化氢水
B 碱石灰氨气水
C 氯化钙二氧化硫氢氧化钠
D 氯化钙一氧化氮氢氧化钠
解析氯化氢是酸性气体,不能用碱石
图1
灰干燥,A项错误;氨气的密度比空气小,用如图收集应该是“短进长出”(用向下排空气法收集),B项错误;二氧化硫是酸性气体,能用氯化钙干燥,且二氧化硫的密度比空气大,用向上排空气法收集,尾气用氢氧化钠溶液吸收,C项正确;一氧化氮极易与空气中的氧气反应生成二氧化氮,不能用排空气法收集,D项错误。故答案为C。
6.考查常见阴离子的推断
例8(上海化学卷)某未知溶液可能含Cl-、CO2-3、Na+、SO2-4、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )。
A.一定有Cl-B.一定有SO2-4
C.一定没有Al3+ D.一定没有CO2-3
解析因将溶液滴在蓝色石蕊试纸上,试纸变红,说明溶液显酸性,则一定没有CO2-3。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成,则一定有SO2-4;在其上层清液中滴加硝酸银溶液,产生白色沉淀,则白色沉淀是氯化银,但由于加入了氯化钡溶液而引入了Cl-,则不能确定原溶液中是否含有Cl-。根据电中性原理可知,Na+和Al3+至少有一种。故答案为B、D。
7.以非金属或其化合物的性质为素材,考查化学方程式的书写
例9(上海化学卷,节选)硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式 。
(2)石油化工的废气中有H2S。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示: 、 。
解析 (1)根据题给反应物和生成物(注意H2SO4是反应物之一),用化合价升降法可写出其化学方程式为5H2S+2KMnO4+3H2SO4K2SO4+2MnSO4+5S↓+8H2O。
(2)方法一:SO2与H2S反应可生成单质硫,而H2S完全燃烧可产生SO2,其化学方程式为2H2S+3O
2点燃2SO2+2H2O,2H2S+SO23S+2H2O。方法二:H2S不完全燃烧可产生单质硫,H2S受热分解也生成单质硫,其化学方程式为:
2H2S+O2点燃2S+2H2O,H2S△S+H2O。
故答案为:(1)5H2S+2KMnO4+3H2SO4
K2SO4+2MnSO4+5S↓+8H2O;
(2)2H2S+3O2点燃2SO2+2H2O,2H2S+SO23S+2H2O;2H2S+O2点燃2S+2H2O,H2S△S+H2。
例10(北京理综卷,节选)NH3经一系列反应可以得到HNO3,如图2所示。
图2
(1)I中,NH3 和O2在催化剂作用下反应,其化学方程式是 。
(2)N2O4与O2、H2O化合的化学方程式是 。
解析(1)NH3 和O2在催化剂作用下反应生成NO和H2O,其化学方程式为:
4NH3+5O2催化剂△4NO+6H2O
(2)N2O4与O2、H2O化合生成HNO3,其化学方程式为2N2O4+O2+2H2O4HNO3。
故答案为:(1)4NH3+5O2催化剂△4NO+6H2O;(2)2N2O4+O2+2H2O4HNO3。
8.以非金属及其化合物的离子的性质为素材,考查离子能否大量共存的判断
例11(山东理综卷)下列有关溶液组成的描述合理的是( )。
A.无色溶液中可能大量存在Al3+、NH+4、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO2-4、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO-3
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO2-4
解析A组的Al3+与S2-能够发生双水解反应而不能大量共存;在酸性溶液中B组的ClO-能将I-氧化而不能大量共存;弱碱性溶液中C组的四种离子彼此不反应而能够大量共存;在中性溶液中D组的Fe3+能够发生强烈的水解生成Fe(OH)3沉淀而不能大量共存。故答案为C项。
例12(2014年广东理综卷)水溶液中能大量共存的一组离子是( )。
A.Na+、Ca2+、Cl-、SO2-4
B.Fe2+、H+ 、SO2-3、ClO-
C.Mg2+、NH+4、Cl-、SO2-4 D.K+、Fe3+、NO-3、SCN-
解析A组中的Ca2+与SO2-4能够生成微溶物CaSO4而不能大量共存;B组中的Fe2+、SO2-3在H+存在下能够被ClO-氧化(且H+能够与ClO-结合生成HClO,H+能够与SO2-3反应)而不能大量共存;C组离子彼此不反应而能够大量共存;D组中的Fe3+与SCN-能够发生络合反应而不能大量共存。故答案为C。
9.以非金属及其化合物的性质为素材,考查离子方程式正误的判断
例13(四川理综卷)能正确表示下列反应的离子方程式是( )。
A.Cl2通入NaOH溶液:
Cl2+OH-Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀HCl:
CO2-3+2H+CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2OAlO-2+4NH+4+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO-3
3Cu2++2NO↑+4H2O
解析A项错在质量不守恒和电荷不守恒,其正确的离子方程式为Cl2+2OHˉCl-+
ClO-+H2O;B项错在将难电离的弱酸的酸式酸根离子写成离子形成,其正确的离子方程式为HCO-3+H+CO2↑+H2O;C项错在产物不符合客观事实,产物有Al(OH)3沉淀生成(氢氧化铝不溶于氨水),其正确的离子方程式为Al3++3NH3·H2O Al(OH)3↓+3NH+4;而D项符合离子方程式的书写原则。故答案为D。
10.以非金属及其化合物的性质为素材,考查物质的鉴别
例14 (重庆理综卷)下列实验可实现鉴别目的是( )。
A.用KOH溶液鉴别SO3(g)和SO2
B.用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2、
C.用CO2鉴别NaAlO2溶液和CH3COONa溶液
D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液
解析SO3(g)和SO2均能与KOH溶液反应,且均没有明显现象产生,则用KOH溶液不能鉴别SO3(g)和SO2;Br2(g)和NO2均具有氧化性,均能使湿润的碘化钾淀粉试纸变蓝,则用湿润的碘化钾淀粉试纸不能鉴别Br2(g)和NO2;CO2与NaAlO2溶液反应能够产生白色沉淀,CO2与CH3COONa溶液不反应(将CO2通入CH3COONa溶液无明显现象产生),用CO2能鉴别NaAlO2溶液和CH3COONa溶液;BaCl2溶液与AgNO3溶液和K2SO4溶液反应均产生白色沉淀(分别生成AgCl和BaSO4),则用BaCl2溶液不能鉴别AgNO3溶液和K2SO4溶液。故答案为C。
11.以非金属及其化合物的性质为素材,考查物质的除杂
例15(海南化学卷)下列除杂操作可行的是( )。
A.通过浓硫酸除去HCl中的H2O
B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2
D.通过水除去CO中的CO2
解析浓硫酸具有吸水性,且与HCl不反应,通过浓硫酸可除去HCl中的H2O,A项正确;H2和CO都能与灼热的CuO反应,将其通过灼热的CuO把H2也除掉了(而转化为CO2和水蒸气),B项错误;灼热的镁粉与N2和O2都能反应,将其通过灼热的镁粉把N2也除掉了,C项错误;CO2在水中的溶解度很小,通过水不能除去CO中的CO2,D项错误。故答案为 A。
12.以氯气的制取和回收氯化锰的实验为素材,考查实验方案的评价
例16(江苏化学卷)图3装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )。
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
图3
解析用浓盐酸与MnO2反应制氯气需要加热,装置甲没有酒精灯,A项错误;除去氯气中的少量氯化氢应用饱和NaCl溶液作吸收剂,且气体通过洗气瓶时应“长进短出”,B项错误;二氧化锰不溶于水,氯化锰溶于水,可用过滤的方法分离,C项正确;在加热氯化锰溶液的过程中氯化锰会发生水解,最终得不到MnCl2·4H2O,D项错误。故答案为C。
13.考查有关计算
例17(全国理综大纲卷)已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且
c(Cl-)c(ClO-)
的值与温度高低有关。当c(KOH)=a mol时,下列有关说法错误的是( )。
A.若某温度下,反应后c(Cl-)c(ClO-)=11,则溶液中c(ClO-)c(ClO-3)=12
B.参加反应的氯气的物质的量等于12a mol
C.改变温度,反应中转移电子的物质的量ne-的范围: 12a mol≤ne-≤56a mol
D.改变温度,产物中KC1O3的最大理论产量为17a mol
解析因12Cl2+e-→Cl-,12Cl2-e-→ClO-,12Cl2-5e-→ClO-3,反应后
c(Cl-)c(ClO-)
=11时,根据得失电子守恒原则得,c(Cl-)=c(ClO-)+5c(ClO-3),解得n(ClO-)c(ClO-3)
=12,A项正确。因Cl2与KOH反应生成KC1、KClO、KClO3,n(KOH)=amol,根据元素守恒原则可知,参加反应的氯气的物质的量等于12a mol,B项正确。若只生成KCl和KClO,由反应Cl2+2KOHKCl+KClO+H2O可知,a mol KOH需要消耗12a mol Cl2,此时转移电子的物质的量为12a mol;若只生成KCl和KClO3,由反应3Cl2+6KOH5KCl+KClO3+3H2O可知,此时转移电子的物质的量为56a mol,C项正确。由反应3Cl2+6KOH5KCl+KClO3+3H2O可知,产物中KClO3的最大理论产量为16a mol,D项错误。故答案为D。
例18 (上海化学卷,节选)硫有多种含氧酸,亚硫酸(H2OSO3)、硫酸(H2OSO4)、焦硫酸(H2OSO4·SO3)、硫代硫酸(H2OS2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。完成下列计算:
(1)焦硫酸(H2OSO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为 mol/L。
(2)若以浓硫酸吸水后生成的H2OSO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。硫化氢体积分数为0.84的混合气体(H2OS、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
解析 (1)445g焦硫酸的物质的量为445g÷178g/mol=2.5mol,其中H2OSO4和SO3的物质的量均为2.5mol,2.5mol SO3与水反应又可生成2.5 mol H2OSO4,则溶液中H2OSO4的物质的量为2.5mol+2.5mol=5.0mol。故硫酸的物质的量浓度c(H2OSO4)=5.0mol÷4.00L=1.25 mol/L。
(2)250g质量分数为98%的硫酸中,H2OSO4的质量为250g×98%=245g,则溶剂水的质量为250g-245g=5g;H2OSO4的物质的量为245g÷98g/mol=2.5mol,2.5mol H2OSO4可以结合水的物质的量为2.5mol,即可以结合水的质量为2.5mol×18g/mol=45g,因此还可以吸收水的质量为m(H2O)= 45g-5g=40g。
(3)设混合气体体积为1体积。由H2OS完全燃烧的反应2H2OS+3O2 2SO2+2H2O可知,0.84体积的H2OS完全燃烧消耗1.26体积O2、生成0.84体积SO2和0.84体积水蒸气,因反应中空气过量77%,因此所需空气的体积为(1.26÷0.21)×177%=10.62体积,则产物气体中SO2的体积分数为 ×100%=7.5%。
故答案为:(1)1.25;(2)40;(3)7.5%(或0.075)
14.以碘的回收为素材,考查实验方案的设计
例19(江苏化学卷)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如图4所示:
图4
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作图5将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约
为2,缓慢通入Cl2,在40℃左右反应(实验装置如图5所示)。
实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO2-3+2IO-3+2H+I2+5SO2-4+H2O。某含碘废
水(pH约为8)中一定存在I2,可能存在I-、IO-3中的一种或两种。
请补充完整检验含碘废水中是否含有I-、IO-3的实验方案:取适
量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不
出碘单质存在; 。(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
解析(1)I2将Na2SO3氧化为Na2SO4,而I2还原为I-(注意H2O也是反应物,且有H+生成),则其离子方程式为SO2-3+I2+H2O SO2-4+2I-+2H+。含碘废液(除H2O外,含有CCl4、I2、I-等)中碘以I-、I2的形式存在,而I2能够溶于CCl4,将I2还原为I-的目的是使溶于CCl4中的碘进入水层。
(2)由题意可知,操作X为分液操作。
(3)实验控制在较低温度下进行,是为了使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步氧化)。锥形瓶中溶液的作用是吸收过量的Cl2,则锥形瓶里盛放的溶液为NaOH溶液。
(4)检验I-,可以利用I-的还原性,先加入淀粉溶液,再加入盐酸酸化,最后滴加FeCl3溶液,若溶液变蓝,则说明废水中含有I-,若溶液不变蓝,则说明废水中不含有I-。检验IO-3,可以利用IO-3的氧化性,先加入淀粉溶液,再加入盐酸酸化,最后滴加Na2SO3溶液,若溶液变蓝,则说明废水中含有IO-3,若溶液不变蓝,则说明废水中不含有IO-3。
故答案为:(1)SO2-3+I2+H2OSO2-4+2I-+2H+,使CCl4中的碘进入水层;(2)分液;(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步氧化),NaOH溶液;(4)从水层取少量溶液,加入1~2mL淀粉溶液,然后加盐酸酸化,再滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另从水层取少量溶液,加入1~2mL淀粉溶液,然后加入盐酸酸化,再滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO-3,若溶液不变蓝,说明废水中不含有IO-3。
(收稿日期:2014-07-15)
- 海洋环境资源3S监测管理系统研究
- 高校数据备份技术的应用与探讨
- 基于Geodatabase的多基态修正模型时空数据库设计
- 从SQL SERVER到MY SQL的数据库迁移研究
- 网络多媒体分析系统的分析与设计
- 基于VR的在线定制家具虚拟场景设计与实现
- 公安基层应用视频侦查技术的现状及展望研究
- 全媒体时代公共图书馆特色资源推广对策研究
- 基于CAN总线的智能小区自动抄表系统
- 计算机图像处理中的ISAR成像手段分析
- 模糊神经网络在网络故障诊断中的应用
- 大数据时代人工智能在计算机网络技术中的应用分析
- 用户识别技术现状分析
- 基于脑电特征纹理与SVM分类的癫痫发作检测研究
- 基于一致性哈希算法的区块链优化模型
- 基于物联网的智能化体育场馆设计
- 基于树莓派的智能小车系统
- 探究带式输送机变频调速智能控制的应用实践
- 基于AT89C52的电动车智能温控手套设计
- 复杂装备远程智能运维服务决策关键技术研究
- 基于深度网络的车辆前后端图像识别方法研究
- 全维知识图谱概述及知识表示框架研究
- 浅谈电子信息技术在人工智能中的应用
- 对图像中条形码进行定位识别的应用
- 基于Node.js的学习平台后端系统设计与实现
- irrigates
- irrigating
- irrigation
- irrigators
- irrigatory
- irritability
- irritable
- irritableness
- irritablenesses
- irritabler
- irritablest
- irritably
- irritancies
- irritancy
- irritant
- irritants
- irritate
- irritated
- irritates
- irritating
- any²
- any¹
- aob
- a once-over
- a once-over lightly
- 枯树发荣
- 枯树开花
- 枯树无果实,空话无价值
- 枯树根上浇水
- 枯树根上浇水——白费劲
- 枯树烂木头
- 枯树烂木头——无用之才(材)
- 枯树生华
- 枯树生枝
- 枯树生花
- 枯树赋
- 枯树逢春
- 枯树遇到春天又恢复了生机
- 枯树重花
- 枯株朽木
- 枯株朽木枯木朽材
- 枯株败枿
- 枯桐
- 枯梗断草
- 枯槁
- 枯槁之士
- 枯槁凋残
- 枯槁凋零
- 枯槁瘦弱
- 枯槁的草木