
当pH相等或相近的强、弱酸等体积混合后,弱酸的电离平衡是否变化,怎样变化的?对此问题笔者从理论和实验两方面对盐酸、醋酸等体积混合后酸度的变化进行探讨。
一、实验部分
1.用250 mL容量瓶分别配制邻苯二甲酸氢钾标准溶液(pH=4.0)和混合磷酸盐标准溶液(pH=6.864)。
2.用250 mL容量瓶分别配制pH=3的醋酸、盐酸待测溶液。
3.用配制的标准溶液标定pH电极。
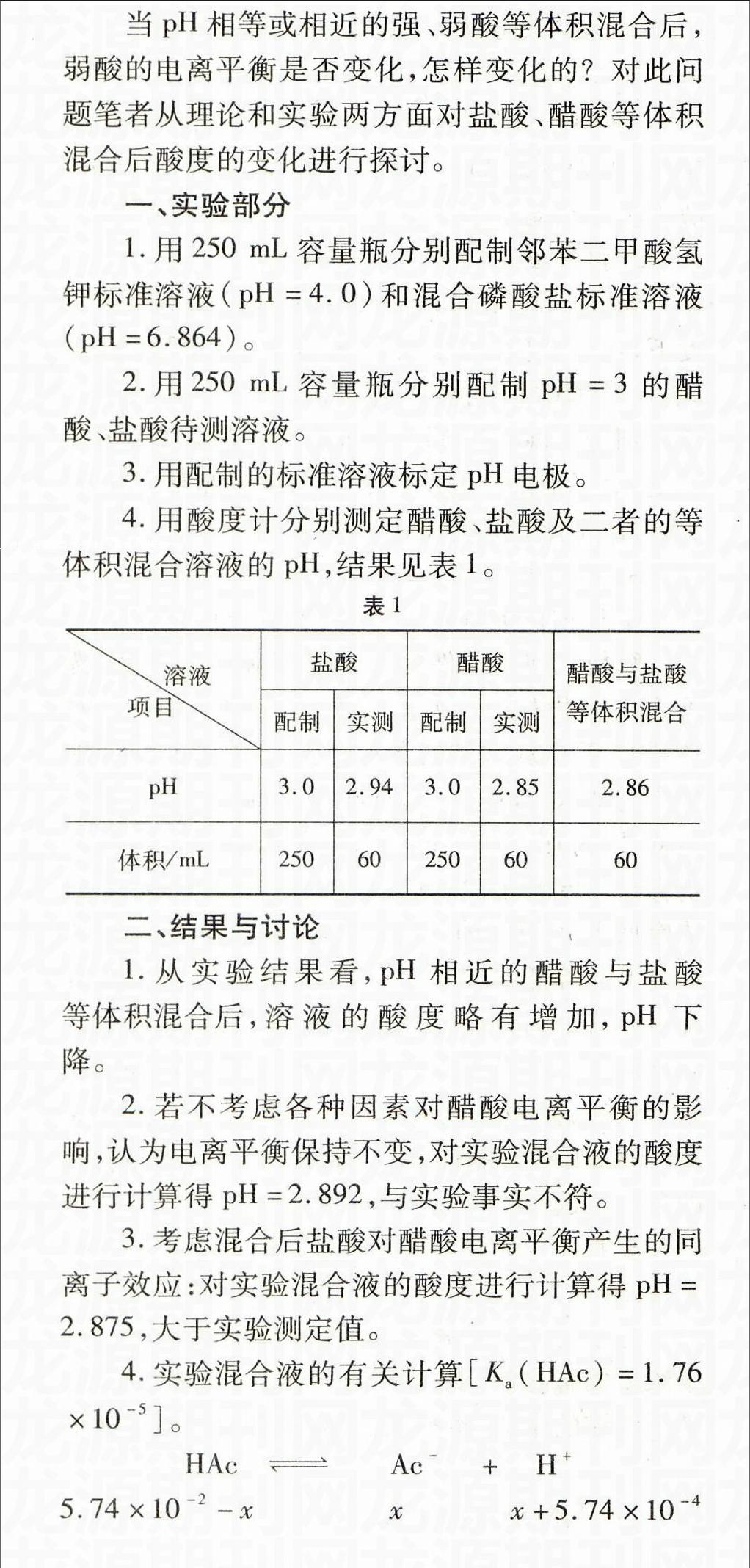
4.用酸度计分别测定醋酸、盐酸及二者的等体积混合溶液的pH,结果见表1。
二、结果与讨论
1.从实验结果看,pH相近的醋酸与盐酸等体积混合后,溶液的酸度略有增加,pH下降。
2.若不考虑各种因素对醋酸电离平衡的影响,认为电离平衡保持不变,对实验混合液的酸度进行计算得pH=2.892,与实验事实不符。
3.考虑混合后盐酸对醋酸电离平衡产生的同离子效应:对实验混合液的酸度进行计算得pH=2.875,大于实验测定值。
5.用上述同样的方法,对pH=3的醋酸与盐酸等体积混合液进行计算,结果pH小于3。
6.对实验结果进行理论分析:
(1)对于pH相等或相近的弱酸与强酸溶液等体积混合后,溶液的pH不能简单的把两种酸的氢离子浓度相加求解,而应同时考虑强酸的加入,产生的同离子效应和盐效应等因素对弱酸电离平衡的影响;从而来分析得出混合液pH的变化。
(2)强酸提供的H+对弱酸电离平衡产生的同离子效应,只有在强酸的c(H+)大于弱酸电离产生的c(H+)的前提下,才能发挥主导作用;在pH相等的情况下,弱酸与强酸等体积混合,强酸的同离子效应对弱酸电离平衡的影响与混合前弱酸自身的电离平衡相同,但体积增加了一倍,使弱酸电离产生的酸根离子浓度降低,与质子结合成弱酸分子的几率下降,加上强酸根离子产生的盐效应,使弱酸的电离度增大,使混合溶液中氢离子净含量增加,导致溶液的pH降低,但同时氢离子仍存在一定程度的同离子效应,混合溶液的pH虽然下降,但幅度不太。
综上所述,笔者认为pH相等或相近的醋酸与盐酸等体积混合后,溶液的酸度略有增加,pH有一定程度的下降。
(收稿日期:2015-03-01)
- 大数据时代高校图书馆嵌入式知识发现情报分析服务模式研究
- 从个性化营销理论看高校图书馆应对服务危机
- 山西省高校图书馆微信公众平台调查与分析
- 微阅读时代高校图书馆的角色定位与阅读服务创新
- 谈高校图书馆的社会化服务
- 地方高校图书馆地方文献工作的实践与思考
- 刍议我国艺术院校图书馆学科服务平台建设
- 媒介融合背景下高校图书馆的数字移动阅读服务模式研究
- “互联网+”背景下高校图书馆学科服务研究
- 高校馆员阅读微推广:主体定位、阅读主旨和媒介选择
- 面向未成年人的外文馆藏建设与推广研究
- 欠发达地区村级综合性文化服务中心可行性研究
- 多校区图书馆统一联合编目数据质量控制探讨
- 基于大数据的图书馆信息模式与个性化服务研究
- 浅谈《中图法》(第5版)儿童文学类目的设置
- 图书馆采编业务外包的质量控制
- 民国时期徽州地区图书馆事业概述
- 应用型本科院校学生纸质图书利用调查分析
- 网络环境下图书馆电子图书数字版权保护的方法及策略研究
- 新常态下文化事业单位专业技术人员继续教育探究
- 基于“互联网+”的义务馆员培养模式研究
- 美、英、日、中四国图书馆员职业伦理规范之比较
- “互联网+”智慧图书馆运行与发展策略
- 读书节与大学生的素质教育
- 图书馆文创产品开发工作中对经营创收认识的误区
- adventuring
- adventurous
- adventurously
- adventurousness
- adventurousnesses
- adverb
- adverbial
- adverbless
- adverbs
- adversaries
- adversariness
- adversarinesses
- adversary
- adverse
- adverse balance
- adversebalance
- adversed
- adversely
- adverseness
- adversenesses
- adverser
- adversest
- adverse trade balance
- adversetradebalance
- adversing
- 椎杀
- 椎牛
- 椎牛享士
- 椎牛发冢
- 椎牛酾酒
- 椎牛飨士
- 椎破
- 椎秦
- 椎秦报韩
- 椎肤剥髓
- 椎胸泣血
- 椎胸跌足
- 椎胸顿足
- 椎膺顿足
- 椎讷
- 椎轮
- 椎轮大辂
- 椎钝
- 椎锋陷阵
- 椎锋陷陈
- 椎间盘
- 椎间盘突出症
- 椎陋
- 椎飞博浪
- 椎骨