李艳

摘要: 针对次氯酸分解实验的不足之处,利用溶解氧传感器从催化剂的选择、催化剂用量、氯水pH和氯水存放时间等角度探究次氯酸催化分解反应的影响因素,改进和优化了次氯酸催化分解的实验方法及实验条件,提高了次氯酸分解实验的课堂演示教学效果。
关键词: 次氯酸; 钴氧化物; 催化分解; 溶解氧传感器; 实验探究
文章编号: 1005-6629(2020)02-0064-05
中图分类号: G633.8
文献标识码: B
1? 研究背景
次氯酸是一種重要的无机酸,高中化学中主要介绍它的弱酸性、不稳定性和强氧化性,其中关于次氯酸不稳定分解的反应,现行的高中化学教材均没有相关的演示实验。这主要是因为次氯酸分解速率比较慢,在短时间内很难观察到明显的实验现象,不适合演示。目前关于次氯酸分解实验的改进主要集中在两个方面: 一是从光源及次氯酸浓度角度作改进以加快次氯酸分解反应速率[1,2];二是改进实验装置方便收集氧气[3,4]。但这些改进实验仍存在一些问题,主要如下:
(1) 次氯酸分解产生的氧气都是用带火星的木条进行检验,需要收集一定量的氧气,因此对实验装置要求高,不够简便。
(2) 次氯酸光照分解实验对光源要求高,如遇阴雨天,光照不充足,很难进行实验。同时,这些改进实验中为了收集到一定量的氧气,常常要使用较多的氯水,不够节约试剂,也造成一定的污染。
(3) 这些改进实验的实验时间仍要5~10分钟,时间长,不利于在课堂上进行演示。
因此,我们意在进一步改进次氯酸分解实验,以期能简便、快捷地进行实验,使课堂演示该实验成为可能。
2? 实验部分
2.1? 实验设计思路
北师大、华中师大等合编的《无机化学》中提到次氯酸在光照或金属化合物催化下能分解产生氧气[5]。因此,我们设想用催化剂来加快次氯酸分解反应的速率。查阅文献发现,Fe、 Co、 Ni、 Mn、 Cu等金属的氧化物可以催化次氯酸钠的分解[6],我们猜测这些金属氧化物或许也能催化分解次氯酸。
溶解氧传感器是一种测量氧气在水中的溶解量的传感设备,可以实时检测水溶液中氧气浓度变化情况,非常灵敏、方便、快捷。因此,我们利用溶解氧传感器检测次氯酸分解产生的氧气。
2.2? 实验仪器和药品
实验仪器: 溶解氧传感器、温度传感器和pH传感器及配套设备、小烧杯、电子天平、蒸发皿、抽滤装置、玻璃棒、酒精灯、量筒
实验药品: 新制饱和氯水、放置1天的氯水、放置3天的氯水、NaOH固体、CoCl2·6H2O、 NiO、 CuO、 MnO2、 Fe3O4、 36.5%浓盐酸、10% NaOH溶液、稀盐酸(pH=1.5)
2.3? 实验装置
实验装置见图1。
图1? 实验装置图
2.4? 实验探究
2.4.1? 催化剂的选择
除钴的氧化物外,其余金属氧化物实验室均有现存药品,钴的氧化物采用下述实验1的方法进行制备。
实验1? 用天平称取约5g CoCl2·6H2O,用少量蒸馏水溶解,再加入20mL 10% NaOH溶液,搅拌,抽滤,水洗,将抽滤得到的固体物质放在蒸发皿中灼烧至全部转化为黑色粉末,即得到钴的氧化物(Co2O3和Co3O4混合物)[7]。
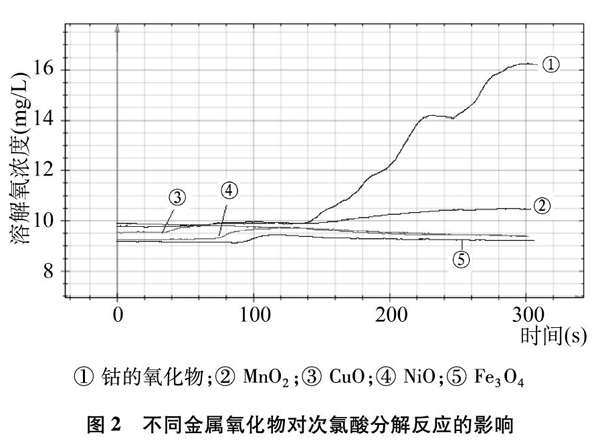
实验2? 取15mL新制饱和氯水于小烧杯中,按图1连接好装置,打开计算机中WCYdislab软件,点击“开始”按钮,再加入0.1g不同金属氧化物进行实验,得到氯水中溶解氧变化曲线,如图2所示。
① 钴的氧化物;② MnO2;③ CuO;④ NiO;⑤ Fe3O4
图2? 不同金属氧化物对次氯酸分解反应的影响
图2中几条曲线开始阶段溶解氧的变化是加入金属氧化物后造成溶液的扰动而引起的变化,可以忽略(下同)。从整个实验过程中氯水中溶解氧含量的变化来看,NiO、 CuO、 Fe3O4几乎不能催化次氯酸分解,MnO2对次氯酸分解反应略有催化作用,而钴的氧化物的催化效果最好。因此,我们选用钴的氧化物作次氯酸分解的催化剂。
2.4.2? 催化剂用量的选择
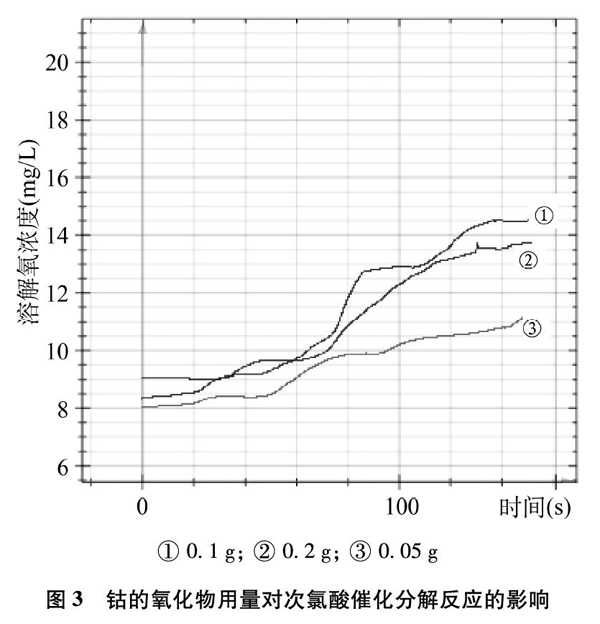
实验3? 各取15mL新制饱和氯水于小烧杯中,分别向氯水中加入不同用量的钴的氧化物进行实验,得到溶解氧含量变化曲线,如图3所示。
① 0.1g; ② 0.2g; ③ 0.05g
图3? 钴的氧化物用量对次氯酸催化分解反应的影响
由图3可知,当钴氧化物用量为0.05g时,氯水中溶解氧含量变化最小,变化趋势最缓和,说明次氯酸催化分解反应速率最慢;当催化剂用量增至0.1g时,次氯酸催化分解反应速率加快;当催化剂用量增至0.2g时,分解反应速率与0.1g时相当。因此,我们确定次氯酸催化分解反应合适的钴的氧化物用量为0.1g。
2.4.3? 氯水pH的影响
实验4? 分别取少量新制饱和氯水(pH=1.5),向其中加入少量NaOH固体或浓盐酸,用pH传感器监测氯水的pH,分别制得pH为0.5、 5.4、 6.4、 7.8的氯水。
实验5? 分别取15mL不同pH的氯水于小烧杯中,各加入0.1g钴的氧化物进行实验,得到溶解氧含量变化曲线,如图4所示。
由图4中5条曲线斜率可知,次氯酸分解反应速率快慢顺序为: ②≈③>①>④>⑤。这是因为5条曲线代表的次氯酸浓度大小顺序为②≈③>①>④>⑤,次氯酸浓度越大,分解反应速率越快。所以,通过调节氯水
① pH=1.5; ② pH=5.4; ③ pH=6.4; ④ pH=7.8; ⑤ pH=0.5
图4? 氯水pH对次氯酸催化分解反应的影响
的pH可以改变氯水中次氯酸浓度,从而引起次氯酸催化分解反应速率的改变。
2.4.4? 氯水存放时间的影响
实验6? 分别取15mL不同存放时间的氯水于小烧杯中,各加入0.1g钴的氧化物进行实验,得到溶解氧含量变化曲线,如图5所示。
由图5曲线可知,氯水不避光存放时间越久,次氯酸催化分解反应速率越慢。这是因为氯水在放置过程中次氯酸在不断地缓慢发生分解,放置时间越久,次氯酸浓度越小,催化分解反应速率越慢。
① 新制饱和氯水; ② 放置1天的氯水; ③ 放置3天的氯水
图5? 氯水存放时间对次氯酸催化分解反应的影响
2.4.5? 光照与催化条件下次氯酸分解反应对比
实验7? 各取15mL新制饱和氯水于小烧杯中,其中一个不加催化剂放置在太阳光下,另一个加入0.1g钴的氧化物放置在阴凉处进行实验,得到两种情况下溶解氧浓度变化曲线,如图6所示。
① 加0.1g钴的氧化物催化剂,不光照; ② 光照,不加催化剂
图6? 光照与催化条件下次氯酸分解反应对比
由图6可知,在催化剂存在下氯水中溶解氧含量变化比光照下更快,因此,次氯酸在催化条件下的分解反应速率比光照下更快。
2.4.6? 次氯酸催化分解过程中温度和pH的变化
实验8? 取15mL新制饱和氯水于小烧杯中,同时连接溶解氧、温度、pH传感器,再加入0.1g钴的氧化物进行实验,得到溶解氧含量、温度、pH变化情况,如图7所示。
图7? 次氯酸催化分解过程中溶解氧、温度和pH变化
反应过程中,溶液中溶解氧含量在加入催化剂后持续增加,而温度和pH基本不变。这是因为整个反应过程中发生分解的次氯酸很少,溶解氧传感器灵敏度高,可以检测到氧气浓度的变化,但是温度和pH传感器的灵敏度不足以检测这些微量的变化。假设反应过程中溶解氧改变量为8.0mg·L-1,相关计算如下:
15mL氯水中增加的氧气量为: n(O2)=8.0×10-3×15×10-332=3.8×10-6mol
2HClO催化剂O2? +? 2HCl
1mol2mol
3.8×10-67.6×10-6
c新增(H+)=7.6×10-615×10-3=5.1×10-4mol·L-1,与原溶液中c原(H+)=10-1.5=0.032mol·L-1相比,氢离子浓度增加得很少,可以忽略,因此反应过程中pH基本不变,同理,温度亦是如此。
2.4.7? 钴的氧化物是催化剂的证据
如果钴的氧化物不是次氯酸分解的催化剂,我们猜想氯水中加入钴的氧化物后引起溶解氧含量变化可能是这些原因: 原因一,钴的氧化物在酸性溶液中反应产生氧气,2Co2O3+8H+4Co2++O2↑+4H2O;原因二,钴的氧化物与盐酸反应,Co2O3+2Cl-+6H+2Co2++Cl2↑+3H2O, Co3O4+2Cl-+8H+3Co2++Cl2↑+4H2O[8],盐酸浓度降低,使得Cl2+H2OHCl+HClO平衡正移,增大了次氯酸浓度,从而加快次氯酸分解产生氧气的速率;原因三,钴的氧化物直接与次氯酸反应产生氧气。我们通过设置以下对比实验进行探究。
实验9? 取15mL稀盐酸(pH=1.5)于小烧杯中,加入0.1g钴氧化物进行实验,得到溶解氧浓度变化情况如图8。
图8? 稀盐酸中加入0.1g钴的氧化物后溶解氧浓度变化
表1? 相同pH的盐酸和氯水中各加入0.1g
钴的氧化物后实验现象对比
实验样品反应后溶液颜色气泡情况溶解氧含量变化值
稀盐酸(pH=1.5)无色无气泡产生0
新制氯水(pH=1.5)无色较多气泡产生7~8mg·L-1
由图8可知,稀盐酸中加入0.1g钴的氧化物,溶解氧没有变化,说明新制氯水中加入钴的氧化物后溶解氧含量的增大不是钴的氧化物在酸性溶液中反應产生的氧气,上述原因一不成立。由表1知,稀盐酸中加入钴的氧化物,没有气泡产生,盐酸溶液颜色无变化,说明钴的氧化物不与稀盐酸反应,原因二也不成立。新制氯水中加入钴的氧化物反应一段时间后,过滤除去钴的氧化物,所得滤液颜色仍是无色,说明无Co2+的产生,原因三也不成立。因此,我们推断钴的氧化物是次氯酸分解的催化剂。
2.5? 实验结论及可能的反应机理
2.5.1? 实验结论
少量钴的氧化物可以很好地催化次氯酸分解产生氧气,当氯水中次氯酸浓度增大时,分解反应速率加快,且在钴的氧化物催化下次氯酸的分解速率比光照条件下更快。
2.5.2? 可能的反应机理
根据文献报道,我们推测钴的氧化物催化下的次氯酸分解反应按如下反应机理进行[9]:
Co2O3+HClO2CoO+O2↑+HCl(1)
2CoO+HClOCo2O3+HCl(2)
次氯酸的氧化能力很强,在新制氯水中次氯酸的浓度也尚可,因此我们认为其可以氧化CoO到Co2O3。钴的氧化物中的Co3O4或许也能像上述(1)、 (2)反应式一样参与次氯酸的分解反应,具体的反应机理有待进一步研究。
3? 实验研究的意义
根据上述研究,我们设计的次氯酸分解实验为: 取15mL新制饱和氯水于小烧杯中,连接溶解氧传感器,再加入0.1g钴的氧化物进行实验,观察实验现象。该次氯酸分解实验具有以下优点:
(1) 简化实验装置。我们设计的次氯酸分解实验只需要一个小烧杯、溶解氧传感器及配套数字化实验设备,不需要搭建复杂的装置,可以方便地进行实验。
(2) 简化实验条件。我们设计的次氯酸分解实验不需要光照,摆脱了光对次氯酸分解实验的限制,可以随时进行实验。同时,在我们设计的次氯酸分解实验中,只要不是放置时间很久的氯水,都能实现次氯酸分解实验,方便氯水的制取。而且,用我们的方法进行次氯酸分解实验,氯水用量大大减少,节约了试剂。
(3) 利用传感器技术,检验氧气更为方便,实验时间也更短,整个实验操作的过程只需要2~3分钟,十分有利于进行课堂演示实验。
参考文献:
[1]吴民生. 光照氯水实验新设计[J]. 化学教学, 2014, (8): 52~54.
[2][3]陆燕海, 嵇月萍. 氯水光解实验的改进[J]. 化学教学, 2012, (7): 47~48.
[4]马喜军. 对次氯酸分解演示实验的微型环保设计[J]. 教学仪器与实验, 2014, (10): 46~47.
[5][7]北京师范大学, 华中师范大学, 南京师范大学. 无机化学(下)[M]. 北京: 高等教育出版社, 2003: 476~779.
[6][9]邵黎歌, 陈卿. 次氯酸钠的分解特性及提高其稳定性能的途径[J]. 氯碱工业, 1997, (4): 21~24.
[8]蔡少华, 黄坤耀, 张玉容. 元素无机化学[M]. 广州: 中山大学出版社, 1998: 247~248.
- 高职院校Visual FoxPro课程教学方法探讨
- 基于WebQuest的高职计算机基础课程教学模式探究
- 微波技术在水污染监测中的应用
- 包装机械设计制造中计算机仿真技术的运用
- AES和RSA混合加密技术在网络数据传输中的应用
- 三网融合背景下数字电视终端技术应用及其发展趋势研究
- 数据挖掘技术在电厂经济性分析系统中的应用Q
- 机器视觉技术发展及其工业应用
- 信息时代数控铣削的刀具路径优化技术
- 基于物联网技术的轿车3G/4G远程监控系统研究
- 基于单片机的多功能数字万年历设计
- 移动机会网络路由问题研究
- GPRS无线热力监控系统解决方案
- 近距离无线信息技术在信息传输中的运用
- 军队无线电台组网应用与设计
- EOC云媒体在雨花广电中的应用分析
- 基于数字电视传输的应急广播系统建设
- 低功耗射频唤醒无线传感器网络设计
- “紫蜂”(ZigBee)通信技术分析
- 短距离无线网络通信技术及其应用分析
- 基于改进AHP的多机协同多目标攻击威胁评估算法分析
- 物联网分布式数据库系统优化研究
- 基于图像处理的空车位检测预测系统设计
- YL—335B型自动生产线设备故障分析
- 一种适应于智能电网的智能电表设计
- barge²
- barge¹
- barging
- bar graph
- bargraph
- bar graphs
- baring
- barish
- barista
- baritonal
- baritone
- baritones
- barium
- bariums
- bark
- bark-at-the-moon
- barked
- barken
- barkey
- barking
- barks
- bark-up-the-wrong-tree
- bark²
- bark¹
- barless
- 较短的分别
- 较短的时日
- 较短絜长
- 较短论长
- 较短量长
- 较稀的粥
- 较竞
- 较约
- 较细的丝弦
- 较老年人
- 较胜
- 较胜一筹
- 较胜争强
- 较能
- 较艺
- 较若列眉
- 较若画一
- 较著
- 较要
- 较覆
- 较订
- 较论
- 较证
- 较证 教证
- 较试