杨卫梅 刘刚 欧全宏 安冉 李建美 符致秋 时有明
摘?要?利用傅里葉变换红外光谱(FTIR)结合曲线拟合分析(Curve-fitting analysis)及聚类分析(HCA)研究自然老化豆类种子。结果表明,豆类种子的红外光谱主要由蛋白质及碳水化合物的吸收峰组成,不同老化时间种子的原始光谱整体特征基本相似,但几个吸收强度比随老化时间的增加均呈下降趋势。对原始光谱酰胺Ⅰ带1700~1600 cm1范围和多糖1180~980 cm1范围进行曲线拟合分析,结果表明,不同老化时间种子的子峰位置和面积比差异较大,老化期间蛋白质二级结构中β-折叠、无序结构、α-螺旋和β-转角成分及多糖中CO、CC和COH成分存在明显差异。将1800~800 cm1范围的二阶导数光谱进行聚类分析,聚类准确率达到100%,聚类分析能有效地区分不同老化时间的种子。本研究结果表明,FTIR光谱结合曲线拟合与聚类分析可以快速、有效地区分自然老化豆类种子。
关键词?豆类种子; 自然老化; 红外光谱; 曲线拟合; 聚类分析
1?引 言
种子是重要的农业生产资料,种子的质量直接影响粮食产量和品质。种子老化是种子生活力逐渐减弱以至完全丧失的过程,在储藏过程中,种子发生膜脂过氧化、酶失活、细胞结构破坏、DNA和RNA降解等质变,导致种子发芽率降低,活力丧失,严重影响粮食生产及食品品质[1,2]。因此,种子老化的鉴定对农业生产及食品安全都具有重要意义。
目前,已有多种鉴别种子老化的方法[3~11],但均具有各自的不足。其中,根据色泽、气味等的鉴定方法具有较强的主观性。利用发芽率、发芽势和电导率测定种子活力,如白亚利等[3]研究发现新麦草种子老化过程的发芽势、发芽率逐渐下降,电导率上升,此方法耗时费力。惠文森等[4]利用四唑法和标准法检测苏丹草种子活力,发现活力和发芽率之间呈现显著的正相关,方法方便迅速,但精确度差,且需破坏样品。分子生物化学鉴别法准确可靠,但操作繁琐且损坏样品成分和结构[6]。Yin等[8]利用高效液相色谱法、抗氧化酶活性及定量逆转录聚合酶链式反应研究陈化水稻种子,发现过氧化氢酶和抗坏血酸表达下降与活性氧的积累有关,导致种子丧失活力; Gao等[9]利用二维电泳和矩阵辅助基质辅助激光解吸/电离时间飞行质谱法研究发现,杂交水稻种子老化过程中谷胱甘肽相关蛋白发生不同程度的变化; Li等[10]采用激光扫描共聚焦显微镜和蛋白质组学方法研究榆树种子,发现种子衰老过程中线粒体代谢降低。这些方法测量准确,但需要对样品进行预处理,成本高。卢伟等[11]利用荧光光谱检测水稻种子的发芽率,具有高的精确度。种子活力是种子品质的综合性指标,仅凭单一活力测定指标难以准确全面判定其总活力水平或健壮度。 因此,有必要提供一种快捷的全面、综合的分析技术。
高光谱成像技术是一种结合光谱和图像技术的无损检测技术,高光谱成像技术(HIS)和近红外光谱(NIR)已被用于农作物种子活力的检验研究。吴小芬等[12]利用高光谱成像技术对种子活力进行快速无损检测,建立的判别分析模型可准确区分老化和未老化种子,发现不同老化品种水稻存在差异。李毅念等[13]利用近红外光谱技术测试杂交水稻种子的发芽率,建立偏最小二乘法回归模型鉴别不同老化时间水稻种子的发芽率。罗丽萍等[14]使用近红外光谱技术检测人工老化的白菜和芥菜种子,并建立了预测模型,可准确地预测种子活力; 李欢欢等[15]采用光声光谱技术结合最小二乘支持向量机回归对高温高湿人工老化的水稻种子活力进行鉴别研究,通过协方差和主成分分析对光谱进行降维,建立偏最小二乘回归和反向传播神经网络预测模型,具有较好的预测精度。Ambrose等[16]利用傅立叶变换近红外和拉曼光谱方法比较评估玉米种子的生存能力,利用主成分分析和偏最小二乘判别分析进行预测评估,准确率可达到100%。傅里叶变换红外光谱(FTIR)具有指纹特征性,反映官能团的振动模式,是一种直接、快速的光谱鉴别方法[17]。Chen等[18]利用FTIR结合二维相关红外光谱(2D-IR)技术研究中国第一艘宇宙飞船携带的大青种子飞行前后的化学变化,得出飞行前后两种光谱在500~1200 cm1范围内的峰位相差7 cm1,且蛋白质含量在飞行后发生变化。Lu等[19]利用FTIR和光声光谱(PAS)对不同品种的油菜籽进行分类,采用主成分分析(PCA)研究分离情况,利用偏最小二乘法分析(PLS-DA)和支持向量机(SVM)进行分类,发现SVM模型在标定和预测集上实现了较好分类,并优于PLS-DA。
豆类种子含有丰富的蛋白质及碳水化合物,本研究利用FTIR谱技术,结合曲线拟合及聚类分析研究不同老化时间的豆类种子,探讨豆类种子老化的光谱变化规律,以期为豆类种子老化以及相关农业生产和粮食储存加工提供参考。
2?实验部分
2.1?仪器设备
Frontier型傅里叶变换红外光谱仪(美国Perkin Elmer公司),配备DTGS探测器,测定范围4000~400 cm1,累计扫描32次(扫描时自动扣除H2O和CO2的干扰),分辨率为4 cm1,采用YP-2压片机进行压片。
2.2?样品检测及光谱预处理
选用云南省陆良县生产的蚕豆、红豆和黄豆种子进行实验,所有样品均在2013年11月收集并在室温下储藏,每年11月对样品进行测量。3种样品每次各测试10个样品,采用KBr压片法测试光谱。将样品放入玛瑙研钵中磨细,再加入适量的KBr搅磨均匀,压片后测试光谱。光谱采集使用Spectum 10软件,使用Omnic 8.2红外光谱处理软件对所采集的原始光谱进行自动基线校正、平滑、纵坐标归一化及平均谱图预处理; 利用Origin8.6软件对10次测量的平均红外光谱的原始光谱及曲线拟合处理; 利用SPSS20.0 统计软件进行聚类分析。
3?结果与讨论
3.1?原始红外光谱分析
自然老化的蚕豆、红豆和黄豆种子的平均原始红外光谱(图1(蚕豆)、图2(红豆)、图3(黄豆))中的典型吸收峰为:在3300 cm1附近为蛋白质的NH和多糖的OH的伸缩振动吸收峰; 在2926和2855 cm1附近分别为亚甲基的反对称和对称伸缩振动[20]; 在1649、1541和1243 cm1附近的峰分别为蛋白质的酰胺Ⅰ、Ⅱ、Ⅲ带的特征吸收峰[17]; 在1152、1075和1055 cm1附近的吸收峰为糖类分子中的CO伸缩振动[21]; 在900 cm1以下是碳水化合物OH的弯曲振动及糖环振动的吸收峰[22]; 3种豆类种子的主要成分为蛋白质和碳水化合物。不同老化时间种子的原始光谱整体特征基本相似,但几个特征峰吸收强度比存在一定差异,蚕豆吸收峰强度比A1649/A2926从收获当年至老化第五年分别为2.373、1.972、1.692、1.830和1.762,A1649/A1538相应比值分别为1.792、1.684、1.570、1.647和0.942,A1649/A1240分别为3.401、3.049、2.71、2.985和2.793; 红豆吸收峰强度比A1652/A2931从收获当年至老化第五年分别为2.070、2.068、2.047、1.936、和1.838; A1652/A1050相应比值分别为2.012、1.996、1.853、1.667和1.431,A1652/A1244分别为3.521、3.368、3.152、2.732和2.786; 黄豆吸收峰强度比A1652/A2927从收获当年至老化第五年分别为1.588、1.233、1.112、1.222和1.224,A1057/A2927相应比值分别为0.928、0.538、0.559、0.565和0.615。老化过程中几个吸收峰强度比总体趋势下降。
3.2?曲线拟合分析
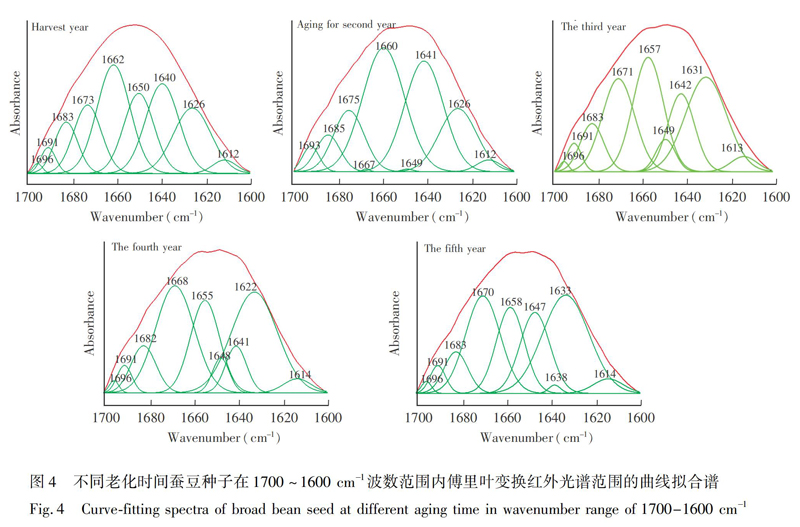
豆类原始红外光谱分析中,不同老化时间豆类种子在蛋白质和多糖区域存在明显差异,选用蛋白质酰胺 I 带1700~1600 cm1和多糖1180~980 cm1范圍进行曲线拟合分析,为了分析种子老化过程中蛋白质二级结构和糖类区域中相对含量变化[23],3种豆类种子老化过程中酰胺 I 带出现9个子峰(位置见图4以及电子版文后支持信息图S1和S2),多糖范围出现7个子峰(电子版文后支持信息图S3~S5),其中1600~1640 cm1归属为β-折叠[22],1640~1650 cm1为无序结构[23],1650~1660 cm1 为α-螺旋[24],1660~1700 cm1归属为β-转角[25],990和1080 cm1附近为CO伸缩振动[26],1020和1050 cm1附近为CC伸缩振动[27],1100和1120 cm1附近为COH伸缩振动[28],1160 cm1附近为CC和CO的伸缩振动[28]。 酰胺 I 带和多糖的面积百分比(10次测量光谱)见表1和表2。
由表1可知,不同老化年份豆类的蛋白质二级结构面积百分比差异明显,对于β-折叠,蚕豆和黄豆种子从收获当年到老化第三年后下降,而红豆种子上升,且3种样品随老化时间增加总体呈上升趋势。无序结构成分,3种样品在老化一年后都增加,但3种样品随老化时间增加呈下降趋势。对于α-螺旋,3种样品随老化时间增加也呈现下降趋势。对于β-转角,除了红豆在老化第二年后上升,而3种样品随老化时间增加总体趋势下降。结果表明,随着老化时间增加,蛋白质酰胺I带的β-折叠、无序结构、α-螺旋和β-转角区域的面积百分比均发生下降趋势。
在多糖1180~980 cm1范围,不同老化年份的面积百分比(表2)也有明显差异,蚕豆种子所有子峰的面积百分比随老化时间增加呈下降趋势; 红豆种子在995、1018和1099 cm1附近的面积百分比随着老化时间增加总体呈下降趋势; 黄豆种子在992和1050 cm1附近的面积百分比在第四年出现下降趋势,但在1079、1090和1160 cm1附近出现上升趋势。因此,3种豆类种子在老化过程中,多糖的CO、CC和COH所对应峰的面积百分比发生了明显变化。曲线拟合结果表明,种子老化过程中蛋白质β-折叠、无序结构、α-螺旋成分和β-转角相对成分以及多糖中CO、CC和COH所对应面积百分比存在差异。
3.3?聚类分析
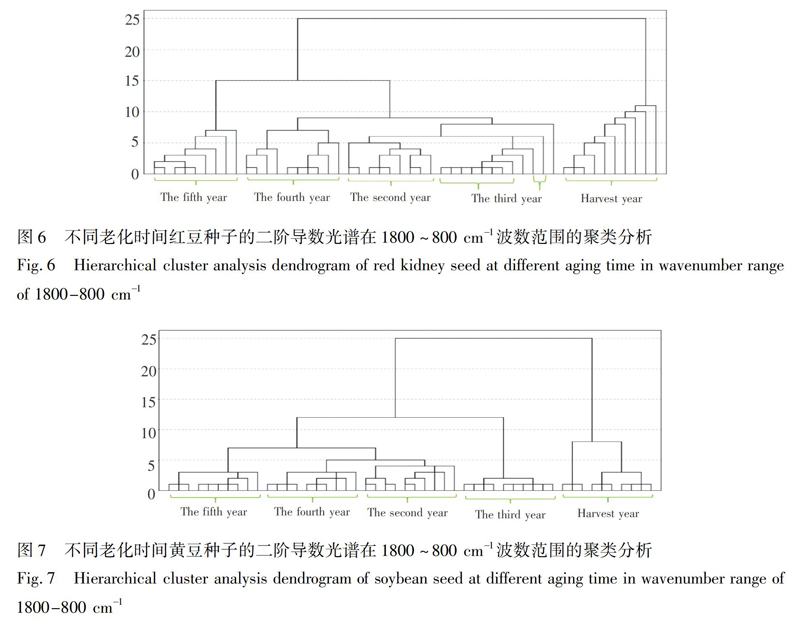
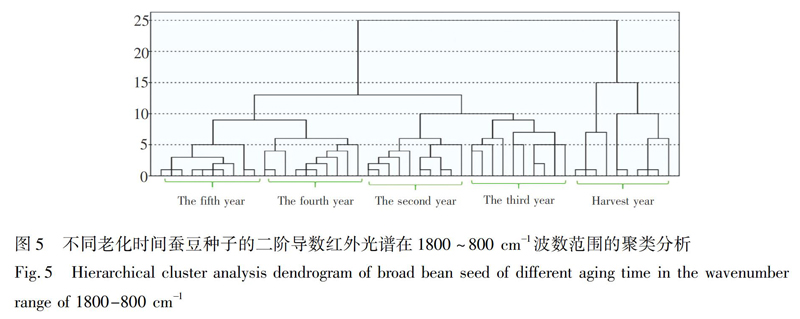
系统聚类法是一种无监督模式识别分类法,根据研究对象的特征在数值上存在的相似性程度,将其聚合为不同点群的一种多元统计分析方法,距离越近越易聚在一起,形成一类物质[29]。为了准确鉴别出不同老化时间的种子,利用SPSS20.0软件并采用欧氏距离对不同老化时间的50个样品在1800~800 cm1波数范围的二阶导数光谱进行聚类分析。
蚕豆种子的聚类结果(图5)表明,在距离5左右,老化第五年的种子聚为一类; 在距离6左右,老化第二年和第四年种子各自聚为一类; 在距离9左右,第三年种子聚为一类; 在距离15左右,收获当年种子聚为一类; 在距离9左右,第四年和第五年种子聚为一类; 在距离10左右,第二年和第三年种子聚为一类; 在距离25左右,所有年份种子聚为一类。红豆种子(图6),在距离5左右,老化第二年和第三年种子各自聚为一类; 在距离7左右,第四年和第五年种子各自聚为一类; 在距离11左右,收获当年种子聚为一类; 在距离15左右,老化第二至第五年种子聚为一类; 除了两个样品聚类有误外,在距离25左右,所有年份种子聚为一类。黄豆种子(图7),在距离2左右,老化第四年种子聚为一类; 在距离3左右,第三年和第五年种子各自聚为一类; 在距离4左右,第二年种子聚为一类; 在距离8左右,收获当年种子聚为一类; 在距离12左右,老化第二至第五年种子聚为一类; 在距离25左右,所有年份种子聚为一类。3种豆类种子的聚类准确率都达到100%,即采用聚类分析,可以区分不同老化时间的豆类种子。
4?结 论
利用红外光谱结合曲线拟合可快速地对豆类种子自然老化过程进行研究,结果表明,不同老化时间种子的吸收峰强度比随老化时间延长呈下降趋势。进一步分析发现,不同老化时间种子的蛋白质二级结构酰胺Ⅰ带和多糖特征峰吸收区曲线拟合处理结果存在差异,各子峰出现的位置和面积百分比也存在较大差异。老化期间蛋白质二级结构中β-折叠、无序结构、α-螺旋和β-转角成分及多糖中CO、CC和COH存在明显差异。3种豆类种子在1800~800 cm1波数范围内的二阶导数聚类分析准确率达到100%。本研究结果表明,傅里叶变换红外光谱结合曲线拟合及聚类分析可快速无损地鉴别研究不同老化时间豆类种子。
References
1?Moncaleano-Escandon J,Silva B C F,Silva S R S,Granja J A A,Alves M C J L,Pompelli M F. Indust. Crops Products,2013,44(1): 684-690
2?Dong X Y,Fan S X,Liu J,Wang Q,Li M R,Jiang X. J. Integr. Agric.,2017,16(5): 1084-1092
3?BAI Ya-Li,YUN Lan,SONG Bai-Zhi. Seeds,2015,34(8): 33-38
白亚利,云 岚,宋百枝. 种子,2015,34(8): 33-38
4?HUI Wen-Sen,WANG Kang-Ying. Grass and Animal Husbandry,2009,(5): 5-6
惠文森,王康英.?草业与畜牧,2009,(5): 5-6
5?WANG Xin-Xin,LU Ping,LI Hong-Yan,HUANG Fan,LI Jun. Seeds,2016,35(5): 13-17
王欣欣,盧 萍,李鸿雁,黄 帆,李 俊.?种子,2016,35(5): 13-17
6?Daniel I O,Adabale O W,Adeboye K A,Aladele E S,Oduoye O T,Adetumbi J A. Nigerian J. Genetics,2014,28(2):?29-33
7?YU Zheng,FANG Fang,PENG Zuo-Deng,YAN Lei. Seeds,2012,31(8):?52-55
于 征,方 芳,彭祚登,闫 磊.?种子,2012,31(8):?52-55
8?Yin G,Xin X,Song C,Chen X,Zhang J,Wu S. Plant Physiol. Biochem.,2014,80: 1-9
9?Gao J,Fu H,Zhou X,Chen Z,Luo Y,Cui B. Plant Physiol. Biochem.,2016,103: 31-44
10?Li Y,Wang Y,Xue H,Hugh W,Xiao F W. Plant Physiol. Biochem.,2017,114: 72-87
11?LU Wei,GUO Yang-Ming,DAI De-Jian,ZHANG Cheng-Yu,WANG Xin-Yu. Spectroscopy and Spectral Analysis,2018,38(4): 1303-1312
卢 伟,郭阳鸣,代德建,张澄宇,王新宇.?光谱学与光谱分析,2018,38(4): 1303-1312
12?WU Xiao-Fen,ZHAO Guang-Wu,QI Heng-Nian. Anhui Agricultural Sciences,2017,45(29): 12-14
吴小芬,赵光武,祁亨年.?安徽农业科学,2017,45(29): 12-14
13?LI Yi-Nian,JIANG Dan,LIU Ying-Ying,DING Wei-Min,DING Qi-Shuo,ZHA Liang-Yu. Spectroscopy and Spectral Analysis,2014,34(6): 1528-1532
李毅念,姜 丹,刘璎瑛,丁为民,丁启朔,查良玉.?光谱学与光谱分析,2014,34(6): 1528-1532
14?LUO Li-Ping,LIU Xing-Xing,YIN Qin,DU Shang-Guang,HUANG Xue-Yong,LUO Huo-Lin. Journal of Nanchang University,2017,41(1):?66-71
罗丽萍,刘星星,殷 勤,杜尚广,黄学勇,罗火林.?南昌大学学报(理科版),2017,41(1):?66-71
15?LI Huan-Huan,LU Wei,DU Chang-Wen,MA Fei,LUO Hui. Chinese Laser,2015,(11):?270-279
李欢欢,卢 伟,杜昌文,马 菲,罗 慧.?中国激光,2015,(11): 270-279
16?Ambrose A,Lohumi S,Lee W H,Cho B K. Sens. Actuators B,2016,224: 500-506
17?Zhang F D,Xu C H,Li M Y,Huang A M,Sun S Q. J. Mol. Struct.,2014,1069:?89-95
18?Chen X,Keong C Y,Mei X,Lan J. Spectrochim. Acta A,2014,124(8):?528-534
19?Lu Y,Du C,Yu C,Zhou J. Comput. Electron. Agric.,2014,107(3): 58-63
20?Holse M,Larsen F H,Hansen A,Engelsen S B. Food Res. Int.,2011,44(1): 373-384
21?Plans M,Simó J,Casaas F,Sabat J,Rodriguez-Saona L. Food Res. Int.,2013,54(2): 1643-1651
22?LI Hui-Mei,LIU Gang,MA Dian-Xu,OU Quan-Hong,YU Hai-Chao,LIU Yan. Optical and Photoelectric Technology,2015,13(5):?58-63
李会梅,刘 刚,马殿旭,欧全宏,于海超,刘 艳.?光学与光电技术,2015,13(5):?58-63
23?LI Hui-Mei,LIU Gang,MA Dian-Xu,OU Quan-Hong,YU Hai-Chao,LIU Yan. China Agricultural Science Bulletin,2015,31(32):?81-86
李会梅,刘 刚,马殿旭,欧全宏,于海超,刘 艳.?中国农学通报,2015,31(32):?81-86
24?Haris P I. Biochim. Biophys. Acta,2013,1828(10): 2265-2271
25?Guerrero P,Kerry J P,De la Caba K. Carbohyd. Polym.,2014,111(6): 598
26?WANG Xiao-Long,LIU Gang,ZHAO Xing-Xiang,OU Quan-Hong,HAO Jian-Ming. Journal of Light Scattering,2014,26(4): 406-410
王小龍,刘 刚,赵兴祥,欧全宏,郝建明.?光散射学报,2014,26(4): 406-410
27?MA Dian-Xu,LIU Gang,OU Quan-Hong,YU Hai-Chao,LI Hui-Mei. Spectroscopy and Spectral Analysis,2016,36(7): 2104-2110
马殿旭,刘 刚,欧全宏,于海超,李会梅.?光谱学与光谱分析,2016,36(7): 2104-2110
28?Warren F J,Butterworth P J,Ellis P R. Biochim. Biophys. Acta,2013,1830(4): 3095-3101
29?Peets P,Leito I,Pelt J,Vahur S. Spectrochim. Acta A,2017,173: 175-181
- 躬身教坛勤耕耘?注入活水更哺苗
- 浅析如何提高小学语文阅读教学的有效性
- 部编本初中写作教材分析
- “欲学诗,功夫在诗外”
- 评价作文选材须要注意的“问题”
- 作文评讲课初探
- 浅析网络语言对语文教学的影响
- 基于图尔敏论证模式的高中议论文写作研究
- 让民族精神在语文教学中熠熠生辉
- 从导游面试看中职语文教学应注意的问题
- 小学语文整本书阅读实践策略研究
- 写作是花,真情是根
- 试谈高中语文教学中批判性媒介素养的培养
- 从作文语文训练个案看训练的优化
- 刍议当前职业学校语文教学中专业的渗透
- 浅谈小学语文批注式阅读教学策略
- 优化小学生语文阅读能力的实践及思考
- 看小学语文实践课堂如何完败传统教学模式
- 质疑,让语文课散发魅力
- 以读促写厚积薄发推陈出新
- “角色扮演”落实小学语文阅读差异化教学具体案例分析
- 活用“引子”文本提高阅读能力
- 主题引领阅读
- 基于儿童立场 畅享本真作文
- 关于小学高年级学生写作能力的培养
- pore's
- pores
- pore²
- pore¹
- poring
- pork
- porkier
- porkies
- porkies'
- porkiest
- porkiness
- porkinesses'
- porkinesses
- porkiness's
- porkish, porklike
- porkless
- porks
- porky
- porky's
- pornographic
- pornographically
- pornographies'
- pornographies
- pornography
- pornography's
- 花剌子模
- 花剌子米
- 花前月下
- 花前月下散步
- 花剑
- 花剑刃
- 花功
- 花包袱
- 花包谷
- 花匠
- 花匠捧仙人球——扎手
- 花十子
- 花卉
- 花卉引人伤感
- 花卉草木
- 花博会
- 花卷
- 花厅
- 花历
- 花去的钱财
- 花县
- 花又不损,蜜又得成
- 花友
- 花发多风雨,人生苦别离
- 花发多风雨,人生足别离