陈飘飘 邢怡晨 刘洋 郑姗 黄朝表

摘 要 建立了基于DNA 量子点(DNA QDs)与聚多巴胺(PDA)荧光共振能量转移(FRET)检测半胱氨酸的方法。DNA QDs发射的荧光被PDA分子吸收,发生FRET,导致DNA QDs的荧光猝灭,使DNA QDs处于荧光“关闭”状态。当存在半胱氨酸时,从多巴胺(DA)向PDA的自发氧化聚合反应将被阻断,使DNA QDs的荧光恢复,处于荧光“开启”状态,且DNA QDs荧光的恢复程度与溶液中半胱氨酸的浓度相关,基于此构建了半胱氨酸荧光传感器。检测半胱氨酸的线性方程为y=0.0181x-0.0185,线性范围为10.0~100.0 μmol/L,检出限为1.7 μmol/L(S/N=3,n=10),此传感器对半胱氨酸具有良好的选择性,常见氨基酸及生物硫醇小分子均无干扰。将本方法用于人尿样中半胱氨酸的测定,回收率为98.6%~105.9%。
关键词 DNA 量子点; 共振能量转移; 聚多巴胺; 半胱氨酸
1 引 言
半胱氨酸(Cys)是人体必需的一种含巯基的氨基酸,人体内半胱氨酸的含量被认为是疾病诊断的重要指标。半胱氨酸缺乏可导致多种疾病,如儿童生长缓慢、头发变色、水肿、嗜睡、肝损伤、肌肉和脂肪损失以及皮肤损伤等[1,2]。
目前,检测半胱氨酸的常用方法有光电化学分析法[3,4]、比色法[5,6]、电化学分析法[7]、高效液相色谱法(HPLC)[8]和荧光分析法[9,10]。然而,因半胱氨酸本身无紫外吸收,故高效液相色谱法需柱前衍生后再进行测定,操作复杂,且衍生效果不佳; 光电化学分析法及电化学分析法耗时长; 比色法的灵敏度不高。荧光分析因具有灵敏度高、设备简单、操作方便等优点而受到越来越多的关注。
量子点(QDs)因其独特的光学特性、良好的水溶性和生物相容性等引起了研究者的关注[11,12], 已广泛应用于金属离子[13]和生物小分子[14]测定及细胞成像[15]等领域。其中,无机金属半导体量子点虽具有高量子产率和良好的光学稳定性,但重金属(Pb\,Te\,Cd等)离子的高细胞毒性和潜在环境危害,使其应用受限[16]; 碳量子点(CQDs)表现出强光致发光、高化学惰性、良好的水溶性、低细胞毒性、优越的光稳定性等优点,且易实现绿色合成,是无机金属半导体量子点的理想替代物[17]。最近,Guo等[18]在相对温和的条件下通过DNA自组装制备了一系列DNA量子点。研究证明,由于DNA量子点富含的胞嘧啶碱基对的堆叠可形成sp2碳样中心,以此为发色团发射荧光,且同时克服了无机半导体量子点和CQDs的缺点[19~22]。
多巴胺(DA)是儿茶酚胺神经递质,在弱碱性条件下可被空气或溶解氧氧化成多巴胺醌,并可在水溶液中自聚合形成一系列具有不同分子量的低聚物。同时,多巴胺、多巴胺醌及其低聚物在溶液中自组装,通过各种非共价键形成不同结构的组装体,统称聚多巴胺(PDA)[23]。因PDA较宽的紫外-可见吸收光谱,使其成为一种应用广泛的荧光猝灭剂。Qiang等[24]研究了多巴胺纳米球的荧光猝灭能力,发现猝灭能力与氧化石墨烯相当,猝灭作用是通过能量转移或电子转移实现的。近年来,基于PDA与染料标记的DNA的结合,已开发了DNA[25]、ATP[26]、癌细胞[27]等的测定方法。据报道,某些还原性物质的存在,可有效抑制多巴胺的自发氧化聚合,从而有效抑制荧光猝灭效应的发生[28]。Ma等[29]报道了一种基于染料标记的ssDNA与PDA之间发生的荧光共振能量转移(FRET)效应,还原剂的存在使ssDNA的荧光恢复,建立了一种检测还原剂的新型荧光分析方法。
本研究设计了一种基于DNA [email protected]的荧光共振能量转移(FRET)的半胱氨酸荧光传感器。PDA的NH2与DNA QDs的COOH之间的共价键作用可将DNA QDs组装在PDA表面,并产生FRET,导致DNA QDs的荧光猝灭,使DNA QDs处于荧光“关闭”状态; 而半胱氨酸存在时,可以有效地抑制从DA向PDA的自发氧化、聚合、自组装,从而抑制DNA QDs与PDA之间的FRET,使DNA QDs处于荧光“开启”状态,实现了半胱氨酸的定量检测。
2 实验部分
2.1 仪器与试剂
RF-5301PC型荧光分光光度计、Kratos Axis ULTRA X射线光电子能谱仪(日本岛津公司); LZMBDA 950型紫外分光光度计(珀金埃尔默股份有限公司); 1810D 型分析电子天平(德国赛多利斯公司); JEOL-2100F型透射电子显微镜(TEM,日本电子株式会社); Thermo NEXUS 670型傅里叶变换红外光谱仪(美国赛默飞世尔公司); Plus-E3-20TH超纯水器(南京易普易达公司)
半胱氨酸(Cys)、葡萄糖(C6H12O6)、丙氨酸(Ala)、蛋氨酸(Met)、甘氨酸(Gly)、谷氨酸(Glu)、瓜氨酸(Cit)、精氨酸(Arg)、鸟氨酸(Orn)、色氨酸(Try)、缬氨酸(Val)、组氨酸(His)、多巴胺盐酸盐(DA)、三羟甲基氨基甲烷(Tris)、D,L-青霉胺(PA)、D-青霉胺(D-PA)、二硫苏糖醇(DTT)、3-巯基丙酸(MPA)、2-巯基乙酸(MAA)、2-巯基乙醇(MCE)(分析纯,阿拉丁公司); 鲑精低分子量双链DNA(Sigma-Aldrich公司)。实验用水均为超纯水。
2.2 DNA QDs的制备
采用水热法制备DNA QDs[18]。将双链DNA溶解于水中,配成2.5 g/L的溶液。將DNA溶液转移到聚四氟乙烯(Teflon)衬里的高压釜中,160℃水热反应4 h,冷却至室温,即获得DNA QDs。对DNA QDs进行形貌、成分以及光谱表征。
2.3 DNA QDs的荧光猝灭效应
将100 μL不同浓度(0.0、0.5、1.5、2.5、5.0、10.0和20.0 mmol/L)的DA溶液与400 μL 2.5 g/LDNA QDs溶液混合,并用10.0 mmol/L Tris-HCl缓冲液(pH 8.7)稀释至4.0 mL,超声1 h后,测定荧光光谱和紫外-可见吸收光谱。另外,为了研究Cys对PDA导致的DNA QDs荧光猝灭的抑制作用,将不同浓度的Cys同时加入上述荧光猝灭体系中,测定荧光光谱。
2.4 半胱氨酸的测定
将不同浓度的Cys溶液与400 μL 2.5 g/L DNA QDs溶液混合,加入100 μL 2.5 mmol/L DA溶液,用Tris-HCl缓冲液稀释至4.0 mL。反应1 h后,选择激发波长为367 nm,发射波长为455 nm, 测定DNA QDs的荧光强度。
3 结果与讨论
3.1 DNA QDs和PDA的表征
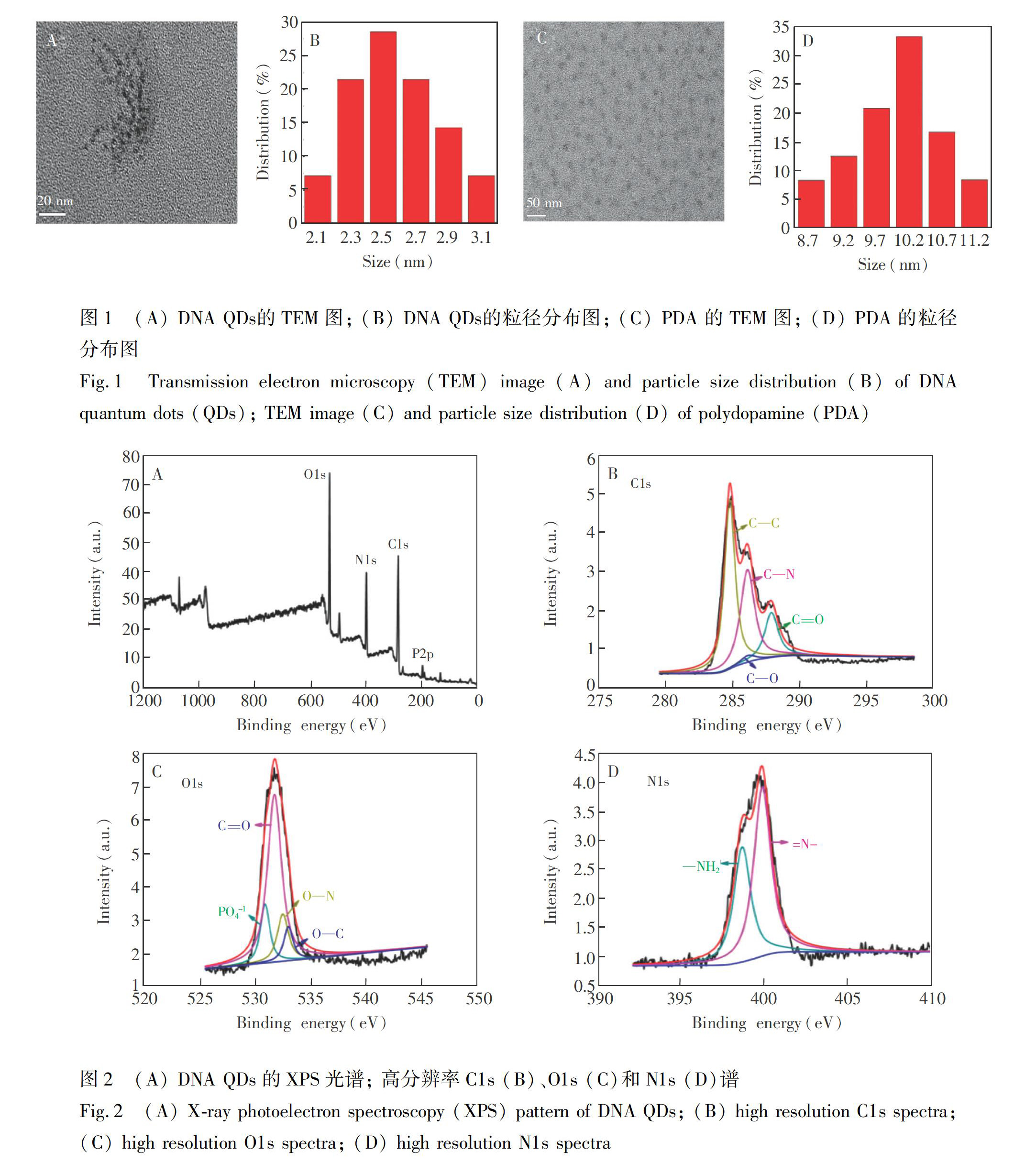
图1A和1C分别为DNA QDs和PDA的透射电镜 (TEM) 图。DNA QDs和PDA在水中均具有良好的分散性,平均粒径分别约为2.5 nm (图1B)和10.2 nm (图1D)。图2A为DNA QDs的X射线光电子能谱(XPS)图,位于284.57、405.82、531.42和139.72 eV处的谱峰分别为C1s、N1s、O1s和p2p特征峰。图2B为高分辨率C1s光谱,在284.7、286.0、286.2和287.8 eV处的4个峰分别归属于CC、 CN、 CO和CO键。图2C为高分辨率O1s光谱,在530.9、531.9、532.5和533.0 eV处的4个特征峰分别归属为PO-4、CO、 ON和CO[18,19]。图2D为高分辨率N1s光谱,在399.9和398.7 eV处的特征峰可分别归属因于N和NH2。XPS表征结果证实,DNA QDs表面包含丰富的含氧和含氮基团。因此,DNA QDs可通过共价键结合组装在PDA表面[30]。
3.2 DNA [email protected]的表征
由DNA [email protected]的TEM图(图3A)可见,DNA [email protected]在水中分散良好,平均粒径约为14.4 nm(图3B)。由图3A可见,与DNA QDs相比,DNA [email protected]粒径略有增大,证明DNA QDs结合在PDA表面。图4中曲线a和b分别为DA和DNA [email protected]的红外光谱图, DA和DNA [email protected]在3500~3100cm-1均出现了NH和OH键伸缩振动的强吸收峰,以及2970和 2885 cm-1附近的CH键伸缩振动的弱吸收峰,且DNA [email protected]的吸收更强。另外,在500~1700 cm-1之间,吸收峰发生了很大改变,多巴胺分子的特征吸收峰几乎完全消失,这是由于PDA和DNA [email protected]的生成导致DA分子的精细结构消失[33],进一步证明DNA [email protected]的形成。
3.3 PDA和DNA QDs的光谱性质
图5中曲线a、b和c分别为PDA的吸收光谱和DNA QDs的激发和发射光谱。DNA QDs最大激发波长为367 nm,最大发射波长为455 nm,发射蓝色荧光。PDA在可见区有连续的吸收,可与DNA QDs发生FRET效应,导致DNA QDs的荧光猝灭[31]。
3.4 DNA QDs荧光猝灭及抗猝灭研究
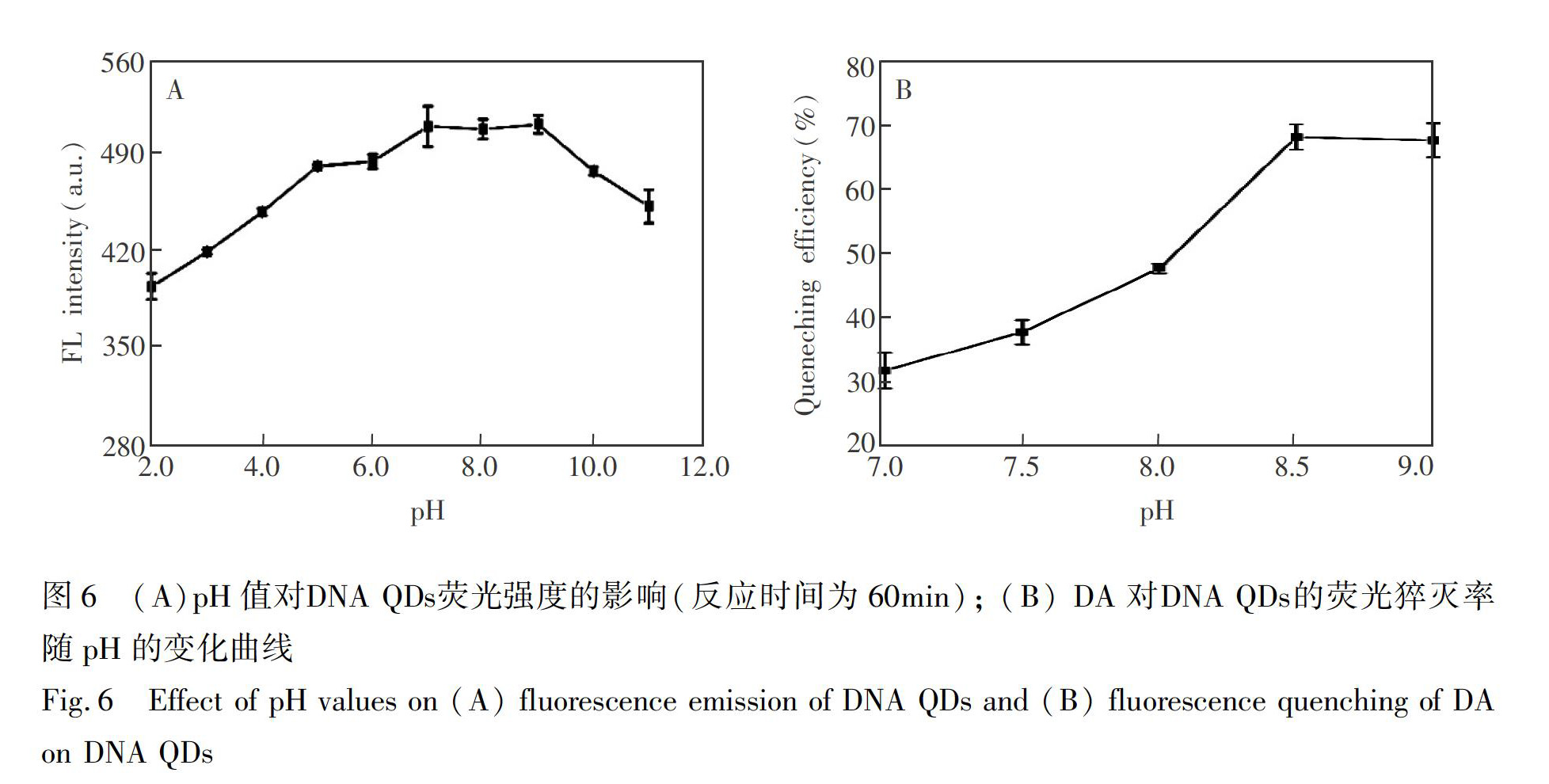
3.4.1 pH值的影响 图6A为pH值对DNA QDs荧光性能的影响。当pH=7.0~9.0时,DNA QDs的荧光强度基本不随pH值变化。图6B为DA对DNA QDs的荧光猝灭率随pH值变化的曲线。结果表明,当pH=8.5时,基本达到猝灭平衡,故选择Tris-HCl(10 mmol/L)缓冲溶液(pH=8.7)进行后续实验。
3.4.2 DA浓度和反应时间对DNA QDs荧光猝灭的影响 随DA浓度增大,对DNA QDs的荧光猝灭不断增强,这是由于DNA QDs连接到PDA表面后,发生FRET所致[34]。当DA浓度为2.5 mmol/L时,猝灭率达最大。后续实验选择DA的猝灭浓度为2.5 mmol/L。 随DA与DNA QDs反应时间延长,猝灭率持续增大,在60 min时基本达到猝灭平衡。选择猝灭反应时间为60 min。
3.4.3半胱氨酸的抗猝灭效应 在pH 8.7的Tris-HCl缓冲液中,随反应时间的延长,DA溶液的吸收增强,表明溶液中氧化产物和低聚物增加。当Cys浓度为0.0 μmol/L时,DNA QDs的荧光随反应时间延长而持续降低,即猝灭效率不斷增强; 当Cys浓度为100.0 μmol/L时,DNA QDs的荧光强度基本不随反应时间变化,即PDA对DNA QDs荧光的猝灭得以抑制。这是由于Cys的存在抑制了DA的氧化和聚合,从而抑制了DNA [email protected]体系的FRET效应,使DNA QDs处于荧光“开启”状态。
3.5 半胱氨酸的测定
在最佳实验条件下,DNA QDs和DA(2.5 mmol/L)的混合体系中,随着Cys浓度增加,DNA QDs荧光逐渐恢复(图7A),且DNA QDs的荧光恢复率与Cys浓度满足下述方程:
其中, F和F0分别为存在Cys和不存在Cys时DNA QDs的荧光强度,k为猝灭常数,c为Cys的浓度。
如图7B所示,荧光恢复率与Cys浓度在10.0~100.0 μmol/L范围内呈线性关系,线性方程为y=0.0181x-0.0185(R2=0.9962),检出限(LOD)为1.7 μmol/L(S/N=3, n=10)。将本方法与文献方法进行比较(表1),结果表明,本方法的灵敏度优于或相当于文献方法。
3.6 荧光探针的选择性
為了考察荧光探针对Cys的选择性,选择100 μmol/L Cys 与100 μmol/L氨基酸、生物硫醇小分子和葡萄糖等潜在干扰物质进行检测。如图8所示,这些氨基酸和葡萄糖对此荧光探针的干扰均可忽略,对DNA QDs的荧光光谱几乎没有影响。
3.7 实际样品分析
利用DNA [email protected]荧光探针测定了人体尿液样品中Cys含量。尿样由两名健康志愿者提供,对尿样进行简单的离心和过滤处理,采用本方法进行测定,测定结果如表2所示,加标回收率为98.6%~105.9%,表明本方法具有良好的实用性。
References
1 Hirai T, Kanda T, Sato K, Takaishi M, Nakajima K, Yamamoto M, Kamijima R, DiGiovanni J, Sano S. J. Immunol., 2013, 192(10): 4805-4811
2 Weerapana E, Wang G C, Simon G M, Richter F, Khare S, Dillon M B D, Bachovchin D A, Mowen K, Baker D, Cravatt B F. Nature,? 2010,? 468(7325): 790-795
3 Shen Q M, Jiang J Y, Liu S L, Han L, Fan X H, Fan M X, Fan Q L, Wang L H, Huang W. Nanoscale,? 2014,? 6(12): 6315-6321
4 Long Y T, Kong C, Li D W, Li Y, Chowdhury S, Tian H. Small,? 2011,? 7(12): 1624-1628
5 Li M, Wu X M, Wang Y, Li Y S, Zhu W H, James T D. Chem. Commun.,? 2014,? 50(14): 1751-1753
6 Chen S H, Chi M Q, Zhu Y, Gao M, Wang C, Lu X F. Appl. Surf. Sci.,? 2018,? 440: 237-244
7 Selvarajana S, Allurib N R, Chandrasekharc A, Kim S J. Biosens. Bioelectron.,? 2017,? 91: 203-210
8 Pfeiffer C M, Huff D L, Gunter E W. Clin. Chem.,? 1999,? 45(2): 290-292
9 Huang S, Yang E L, Yao J D, Liu Y, Xiao Q. Anal. Chim. Acta,? 2018,? 1035: 192-202
10 Ma Y X, Zhao Y, Xia L L, Huang J X, Gu Y Q, Wang P. Anal. Chim. Acta,? 2018, 1035: 161-167
11 Michalet X, Pinaud F F, Bentolila L A, Tsay J M, Doose S, Li J J, Sundaresan G, Wu A M, Gambhir S S, Weiss S. Science,? 2005,? 307(5709): 538-544
12 Alivisatos A P, Gu W W, Larabell C. Annu. Rev. Biomed. Eng.,? 2005,? 7(7): 55-76
13 Kim K, Kim J. J. Nanosci. Nanotechnol.,? 2018,? 18(2): 1320-1322
14 Lin D M, Su Z Q, Wei G. Mater. Today,? 2018,? 7:? 76-83
15 Joel P, Zhili P, Roger L. Molecules,? 2018,? 23(2): 378-383
16 Himmelstoss S F, Hirsch T. Methods Appl. Fluoresc.,? 2019, 7(2): 022002
17 Behboudi H, Mehdipour G, Safari N, Pourmadadi M, Saei A, Omidi M, Tayebi L, Rahmandoust M. Phototropism,? 2019, 104: 145-179
18 Guo C X, Xie J L, Wang B, Zheng X T, Yang H B, Li C M. Sci. Rep.,? 2013,? 3(10):? 2957
19 Hong Q, Zhang L L, Bai J M, Liu Z C, Liang R P, Qiu J D. Biosens. Bioelectron.,? 2015,? 74:? 886-894
20 Song T, Zhu X F, Zhou S H, Yang G, Gan W, Yuan Q H. Appl. Surf. Sci.,? 2015,? 347: 505-513
21 Kuang L, Cao S P, Zhang L, Li Q H, Liu Z C, Liang R P, Qiu J D. Biosens. Bioelectron.,? 2016,? 85: 798-806
22 Cheng G F, Zhang W B, Zhou Y, Ge Q F, Huang C B. Anal. Methods,? 2015,? 7(15): 6274-6279
23 Choi C K K, Li J M, Wei K C, Xu Y J, Ho L W C, Zhu M L, To K K W, Choi C H J, Bian L M. J. Am. Chem. Soc.,? 2015,? 137(23): 7337-7346
24 Qiang W B, Hu H T, Sun L, Li H, Xu D K. Anal. Chem.,? 2015,? 87(24): 12190-12196
25 Li W, Dong Y F, Wang X, Li H, Xu D K. Biosens. Bioelectron.,? 2015,? 66: 43-49
26 Liu Q, Pu Z H, Abdullah M A, Abdulrahman O A Y, Sun X P. Sens. Actuators B,? 2014,? 191: 567-571
27 HAN Yu-Ping, ZHAN Lin, LI Zhen, HU Cheng-Guo, LIU Zhi-Hong. Chinese J. Anal. Chem.,? 2018,? 46(8): 1178-1185
韓玉平, 谌 林, 李 贞, 胡成国, 刘志洪. 分析化学, 2018,? 46(8): 1178-1185
28 Wang D, Chen C, Ke X B, Kang N, Shen Y Q, Liu Y L, Zhou X, Wang H J, Chen C Q, Ren L. ACS Appl. Mater. Interfaces,? 2015,? 7(5): 3030-3040
29 Ma S S, Qi Y X, Jiang X Q, Chen J Q, Zhou Q Y, Shi G Y, Zhang M. Anal. Chem.,? 2016,? 88(23): 11647-11653
30 Jiang Y T, Tang Y G, Miao P. Nanoscale,? 2019,? 11: 8119-8123
31 Wang M K, Wang S, Su D D, Su X G. Anal. Chim. Acta,? 2018, 1035: 184-191
32 Chi M Q, Zhu Y, Jing L W, Lu X F. Anal. Chim. Acta,? 2018, 1035: 146-158
33 Shen Q M, Jiang J Y, Liu S L, Han L, Fan X H, Fan M X, Fan Q L, Wang L H, Huang W. Nanoscale,? 2014,? 6(12): 6315-6321
34 Feng T, Chen Y, Feng B B, Yan J L, Di J W. Spectrochim. Acta A,? 2019,? 206: 97-103
35 Zhang H Y, Jia Z H. Sensors,? 2017,? 17(3): 520-530
Abstract A method for detecting cysteine based on fluorescenceresonance energy transfer (FRET) between DNA quantum dots (QDs) and polydopamine (PDA) was developed. Since the fluorescence emitted by DNA QDs was absorbed by the PDA molecule, FRET occurred, resulting in fluorescence quenching of DNA QDs, and leaving the DNA QDs in a fluorescent "off" state. In the presence of cysteine, the spontaneous oxidative polymerization from dopamine (DA) to PDA was blocked, the fluorescence of DNA QDs was restored, and the fluorescence was "on" state. Based on this, a cysteine fluorescence sensor was developed. The sensor had good selectivity to cysteine, and there was no interference between common amino acids and small biothiol molecules. The linear equation was y=0.0181x-0.0185 in linear range of 10.0-100.0 μmol/L. The limit of detection (LOD) was 1.7 μmol/L (S/N=3). The method was successfully applied to determination of cysteine in human urine samples, with recoveries of 98.6%-105.9%.
Keywords DNA quantum dots; Fluorescence resonance energy transfer; Polydopamine; Cysteine
- 库车县的机采棉应用技术推广与思考
- 提高农机修理质量之我见
- 如何提高农机监理档案规范化管理水平
- 手扶拖拉机事故高发原因分析与预防措施
- 当前农机化发展中存在的问题及对策
- 农业机械的高效使用及资源配置分析
- 农用汽车驾驶安全问题探析
- 农机推广中存在的问题及解决措施
- 农机推广在农业机械化进程中的作用
- 农业机械管理中存在的问题及解决措施
- 抓好农机新设备推广的建议
- 玉米种植技术推广的意义及途径
- 农机监理工作的重要性
- 微耕机在农田中的使用与推广
- 农业生产中农机技术的推广与创新
- 水稻全程机械化发展中存在的问题及解决措施
- 农机推广在推进农业机械化进程中的作用
- 新时代阿荣旗农机发展、推广的思考
- 对“放管服”改革之下基层农机监理工作的探索
- 对大安市农业机械化水平近30年变化的思考
- 淮南市现代农机安全监理技术装备建设的思考
- 新形势下农机驾驶员培训的思考
- 机械制图教学现状分析及教改思路研究
- 农业机械实训教学解决方案
- 柴油机体组件常见损伤与维修技术要求
- swordfishing
- swordless
- sword-like
- swordlike
- swords
- swore
- sworn
- sworn²
- sworn¹
- swot
- swots
- swotted
- swotter
- swotters
- swotting
- swotty
- swot²
- swot¹
- swum
- swung
- sycamore
- sycamores
- sycomores
- sycophancy
- sycophant
- 行进快速
- 行进或出游时所搭的蓬帐
- 行进时后面扬起的尘
- 行进时接连不断,前后紧跟
- 行进的样子
- 行进的程度
- 行进的船
- 行进的车
- 行进艰难的样子
- 行进迅速
- 行远升高
- 行远必自迩,登高必自卑
- 行远自迩
- 行迟走慢
- 行述
- 行迹
- 行迹与外界隔绝
- 行迹,踪迹
- 行逆
- 行途
- 行途中感到疲倦
- 行速
- 行遍天下路,吃遍天下亏
- 行道
- 行道树